产胞外多糖菌株的筛选及对水体净化的影响
2020-02-21商玉莽魏淑珍
李 辉,王 颖,商玉莽,魏淑珍
(1.衡水学院 a.湿地保护与研究中心;b.电子信息工程学院,河北 衡水 053000 2.衡水市环境监控中心,河北 衡水 053000)
微生物胞外多糖(EPS)是微生物在生长代谢过程中分泌到细胞壁外的糖类高聚物,是一种次级代谢产物,由单一的或多种的单糖和糖类衍生物单元组成[1]。微生物多糖应用于土壤结构改良正日益受到人们的关注[2-3],微生物在溶解磷中的作用相关研究也越来越广泛[4],植物在水体净化中的研究更是日益凸显[5-6]。本研究以衡水市区滏阳河水上生态浮床为载体,研究产胞外多糖微生物与植物的联合作用,促进水生植物对水体的净化作用。
1 材料与方法
1.1 主要仪器与试验材料
主要仪器:超净工作台BJ-2CD,生化培养箱SPX-150B-Z,高速冷冻离心机GL-20G-H,T-9 紫外分光光度计,伯乐PCR 基因扩增仪,KDN-102c 定氮仪,消煮炉,500 mL 球形索氏提取器,30 mL 古氏坩埚,WXG-4 旋光仪。
分离培养基:葡萄糖50 g/L,酵母膏0.05 g/L,MgSO4·7H2O 0.7 g/L,KH2PO43.48 g/L,(NH4)2SO42 g/L,Na2HPO4·12H2O 1.5 g/L,pH 7.0,采用115 ℃灭菌30 min。
发酵培养基[7]:蔗糖40 g/L,酵母膏3 g/L,MgSO4·7H2O 2 g/L,KH2PO42.6 g/L,Fe SO4·7H2O 1 mg/L,CaCl20.5 g/L,pH 7.0,采用115 ℃灭菌30 min。
供试水生植物及载体:千屈菜,生态浮床。
试验容器:50 cm×40 cm×30 cm 玻璃缸若干。
1.2 试验方法
1.2.1 产胞外多糖菌株的分离筛选
1.2.1.1 样品采集 2018年4月采集滏阳河的水体样品。水样采集深度分别为水表层、水面下0.5 m、1 m,利用2 L 的有机玻璃采水器进行水样采集,将水样低温保存备用。
1.2.1.2 菌种筛选
将采集的新鲜水样1 mL 放于9 mL 无菌水中,混合均匀后做系列稀释,取稀释液0.2 mL 涂布于含有分离培养基的平板上,37 ℃培养48 h。用无菌牙签轻轻挑取菌落向外拉,能形成拉丝现象的单菌落即初步鉴定为产胞外多糖的菌株。初筛菌株保藏于LB 斜面上,置于4 ℃冰箱保存备用。
1.2.1.3 粗多糖的提取与测定
采用发酵培养基对筛选的菌株进行发酵培养。取5 mL 发酵液加入离心管内,10 000 r/min、于4 ℃离心15 min,除去菌体后取上清液加入三氯乙酸至质量分数10 %,反应12 h 后,10 000 r/min,于4 ℃离心45 min 除去蛋白,于上清液中加入3 倍体积的95 %的乙醇溶液,于4 ℃条件下浸提12 h,10 000 r/min、于4 ℃离心45 min 并收集沉淀,弃去上清液后,分别用丙酮、乙醚和无水乙醇洗涤一次后离心,将获得的最终沉淀用去离子水溶解定容即为粗多糖溶液[8]。
制作葡萄糖标准曲线及胞外多糖含量测定采用硫酸苯酚法[9]。
1.2.1.4 菌株的纯化和保存
用平板划线法将高产胞外多糖菌株纯化,在LB 平板上反复划线培养,直至长出形态一致的菌落为止。将单菌落制片、染色,观察菌体形态,以菌体形态是否一致为标准。对纯化的菌株,于斜面4 ℃保存,备用。
1.2.1.5 菌株的分子生物学鉴定
采用16S rDNA 鉴定方法。PCR 扩增产物由北京三博测序公司进行16S rDNA 序列测序。将所测得的16S rDNA 序列与NCBI 数据库中的已有序列进行同源性比较。
1.2.2 产胞外多糖菌株对水生植物水体净化的单因素试验
1.2.2.1 菌悬液的制备
将筛选到的产胞外多糖含量最高的作为优势菌株接种到LB 斜面培养基,37 ℃培养48 h 后,将菌苔轻轻刮起,洗入盛有100 mL 无菌水带玻璃珠的250 mL 三角瓶中,200 r/min 振荡15 min。取2 mL 菌悬液接种于盛有100 mL LB 液体培养基的250 mL 三角瓶中,于37 ℃、180 r/min 震荡培养48 h,以菌数达到108 cfu/mL 为宜,该菌液为接种试验样品,对照为同样条件下的不含菌的液体培养基。
1.2.2.2 接种量对水生植物水体净化效果的影响
选取同样体积的玻璃缸6 个,每个缸内装入采集自滏阳河富营养化区域的水样40 L。按9 株/m2的株密度同时栽种千屈菜,每株有浮体材料支撑,千屈菜栽种15 d 后,将优势菌株按1%、2%、3%、4%、5%、6%接种量分别喷施于不同玻璃缸的植物根部,20 d 后测定水体总氮、总磷和氨氮等水质指标。总氮测定采用过硫酸钾氧化-紫外分光光度法;总磷测定采用钼酸铵分光光度法;硝酸盐氮采用酚二磺酸光度法;亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法;氨氮测定采用纳氏比色法;COD 测定采用重铬酸钾法。
1.2.2.3 接种时间对水生植物水体净化效果的影响
分别在千屈菜栽种5 d、10 d、15 d、20 d、25 d 和30 d 后,于其根部喷施4 %的菌液,喷施后20 d分别进行水体总氮、总磷和氨氮等指标测定。
1.2.2.4 植株密度对水体净化效果的影响
千屈菜栽种株密度分别为3 株/m2、6 株/m2、9 株/m2、12 株/m2、15 株/m2、18 株/m2,以4%接种量分别喷施于不同玻璃缸的植物根部喷施后20 d 分别进行水体总氮、总磷和氨氮等指标测定。
1.2.3 菌株对水生植物水体净化效果影响的正交试验
根据单因素试验结果,以接种量(%)、接种时间即植株栽培时间(d)、植株密度(m2)为影响因素设计三因素三水平正交试验(L9(33))。以不接种的为对照,计算不同试验组总氮和总磷的降解率。接种量设计为2、3、4;接种时间设计为10、20、30;植株密度设计为6、9、12。
降解率(%)=[1-(试验样实测含量/对照样实测含量)]×100 %。
1.2.4 利用正交试验条件进行室内试验
利用正交试验结果,在最适条件下,合适接种量、合适的接种时间、合适的植株密度,根据各试验设计需求测定各种指标。本试验设计三组平行,计算结果为平均值。
1.2.4.1 菌株定植活菌数测定
接种15 d 开始第一次采集千屈菜根际微生物样品,每隔5 d 采集一次,共采集5 次。利用平板计数法测定植物根际细菌活菌数,以不接菌的为对照。
1.2.4.2 菌株对水生植物根系活力的影响
分别于接种后10 d、20 d、30 d 测定根系活力,根系活力的测定采用氯化三苯基四氮唑(TTC)法。
1.2.4.3 菌株对水生植物全氮全磷指标的影响
接种30 d 时同时测定根、茎、叶全N、全P 含量。全N 用凯氏定氮法,全P 用钒钼黄比色法。
1.2.5 菌株对水生植物水体净化室外试验
利用正交试验结果,2018年7月在滏阳河选择500 m2试验区,并利用防水布及重物悬挂(置入底泥)的形式进行防水围隔。利用合适接种量、选择相对比较合适的室外植株密度进行室外试验。菌种扩大培养用发酵液体培养基。发酵液做成冻干制剂备用。接种后28 d 内每7 d 测定一次水质指标,28 d 后每15 d 测定一次,共计测定6 次。
2 结果与分析
2.1 高产胞外多糖菌株的筛选
用1 g/L 葡萄糖溶液,分别制得质量浓度为0、20、40、60、80、100、120、140、160、180、200 mg/L 的葡萄糖溶液,利用蒽酮比色法,在600 nm 处比色,以空白做对照,以吸光度为纵坐标,葡萄糖浓度为横坐标,得标准曲线,结果如图1所示。通过分离筛选获得12 株具有黏性拉丝现象的单菌落。将初筛获得的菌株进行发酵培养,测定胞外多糖含量,结合复筛结果筛选出3 株多糖产量较高的菌株。命名为FY-14、FY-33 和FY-49。其中,产量最高的FY-33 发酵48 h 后,静置和摇床培养多糖产量可达 1 372.69 ~ 1 683.25 mg/L。同时,图2中表明,好氧条件更适合微生物产胞外多糖。

图1 葡萄糖标准曲线

图2 不同培养条件下复筛菌株胞外多糖产量
2.2 菌株分子生物学鉴定
高产胞外多糖菌株FY-33 与序列登录号为JF895489.1 的巨大芽孢杆菌的相似度为99.9%,因此判断FY-33 属于巨大芽孢杆菌类群(Bacillus megaterium strain)。
2.3 FY-33 接种量对水生植物水体净化效果的影响
FY-33 接种量对水生植物水体净化效果的影响见图3。图中A1 为总氮变化情况、A2 为总磷变化情况、A3 为氨氮变化情况。由图3可以看出,接种量为1%和2%时总氮、总磷和氨氮数值较高,3%时数值变小,之后变化较缓,3%接种量较为合适。

图3 不同接种量水质指标变化
2.4 FY-33 接种时间对水生植物水体净化效果的影响
FY-33 接种时间对水生植物水体净化效果的影响见图4。从图4可以看出,植物的栽培时间直接影响接种后对植物净化水体的作用。植物的栽培时间不同,根系发达程度不同,接种后的效果不同,合适的根系发达程度,化感效应明显,对菌株的吸附效果好,菌株的有机氮、磷转化能力通过与植物的相互作用,促进植物对水体的净化作用。图4表明植株栽培后20 d 为合适的接种时间。

图4 不同接种时间水质指标变化
2.5 植株密度对水体净化效果的影响
植株密度对水体净化效果的影响见图5。图5表明植株密度不同,对水体的净化能力不同,千屈菜栽种株密度达到9 株/m2时,总氮、总磷及氨氮含量都明显下降,表明植物净水能力显著提高,之后变化较小。9 株/m2的植株密度根系的覆盖度已基本合适,利于菌株附着和生长,从而提高植物的水体净化效果。

图5 不同植株密度水质指标变化
2.6 FY-33 对水生植物水体净化效果影响的正交试验结果
表1正交试验结果显示接种量为3%、接种时间为植物栽培后20 d、植株密度为12 株/m2的组合总氮降解率(%)最高,达到73%。该组合为总氮降解水体净化合适的处理条件。表2表明总磷降解的最佳组合与总氮降解的最佳组合结果一致,总磷降解率达到65%。由于植物自身有一定的净水能力,产多糖菌株与植物的协同作用可以显著增强植物的水体净化能力。
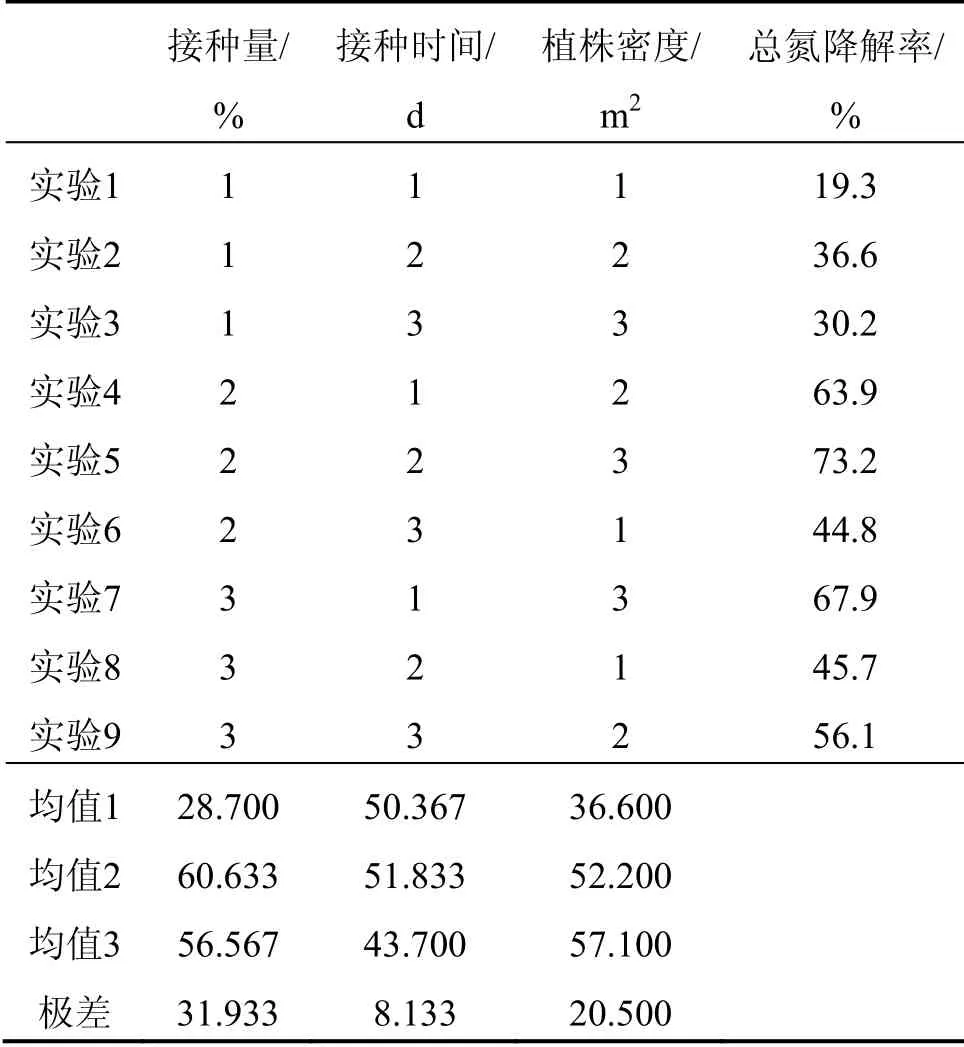
表1 总氮降解率直观分析表

表2 总磷降解率直观分析表
2.7 利用正交试验条件进行室内试验
在接种量为3 %、接种时间为植物栽培后20 d、植株密度为12 株/m2的条件下进行室内试验。
2.7.1 FY-33 定植活菌数测定 FY-33 定植活菌数测定结果见表3。表3中BM 为接种组,CK 组为不接菌的对照组。表3结果显示,接种组活菌数随着时间的延长有不同程度的增长,活菌中有大量的FY-33,因为其胞外多糖产出明显。活菌数比对照组增加了2~5 倍,对照组的活菌数随时间变化较小。说明FY-33 在千屈菜根际有很好的定植。

表3 千屈菜根际FY-33 活菌数
2.7.2 FY-33 对水生植物全氮全磷指标的影响
FY-33 对水生植物全氮全磷指标的影响见表4。表4表明,接种FY-33 菌株30 d 后千屈菜根、茎、叶各器官全N 含量和全P 含量明显高于对照组CK,叶较为明显,较对照全N 和全P 分别提高了31.5%、28.3%。说明千屈菜吸收了水体中更多的氮和磷,FY-33 产生的胞外多糖,一方面增加其在植物根系的定植,本实验结果还说明FY-33 促进植物对氮和磷的吸收,促进植物对水体的净化。
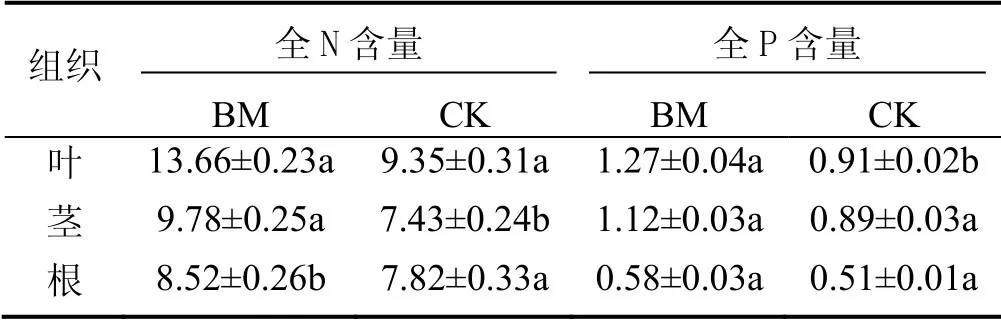
表4 千屈菜各器官全N 含量和全P 含量
2.7.3 菌株对水生植物水体净化
在围隔区内,根据水的体积将冻干制剂FY-33 以3%的接种量接入滏阳河水上生态浮床千屈菜根际,表5显示不同时间水体各指标呈现出随时间增加水质逐渐变好的趋势。与FY-33 的增殖促进植物对氮磷的吸收有关。在水体净化时,该类菌株适合在植物相对密集区使用。

表5 滏阳河水上生态浮床水体净化效果 mg/L
2.7.4 FY-33 对水生植物根系活力的影响
接种组BM 组在接种FY-33 不同的时间内根系活力明显高于对照CK 组。20 d 时已经比较明显,BM组达到1.26 mg/(g·h),20 d、30 d 根系活力分别提高45.2%和52.5%。说明FY-33 对千屈菜的根系活力有明显的促进作用。
3 讨论与结论
初级生产者与初级消费者是淡水生态系统结构的重要组成,是维持系统生产力、多样性和稳定性功能的基础。其中,高等水生植物和浮游植物作为河流和湖泊生态系统中的主要初级生产者,是维持湖泊生态结构和功能的重要组分。利用水生植物来降解净化水污染,已经在很多水体恢复试验中取得了显著成果。细菌在淡水生态系统尤其是富营养化河流和湖泊的物质分解和营养传递中起着重要作用,它们通过自身的生命活动影响和调节着水体的环境质量[11]。但由于水体的流动性,细菌在富营养化水体修复中的应用一直困扰着人们。本研究筛选到高产胞外多糖细菌巨大芽孢杆菌FY-33(Bacillus megaterium strain),摇床培养多糖产量可达1 683.25 mg/L。对其进行了水体净化条件、在水生植物千屈菜根际的定植及对其根系活力和全氮全磷的影响研究,正交实验结果显示:接种量为3%、接种时间为植物栽培后20 d、植株密度为12 株/m2的组合为水体净化最佳组合,总氮、总磷降解率最高,分别达到73.2%和65.4%。FY-33可以提高千屈菜的根系活力,接种20 d、30 d 根系活力分别提高45.2%和52.5%;FY-33 可以提高水生植物全氮、全磷含量,叶最明显较对照全N 和全P 分别提高了31.5%、28.3%。利用滏阳河生态浮床进行了菌株对水生植物千屈菜水体净化试验,滏阳河富营养化区域生态浮床千屈菜根部接种FY-33 菌株58 d 后,水质指标达到三类水的标准,水体净化结果与实验室结果一致。
本研究结果说明,胞外多糖可以促进FY-33 对千屈菜根系的吸附,同时,FY-33 自身可以对有机物进行降解,转化成植物易吸收的小分子物质,促进了植物对水体中氮磷的吸收,植物根系活力增高、全氮、全磷含量增加,对水体的净化效果增强。因此产胞外多糖细菌对植物净水有根系吸附的优势,以植物的根系为载体进行大量定植,克服细菌在流动环境中应用困难和植物对难降解有机物不易吸收的问题,形成微生物与植物净化水体的合力,提高水生植物水体净化能力。该技术可以在封闭或开阔的水域净化水体,应用前景非常广阔。
