施氮与水分胁迫对雪菊幼苗生长及生理的影响
2020-02-14李志元王亚楠秦亚楠邓霜霜褚佳瑶李志慧买尔丹买买提
李志元,江 虹,王亚楠,秦亚楠,余 婷,张 蒲,邓霜霜,褚佳瑶,李志慧,买尔丹·买买提,秦 勇
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
0 引 言
【研究意义】雪菊(CoreopsistinctoriaNutt.)是菊科两色金鸡菊属的一年生草本植物[1],有抗氧化等[2-7]效果显著,是一种高价值的保健饮品。水分是干旱地区植物生长与存活的限制性因子[8],新疆是雪菊栽培的主产区[1],属典型的干旱半干旱气候区,干旱成为限制植物生长发育的重要因素之一[9]。过度干旱会使土壤中氮循环率下降,减少植物的可利用性[10],破坏植物抗氧化系统、光合系统、荧光系统等。雪菊(CoreopsistinctoriaNutt.)主栽区位于新疆的干旱半干旱气候区,雪菊的生长受到水分和氮素的双重限制。研究雪菊幼苗期施氮对水分胁迫生长及生理响应变化,对新疆干旱地区雪菊的科学种植有实际意义。【前人研究进展】水、氮之间存在着显著的耦合效应,合理调控水、氮条件是改善作物抗旱能力及产量等指标的重要途径[11]。施氮可能使植物的生物量得到大量积累,可溶性糖、脯氨酸和丙二醛的含量均有所下降[12-13];施氮还能显著提高其在旱地的净光合速率、蒸腾速率,因水分胁迫所导致的水分利用率和产量的下降可以通过施用氮肥而得到补偿[14-15];此外,在保证植物充足水分的条件下施氮可在一定程度上改善植物的荧光系统,维持叶片较高的PSII活性和光化学活性,使得表观的化学电子传递效率与PSII量子产量得到增加,叶片能更好的进行光能的吸收,从而促进植物光合作用[16]。但也有研究表示,在干旱条件下施氮会造成植物的胁迫指数增加,其光合速率和Rubisco酶活性较之前相比会有所降低[17]。初始荧光(Fo)的上升是光系统II(PSII)反应中心失活的表现[18]。PSII量子产量(ΦPS II)即为非环式电子传递效率或光能捕获的效率,而电子传递效率(ETR)则是表观光合电子传递效率[19]。光化学猝灭系数(qP)表示的是PS II天线色素捕获的光能用于光化学电子传递的部分,非光化学猝灭系数(NPQ)则表示PS II天线色素吸收的光能不能用于光化学电子传递而以热的形式耗散掉的部分[19]。【本研究切入点】前期研究发现雪菊萌发期具有一定抗旱性[20],其生长受到氮素与水分的双重限制,而当前关于干旱条件下施氮对雪菊幼苗影响的研究鲜见报道。研究苗期干旱胁迫和施氮对雪菊生长、生理的影响。【拟解决的关键问题】采用盆栽控水处理方法,研究雪菊幼苗期(8叶1心)在不施氮、低氮、高氮条件及严重缺水、轻度缺水、正常灌水条件下的生长、生理响应。分析雪菊在应对干旱条件以及施用氮肥后的响应,为新疆干旱地区雪菊的科学种植提供理论依据。
1 材料与方法
1.1 材 料
供试雪菊种子采自新疆和田地区皮山县克里阳乡。
1.2 方 法
1.2.1 试验设计
新疆农业大学植物工厂工程技术研究中心进行盆栽试验。供试土壤为黑棕壤土,含有机质含量215.4 g/kg,有效磷316 mg/kg,速效钾353 mg/kg,水解性氮754.8 mg/kg。花盆规格为高20 cm,直径18 cm,选择充分风干并过筛的细土,去杂后每盆混入0.5 kg石英石装盆,每盆共计3 kg。2019年3月19日雪菊进行穴盘育苗,待雪菊生长至4叶期进行移栽,每盆定植1株健壮的雪菊苗。
试验采用随机区组设计,设置3个水分处理,用D1、D2、D3表示,分别为土壤相对含水量25%±5%(严重缺水)、50%±5%(轻度缺水)、75%±5%(正常灌水)。2019年5月4日在雪菊苗期(8叶1心)进行控水处理,将正常供水的植株停止供水,并使其土壤相对含水量自然减少至所设计的水分水平,保持其水分状态至8 d后取样。利用称重法对花盆中的水量进行补充。
根据姜雅爽等[21]关于雪菊盆栽试验的研究结果,随着氮浓度的不断增加,雪菊产量、品质指标持续走高,并在施氮水平为0.3 g/kg土时达最佳,设置0、0.1和0.3 g/kg土3个氮素水平,用N0(CK)、N1、N2表示;选用(NH4)2SO4作为肥源,基施50%,在控水期追施50%,试验共9个处理,每个处理30盆。
1.2.2 测定指标1.2.2.1 土壤相对含水量
每天傍晚20:00取土样,早上10:00进行补水,利用烘干法测定土壤相对含水量,对各处理相对含水量进行记录。在花盆内随机取3个点进行混样,利用80℃烘干箱工作24 h后计算其土壤相对含水量,每个处理随机选取15盆。
1.2.2.2 生长指标
分别在干旱处理前和处理结束后对雪菊株高进行测量,计算株高的增长量,并在取样时对雪菊生物量、地上部、地下部鲜重、根长、根冠比进行测定并记录。
1.2.2.3 叶绿素含量
参照邹琦[22]的方法,对叶片的叶绿素含量进行测定,每个处理重复3次。
1.2.2.4 脯氨酸、可溶性糖
脯氨酸含量按照Bates[23]方法,可溶性糖含量参照张振清[24]方法。
1.2.2.5 光合性能、叶绿素荧光参数
在处理之后第8 d的12:00~14:00使用LI-6400(美国LI-COR公司)便携式光合仪对雪菊第3叶片的光合参数进行测定,仪器使用开放式气路,内置光源,光强为 1 500 μmol/(s· m2)。测定时,每个叶片测定3次取平均值。
与光合参数测定同步,利用FMS2 调制式荧光仪(英国Hansatech公司)对雪菊叶片叶绿素荧光参数进行测定。每处理3次重复,每个叶片测定3次取其平均值。夹上叶片后,正对太阳光照射15 min,测定叶片在正常生长光强下的荧光值(Fs),利用强饱和脉冲光(4 000 μmol/(s· m2),脉冲时间为0.7 s),再测定光下最大荧光(Fm'),在暗适应环境下测定叶片初始荧光(Fo)。
利用强饱和脉冲光测定最大荧光(Fm)。PS II量子效率(ΦPS II)=(Fm'-Fs')/Fm';电子传递速率(ETR)=(Fm'-Fs)/Fm'×PAR×0.5×0.84;光化学猝灭系数(qP)=(Fm'-Fs)/(Fm'-Fo);非光化学猝灭系数 (NPQ)=(Fm-Fm')/Fm'[25]。
1.2.2.6 生理生化指标
超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用氮蓝四唑法。过氧化物酶(peroxidase,POD)活性的测定采用愈创木酚法。过氧化氢酶(catalase,CAT)活性的测定采用紫外吸收法。丙二醛(malondialdehyde,MDA)含量的测定采用硫代巴比妥酸法[22]。
1.3 数据处理
采用Excel 2010进行相关图标制作,利用SPSS 19.0进行单因素方差分析(one-way ANOVA)、皮尔逊(pearson)相关性分析。
2 结果与分析
2.1 水分胁迫与施氮对雪菊生长的影响
研究表明,雪菊株高增长量、根长、地上部鲜重、地下部鲜重、总生物量和根冠比均显著受到氮素和水分条件的影响(P<0.05)。在同一氮素水平下,随着土壤水分含量的提高,雪菊的株高增长量、根长、地上部鲜重、地下部鲜重、总生物量和根冠比呈现不断增长的态势;其中严重缺水(D1)时长势较弱,各项指标均显著低于正常灌水(D3)条件(P<0.05),在严重缺水时(D1)株高增长量仅为0.25 cm,比轻度缺水(D2)、正常灌水(D3)分别低1.91和4.06 cm;严重缺水(D1)时根长最小,为16.00 cm,正常灌水(D3)最长,为29.46 cm;正常灌水(D3)与严重缺水(D1)相比,地上部、地下部鲜重分别增加了75.7%、73.6%,总生物量增加了75.4%,根冠比增加50.7%;在严重缺水(D1)和轻度缺水(D2)条件下,低氮(N1)对幼苗生长无促进作用,高氮(N2)则可显著促进幼苗的生长(P<0.05);而在正常灌水(D3)条件下,低氮处理发挥着与高氮处理一样的对幼苗的促进作用。图1
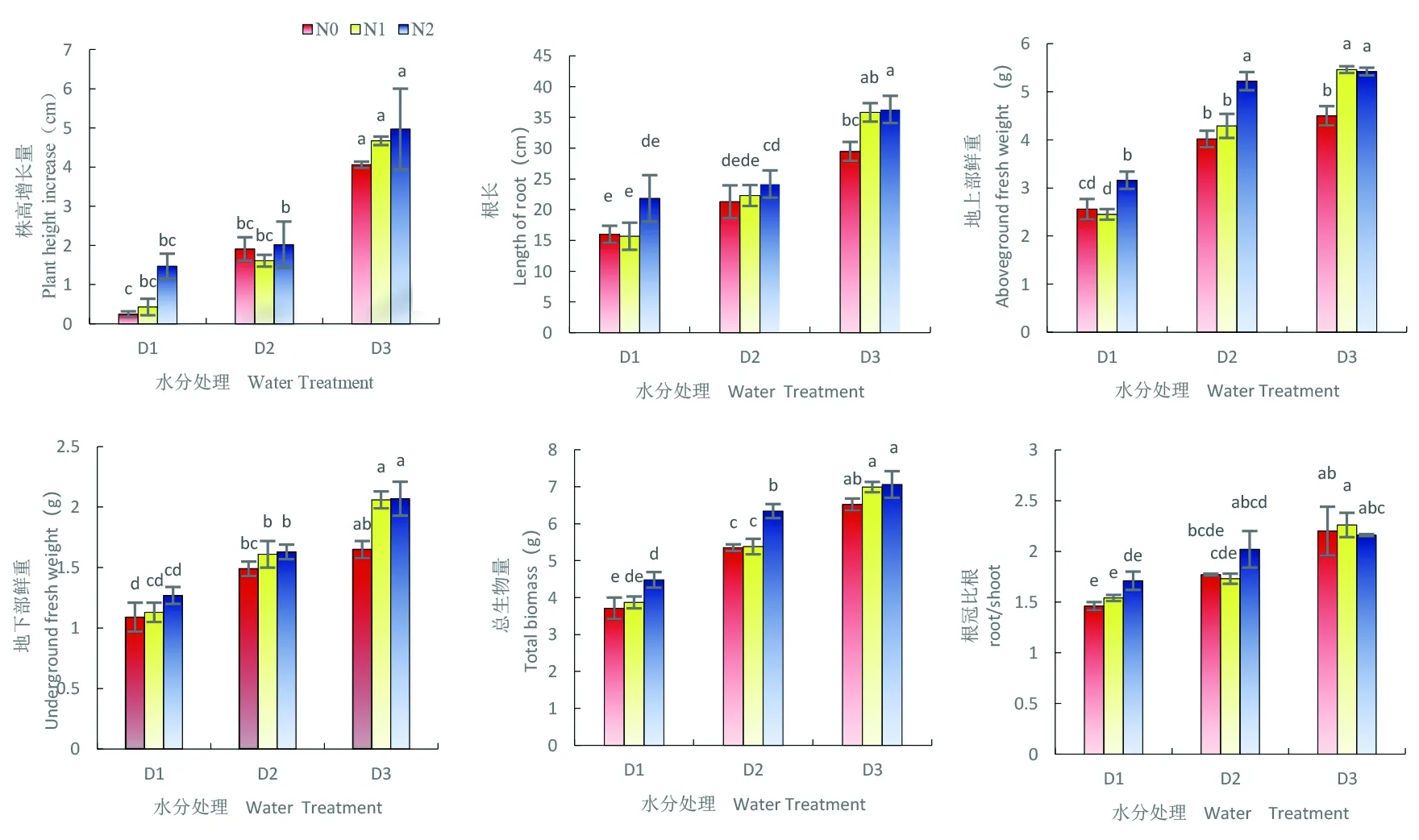
图1 苗期水分胁迫下施氮对雪菊生长指标变化
Fig. 1 Effect of nitrogen application on growth index ofCorepsistinctoriain seedling drought
2.2 水分胁迫与施氮对雪菊叶绿素含量的影响
研究表明,随着水分含量不断增加,叶绿素a、叶绿素b、总叶绿素含量呈现不断上升的态势,严重缺水(D1)和正常灌水(D3)间的差异达到显著性水平(P<0.05),水分在雪菊叶片进行叶绿素a、叶绿素b和总叶绿素含量积累的过程中发挥着重要作用。在严重缺水(D1)和轻度缺水(D2)处理下,低氮(N1)对叶绿素的积累无影响,但高氮可显著增加叶绿素含量(P<0.05);在正常灌水时(D3),施氮对叶绿素的积累作用最为显著,并在低氮(N1)达最大值。图2
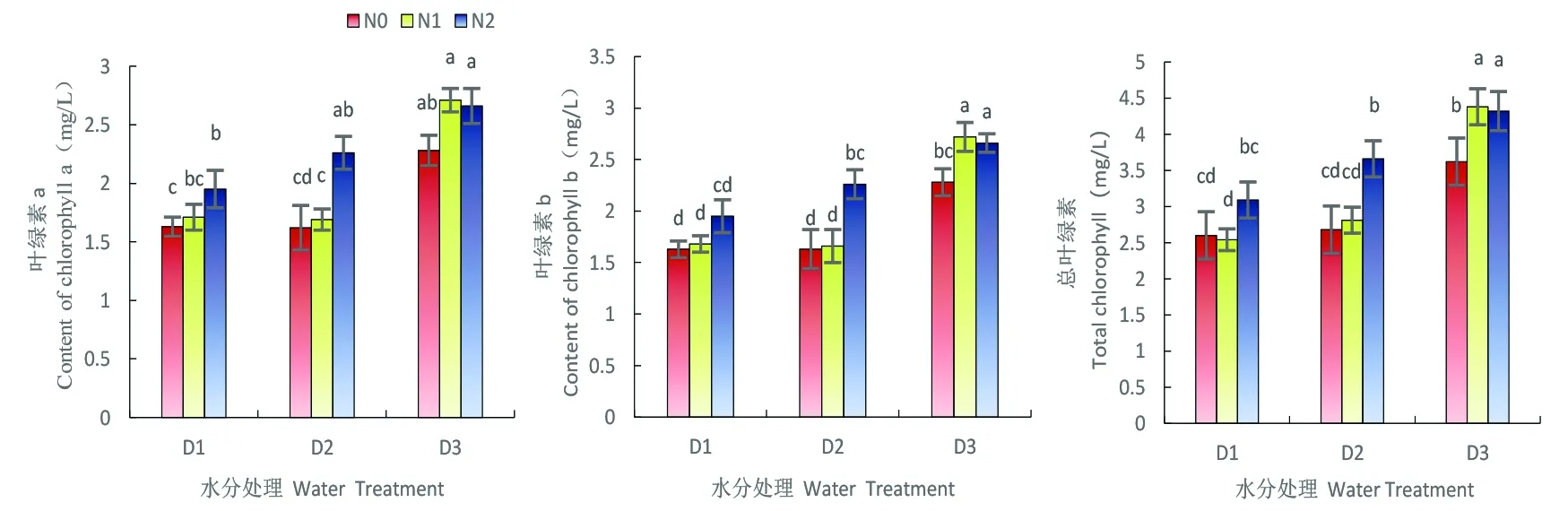
图2 苗期水分胁迫下施氮对雪菊叶绿素含量变化
Fig. 2 Effects of nitrogen application on the content of chlorophyll inCoreopsistinctoriaunder drought condition at seedling stage
2.3 水分胁迫与施氮对雪菊可溶性糖、脯氨酸的影响
研究表明,随着水分胁迫程度的不断加重,可溶性糖含量及脯氨酸含量也不断上升。严重缺水(D1)的可溶性糖含量最高为22.41 mg/g,比正常灌水(D3)条件下可溶性糖含量增加了56.61%(P<0.05),严重缺水(D1)的脯氨酸含量最高为160.86 μg/(gmass);比正常灌水(D3)条件增加了46.43%,当雪菊遭遇干旱胁迫时,通过增加渗透调节物质改善自身渗透调节能力,减缓自我损伤。与不施氮(CK)相比,高氮处理(N2)在不同水分条件下均可显著降低幼苗可溶性糖、脯氨酸的含量(P<0.05),而低氮(N1)处理只在正常灌水下(D3)对幼苗的可溶性糖、脯氨酸含量有降低作用(P<0.05)。图3
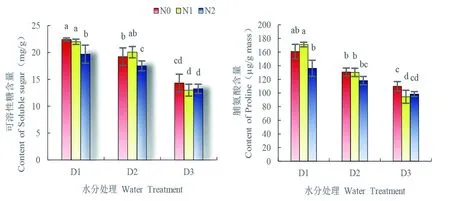
图3 苗期水分胁迫与施氮下雪菊可溶性糖含量、脯氨酸含量变化
Fig. 3 Effects of nitrogen application on soluble sugar content and proline content ofCoreopsistinctoriaunder drought condition at seedling stage
2.4 水分胁迫与施氮对雪菊光合特性的影响
研究表明,水分胁迫程度与净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)、水分利用效率(WUE)呈负相关。在严重缺水(D1)、轻度缺水(D2)时,Pn为正常灌水(D3)的20.1%、46.7%(P<0.05),Tr为正常灌水(D3)的24.4%、49.4%(P<0.05),在严重缺水(D1)时,Gs、Ci、WUE分别为正常灌水(D3)的55.9%、50.1%、21.6%(P<0.05),水分是影响雪菊进行充分光合作用的重要因子。
雪菊植株的各项光和参数均在高氮处理下(N2)得到了显著提升,与不施氮(CK)相比,高氮处理(N2)在正常灌水(D3)时使幼苗的Pn、Tr增加了33.1%、26.2%(P<0.05),在轻度缺水(D2)时,Gs、Ci、WUE增加了32.1%、41.3%、8.3%(P<0.05);而低氮处理(N1)在严重缺水(D1)、轻度缺水(D2)处理下对雪菊光合作用的各项指标无影响,在正常灌水(D3)处理时的结果与高氮处理下(N2)相似。图4
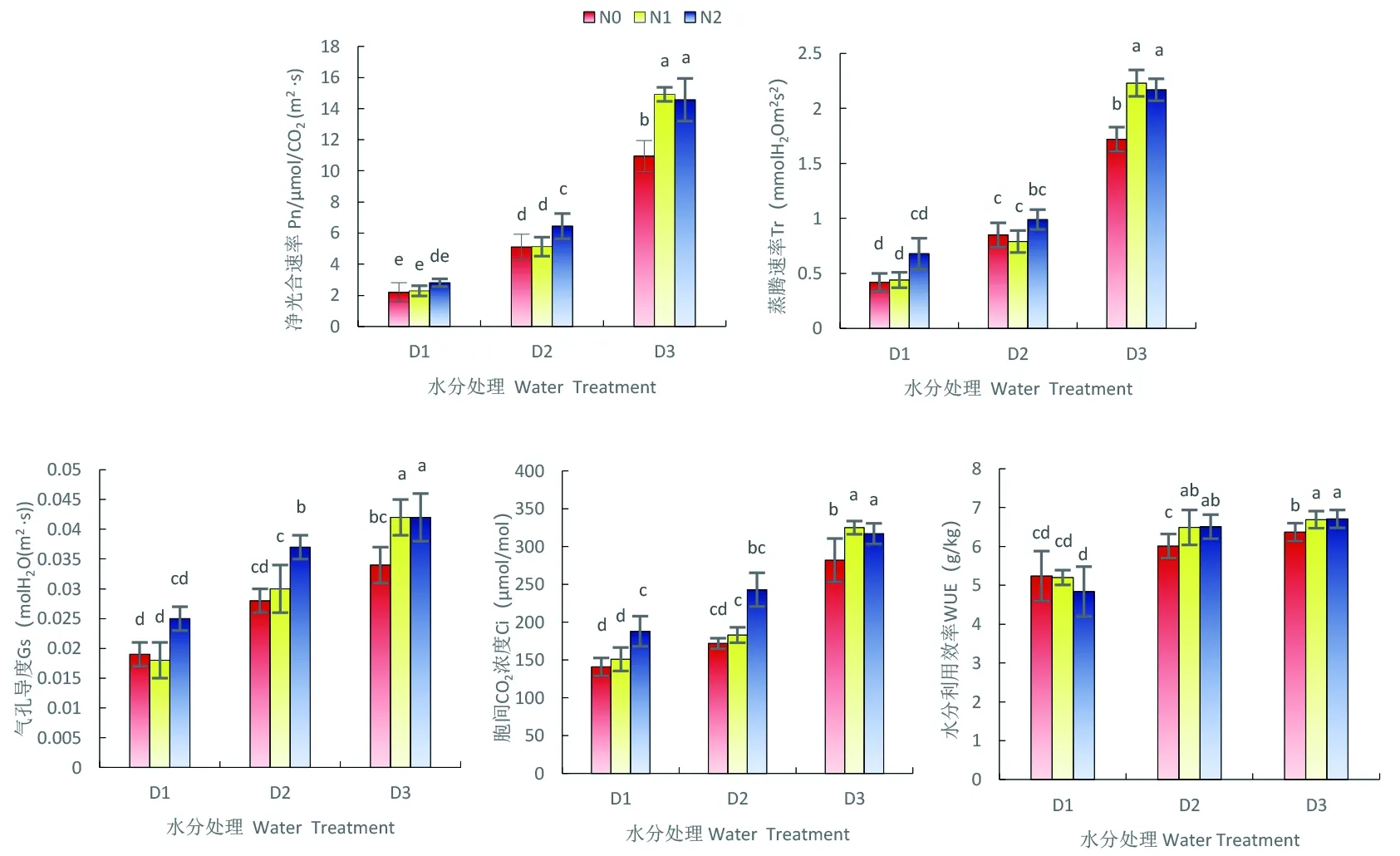
图4 苗期水分胁迫与施氮下雪菊光合特性变化
Fig. 4 Effects of nitrogen application on the photosynthetic characteristics ofCorepsistinctoriaunder drought condition at seedling stage
2.5 水分胁迫与施氮对雪菊叶绿素荧光参数的影响
2.5.1 初始荧光和最大光化学效率
研究表明,当雪菊水分胁迫加重后,Fo不断上升,在严重缺水(D1)时达到最大值,显著高于轻度缺水(D2)、正常灌水(D3)处理(P<0.05),施氮后Fo呈逐渐下降的趋势。PSII的最大光化学效率(Fv/Fm)随水分胁迫的减弱而呈现不断上升的态势,正常灌水(D3)显著高于严重缺水(D1)(P<0.05),水分对植株的光化学效率有较大影响,2种施氮水平均对不同水分胁迫处理下的Fv/Fm有促进作用(P>0.05)。图5
2.5.2 量子产量与电子传递速率
研究表明,随着水分胁迫水平的减缓,ΦPS II、ETR均呈现不断增加的趋势,严重缺水(D1)显著低于轻度缺水(D2)、正常灌水(D3)处理(P<0.05)。与不施氮(CK)相比,在正常灌水条件下,低氮(N1)与高氮处理(N2)均可提升ΦPS II、ETR,当水分含量较低时,高氮对ΦPS II、ETR有较小促进作用,未达到显著性水平(P>0.05)。
2.5.3 光化学猝灭系数与非光化学猝灭系数
研究表明,随着干旱水平的不断减缓,qP不断增加,在正常灌水(D3)时显著高于干旱处理(P<0.05),施氮可使干旱条件下的qP得到提升,在严重缺水(D1)时差异最大(P<0.05)。NPQ与qP呈现出相反的趋势,NPQ随着干旱程度的不断加剧而呈现上升的趋势,表现为严重缺水(D1)>轻度缺水(D2)>正常灌水(D3)。与不施氮相比,高氮水平可增加幼苗的qP系数(P<0.05),低氮水平未发挥任何作用,而当水分处理达正常灌水条件时,低氮、高氮处理对其均无促进作用(P>0.05)。施高氮可降低各处理条件下的NPQ系数,在正常灌水(D3)的下降幅度最大,为47.2%(P>0.05),低氮在缺水条件下对NPQ系数无影响,但在正常灌水下(D3)发挥了与高氮处理相似的作用。在充足的水分环境中施氮将更有效的促进植株对光能的吸收、提高光化学电子传递效率。图5
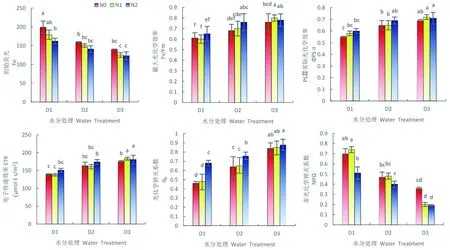
图5 苗期水分胁迫与施氮下雪菊叶绿素荧光参数变化
Fig. 5 Effect of nitrogen Application on chlorophyll fluorescence parameters ofCoreopsistinctoriaunder drought condition at Seedling stage
2.6 水分胁迫与施氮对雪菊抗氧化酶系统及MDA含量的影响
研究表明,SOD、POD、CAT活性及MDA含量均随着水分胁迫程度的增大而增大,抗氧化酶活性及MDA值在严重缺水时(D1)最高,轻度缺水(D2)次之、正常灌水(D3)最小。与不施氮(CK)相比,3个水分处理在施用高氮肥后的抗氧化酶活性及MDA含量均呈现大幅度下降趋势,但施用低氮后对幼苗抗氧化酶活性及MDA含量无影响。高氮肥的施用可在一定程度上缓解水分胁迫对植物抗氧化系统的伤害,使膜脂过氧化作用减弱。图6
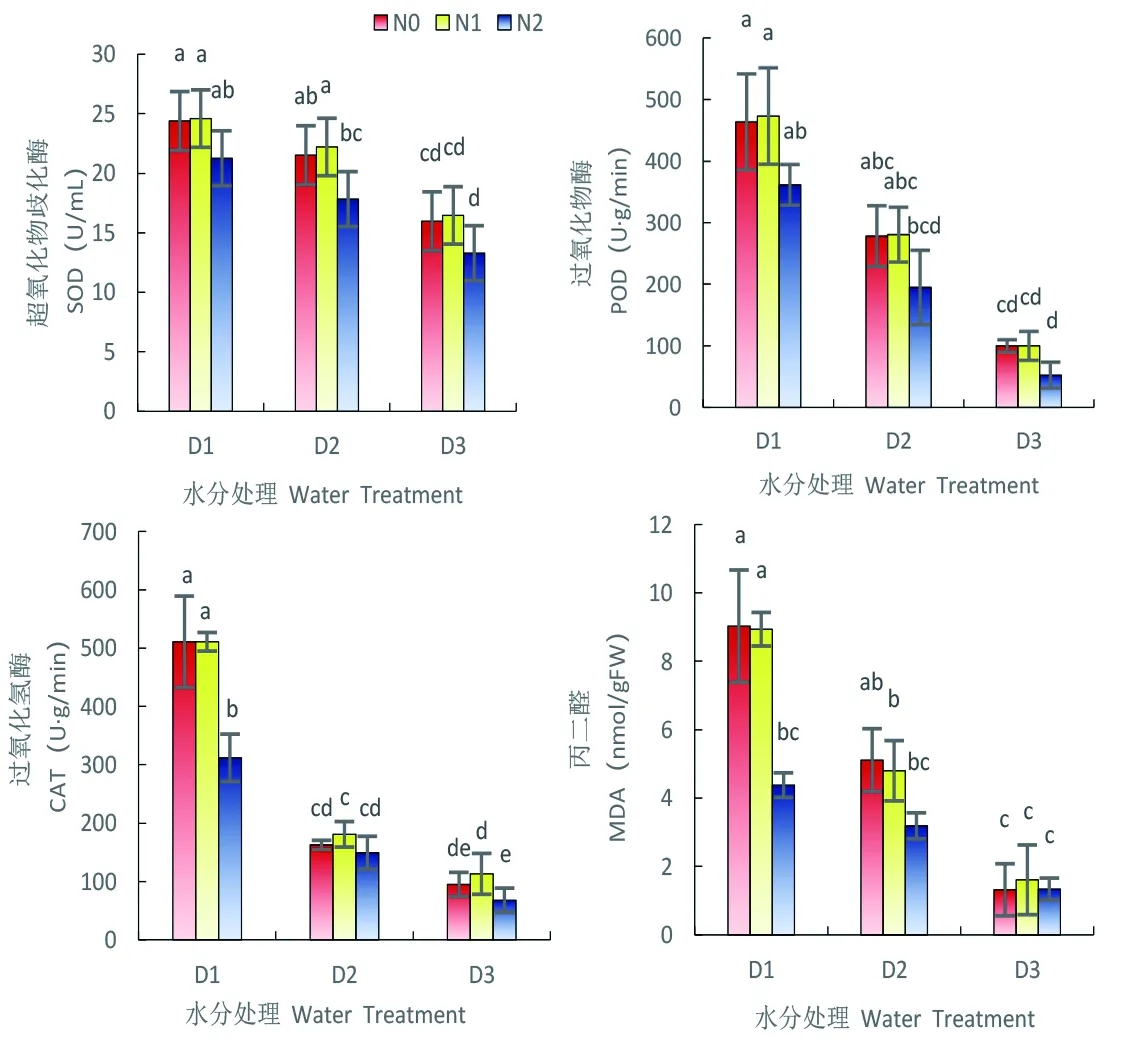
图6 苗期水分胁迫与施氮下雪菊抗氧化酶活性及MDA含量变化
Fig. 6 Effect of nitrogen Application on Antioxidant enzyme activity and MDA ofCoreopsistinctoriaunder drought condition at Seedling stage

2.7 雪菊生长指标与生理指标相关性
研究表明,株高增长量、地上部鲜重、地下部鲜重与根长、根冠比均与总叶绿素、Pn、Tr、Gs、Ci、qP、WUE呈极显著性正相关(P<0.01),与NPQ、SOD、POD、MDA呈极显著性负相关(P<0.01);此外,株高增长量与Fv/Fm、ФPS Ⅱ、ETR呈显著性正相关(P<0.05),而Fo与株高增长量、根冠比呈显著性负相关(P<0.05),与地上部鲜重、地下部鲜重、总生物量呈极显著性负相关(P<0.01);除根长之外,其余生长指标均与CAT呈极显著性负相关(P<0.01)。雪菊的生长指标与生理指标表现出较强的相关性。表1
3 讨 论
3.1 水分胁迫对雪菊苗期生长及生理的影响
幼苗期是植株生长的脆弱期,在此时期遭受水分胁迫会引起植株水分亏损、生长延缓或停止,使植株生长遭受抑制,加快组织、器官和个体的老化、脱落甚至死亡。一般认为植物叶片含水量会在干旱胁迫下降低,使得植株的地上部、地下部鲜重及总生物量下降,株高生长放缓[26]。研究中,通过对雪菊在严重缺水、轻度缺水和正常灌水下的生长情况分析可知,雪菊通过降低株高增长量、地上部鲜重、地下部鲜重、根长、总生物量、根冠比的方式减少对水分的消耗,以局部的损失来维持植株的生长,保证资源的持续利用。
水分胁迫下植株细胞的原生质脱水会导致细胞膜系统受损,导致膜透性的增大,渗透调节物质为了提高细胞液的浓度会主动积累渗透调节物质,维持细胞稳定的膨压以保持原生质与外界环境的渗透平衡,而植物通过积累游离的脯氨酸和可溶性糖来抵御干旱胁迫,使细胞的各种生理过程能正常运行[27],叶绿素含量能在一定程度上直接影响植物的光合能力及生长状况,一般来说叶绿素含量在水分胁迫下呈下降趋势[28],这与试验的研究结果一致。
光合作用易受周围环境的影响,且水分胁迫是其主要的限制因素,有研究表明气孔因素是其中重要的一个环节[29]。研究中的Pn、Tr、Gs、Ci、WUE随着水分胁迫的加重呈逐渐下降的趋势,雪菊叶片通过降低气孔开放程度和净光合速率,进一步降低叶片的蒸腾速率,保证水分维持生命体活动;植物通过降低蒸腾量,尽可能地完成土壤水分和植株水分的动态平衡。光合作用的变化还与叶绿素荧光参数密切相关,水分胁迫对光合作用的影响均可通过叶绿素荧光动力学反映出来,研究中的Fv/Fm、ΦPSⅡ、 qP、ETR随着水分胁迫程度加重不断下降,Fo、NPQ不断上升,随着水分含量的不断降低,PSⅡ反应中心的开放程度不断降低,光合电子传递速率不断下降,PSⅡ的潜在活性受损,进而影响光合作用的电子传递效率,此时积累在PSⅡ反应中心的产能过剩,相关的保护机制不能使过剩的产能得以消耗,抑制光合作用的原初反应,产生光抑制。
膜脂过氧化的最终产物MDA含量的增加同样作为植物受到伤害的重要标志,多项研究表明,MDA含量的上升直接反映了植物体受害程度加剧,植物体只能提高渗透作用增加渗透物质的积累以促进细胞膨压稳定,维持植物继续生长[30]。这一结论在试验中得到验证,不过虽然植物可通过增加渗透物质来缓解干旱对植物体的伤害,但此时的渗透调节能力较之前相比仍有所下降。此外,细胞内的活性氧处于清除和生成的动态平衡状态,植物在水分胁迫下动态平衡被打破,便通过提升抗氧化系统中的SOD、POD、CAT活性来抵制活性氧所带来的伤害,试验中SOD和POD在轻度缺水和严重缺水间无显著差异,2种水分条件对雪菊的伤害程度相当。抗氧化酶活性不会在缺水条件下无限增长,当水分胁迫程度及持续时间已超过植物所能承受的范围时,抗氧化酶就会停止积累。还有研究表明,耐旱性强的植物一般被认为抗氧化酶活性会相对更高[31]。从研究中可知,SOD、CAT、POD活性都有较大幅度的上升,此时雪菊叶片中的活性氧逐渐增多,酶促清除系统的防御调控机制开始减弱,植株的生长已受到了限制,然而雪菊抗氧化酶活性却在水分胁迫条件下持续增加,且未有减弱趋势,这在一定程度上说明了雪菊是一个具有一定耐旱能力的物种。
3.2 水分胁迫与施氮对雪菊苗期生长及生理的影响
研究表明,施氮可以缓解植物应对干旱所造成的伤害[32],适宜的供氮水平可促进植物在缺水条件下的生长[33]。研究中,施氮对雪菊株高增长量、地上部鲜重和地下部鲜重、总生物量、根长和根冠比具有明显的提升作用,缓解了水分亏缺对植株生长的限制,增强了植株在干旱条件下的适应性。
研究发现施氮可以促进叶片含氮量的增加,促进叶绿素的合成,提高光合性能,从而减轻植物在干旱下的光损伤[34]。试验中,施氮可显著提高不同水分胁迫下的叶片叶绿素含量,说明当植株水分亏缺时,植株可通过施用适宜的氮素促进叶绿素的积累。
施氮可使干旱条件下的植物代谢发生变化,研究表明,施氮可降低干旱胁迫下植物的可溶性糖含量与脯氨酸含量[35-36],这一结果与试验结果一致,但此时的细胞膜系统已受到损伤,相比受胁迫之前的细胞膜渗透调节能力有所下降。
叶绿素荧光特性具有反映植物对光能吸收、传递、消耗及分配等特点[37]。在植株缺水条件下施氮可对植物叶绿素荧光参数产生积极影响[38],通过施氮可使干旱区的作物通过调节叶绿素荧光特性来适应水分胁迫[39]。研究表明,适量施氮可以对水分胁迫下叶片捕获的光能以及用于光合电子传递的能量有所增加,提高PSⅡ反应中心活性,提升了电子传递效率,增强了作物的耐旱性[40]。在研究中,水分胁迫下施氮能提高雪菊叶片的实际光化学效率(Ф PSⅡ)、相对电子传递(ETR)效率、最大光化学效率(Fv/Fm),这可能与施氮后的叶片水分状况得到改善以及光合色素增加、羧化酶增强有关。此外,通过施氮可促进CO2固定以及同化作用增强,为植物潜在的光合能力提供能量,增加了幼苗光化学下的电子传递效率,促进 PSⅡ光化学反应活性,增加了植物对干旱地的适应性。
施氮能提高植物的光合能力,增加光合产物的积累,促进植物的生长。研究中,施氮可提高雪菊叶片的光合特性,导致叶肉细胞光合活性对光的吸收能力不断增强,净光合速率、蒸腾速率显著增加。施氮可对雪菊光合作用的下降有很好的补偿作用,缓解水分胁迫对植物机体造成的伤害。然而,当雪菊严重缺水时,施氮对其的补偿作用开始变小,这可能是因为叶片前期受损较重难以恢复或是氮营养不足造成的。研究中雪菊的光合参数与干旱胁迫程度呈负相关,且正常灌水条件下施氮与不施氮差异最大。
施氮使雪菊的抗氧化酶活性开始下降,在严重缺水条件下施氮使SOD的活性恢复到轻度胁迫的的水平,使CAT活性大幅度下降,这与王曦等[36]的研究结果一致,认为氮素可使活性氧的酶促清除系统及其它干旱调节机制增强,减缓了细胞的氧化变质,增加植物机体应对干旱条件对抗能力,提高了植物生长的抗逆性。
4 结 论
水分亏缺(轻度缺水、严重缺水)不利于雪菊幼苗的生长(株高、根长、生物量等),破坏光合系统(净光合速率、蒸腾速率、气孔导度、胞间CO2浓度、水分利用效率)及叶绿素荧光系统(初始荧光、最大光化学速率、PSⅡ实际光化学速率、电子传递效率、光化学猝灭系数、非光化学猝灭系数),使渗透调节物质(可溶性糖、脯氨酸)的积累下降,抗氧化酶活性(SOD、POD、CAT)和丙二醛含量大幅增加。
在水分亏缺条件下,施氮(0.1g、0.3g/kg营养土)可有效促进雪菊幼苗的生长,改善幼苗的光合系统、叶绿素荧光系统,促进渗透调节物质的积累,降低抗氧化酶活性和丙二醛含量,明显减轻水分胁迫对雪菊带来的损伤,使雪菊更好地度过生长脆弱的苗期。然而,在正常灌水条件下,施氮增多(0.3g/kg营养土)并不会进一步促进雪菊的生长。
