胃食管反流病与幽门螺杆菌感染相关机制研究进展
2020-02-14徐思佳王淑娴王孝通蔡凌宇孔桂美
徐思佳, 王淑娴, 王孝通, 蔡凌宇, 孔桂美
徐思佳, 王淑娴, 王孝通, 蔡凌宇, 孔桂美, 扬州大学医学院转化医学研究院 江苏省扬州市 225009
核心提要: 胃食管反流病(gastroesophageal reflux disease,GERD)是临床上常见的消化道疾病, 幽门螺杆菌(Helicobacter pylori, H.pylori)感染是大多数消化道疾病的致病因素, 而在近几年研究发现H.pylori感染可能对GERD有保护作用, 本文以患病机制为主阐述两者的相关性, 并为临床治疗提供更多思路.
0 引言
《第五次全国幽门螺杆菌感染处理共识报告》显示我国幽门螺杆菌(Helicobacter pylori,H.pylori)感染率近年来呈下降趋势, 但由于人口基数较大, 仍有约50%的感染率[1,2].H.pylori感染不仅引起消化系统疾病, 还可引起呼吸、循环、血液等系统疾病, 根除H.pylori治疗对于许多疾病有明显获益, 但H.pylori根除治疗在某些方面存在争议[3,4], 如H.pylori感染与特殊人群溃疡发生、胃肠道菌群关系、胃食管反流病(gastroesophageal reflux disease, GERD)的发生等.GERD是人体消化系统动力障碍疾病, 多因食管下括约肌运动障碍后胃十二指肠内容物反流入食管、口腔或肺部引起, 其发病机制尚不明确, 临床症状以反流、烧心、胸骨后疼痛为主.欧美国家约有10%-20%的人患病, 而亚洲地区患病率较欧美地区少, 约为5%, 但近年来患病率明显上升.国家与国家之间患病率的差别可能是饮食结构的差异与卫生条件的不同所致[5].根据发病过程将GERD归纳为三种形式:反流性食管炎、非糜烂性反流病和巴雷特食管, 其中亚洲地区发病以非糜烂性反流病最为多见[6].本文旨在根据对GERD和H.pylori相关性的研究进展, 通过发病机制阐述两者的相关性, 同时为治疗GERD发现更多证据.
1 GERD产生的机制
是以食管下括约肌压力障碍为主的动力障碍疾病, 其发病机制与病因十分复杂, 目前尚不明确, 有专家指出GERD的发生主要因抗反流防线与反流进攻能力的失衡所致[7].
1.1 抗反流防线
1.1.1 抗反流屏障结构与功能异常: 抗反流屏障位于胃食管交界处, 主要依赖于该位置的解剖结构, 包括食管下端括约肌(lower esophageal sphincter, LES)、胃食管阀瓣瓣膜(gastroesophageal valve, GEV)、HIS角(HIS角是胃纵轴方向与食管形成的夹角)等[8], 腹内压力的升高、食管相对短缩导致的食管裂孔周围支撑结构的破坏, 重要的抗反流屏障 LES、GEV以及HIS角的破坏均可以导致胃食管反流的发生, 胃食管反流的发生, 是一个持续破坏胃食管交界处解剖以及力学结构的过程.例如, 食管裂孔疝能够通过破坏抗反流屏障增加GERD的发生概率[9].
1.1.2 食管廓清能力下降: 抗反流机制还与食管体部的蠕动波对食管内容物和反流物的清除能力有关, 称为廓清作用, 其中对酸的反流廓清作用最显著.赵卡冰[10]等发现GERD患者与正常人相比, 食管中下段蠕动波以及LES压力明显降低, 证明正常的食管蠕动度参与抗反流机制的构成, 可以有效清除食管内容物.
1.1.3 食管黏膜屏障功能降低: 食管黏膜上皮细胞形成物理和生化屏障, 阻止有害成分进入人体.该屏障作为一种保护屏障, 保护自身组织不受食物、胃酸等物质的损害, 长期吸烟、饮酒、刺激性饮食或服用某些伤胃的药物可以使食管黏膜屏障受到破坏, 其保护作用随之降低.
1.1.4 自身抗反流恢复能力与调节能力下降: 由于自身抗反流恢复能力与调节能力较差, 胃食管反流现象易发生于新生儿与中老年人.对于新生儿来说, 由于消化系统未发育完全导致的反流症状是一种生理现象, 超过2/3的新生儿发生过此类症状, 随胃肠道发育至10-12月龄时, 反流的发生率降至5%[11], 严重者会造成不良后果,要加强监测.老年人患病率较高且病情较重有以下几点原因[12]: (1)抗反流药物使用多, 易产生耐受; (2)老年人合并消化系统疾病较多; (3)身体机能下降使抗反流屏障功能下降; (4)老年人肥胖率更高, 易合并糖尿病等慢性病.
1.1.5 精神、心理因素的影响: 近来, 对于精神心理对于胃肠疾病的影响研究逐年增多.屈亚威[13]等和Hasler[14]认为精神心理因素对GERD的发生发展各方面存在影响.精神因素和胃分泌功能紊乱都可以造成胃动力障碍, 导致胃排空延长, 容易导致反流的发生.
1.2 反流进攻能力 反流物中有害成分包括胃酸、消化酶以及各种食物成分, 这些有害成份会破坏食管黏膜屏障, 可造成黏膜出血、糜烂甚至癌变.患者餐后胃酸分泌增加, 在食物上方形成“酸袋”, 该结构接近贲门.在胃酸作用下, 胃蛋白酶原会被激活成为胃蛋白酶分解蛋白质,其分解产物促进胃泌素的分泌[15], 研究表明[16]胃泌素G-17与反流的形成有一定关系, 胃酸受G-17影响后分泌增多, 使更多胃蛋白酶原变为胃蛋白酶,这在一定程度上加剧了疾病.若合并十二指肠胃反流, 反流物可伴有胆汁、胰酶等.研究显示[10], 胆酸可以使上皮细胞炎性介质释放增多, 并使其氧化应激, 损伤DNA结构与细胞, 进而使上皮化生甚至发生癌变.另有研究表明[17], 食管与胆汁酸接触可促进转录因子CDX2的表达,CDX2是一种核转录因子, 它通常在肠道内表达, 在食管中极少表达, CDX2在异位表达, 使食管上皮化生, 从而导致食管癌.
1.3 GERD的有害因素 多项研究显示, 饮食、吸烟、饮酒、药物、肥胖及不良生活习惯、遗传因素等构成了GERD的危险因素[18].陈思旭等[19]调查临床大数据发现GERD的独立危险因素是男性、BMI和食管裂孔疝.由此我们可以认为GERD的发生发展与性别、生活习惯、基础疾病等密切相关, 这也为人们在日常生活中预防GERD提供了一定的科学依据(图1).
2 H.pylori与GERD
近年来, 越来越多的学者致力于H.pylori与GERD相关性的研究.Miftahussurur等[20-22]经过一系列的研究发现,GERD的发病率负相关于H.pylori感染.也有学者认为H.pylori感染会影响胃酸的分泌以及胃动力学的改变,从而加剧GERD.而吴承芳等[23,24]认为H.pylori感染与GERD无相关性.出现上述不同结果可能是由于研究对象的选择、样本含量、研究方法的不同等原因, 所以未来我们需要更大样本, 更详细的准入标准的研究以探究H.pylori感染与GERD之间的关系.
3 H.pylori对GERD的保护机制
目前已有许多学者就H.pylori感染是否为GERD的保护因素做了大量研究, 有报道认为亚洲人群感染H.pylori对GERD有保护性作用[25].Raghunath等[26]认为H.pylori的低感染率可能与GERD的高患病率相关, 这也部分论证了H.pylori与GRED呈负相关的假说.Liu等[27]发现H.pylori感染可能为GERD的保护因素, 因为它可以改善食道的蠕动、增强下食道括约肌的压力并减少食道酸的暴露.目前, 大部分亚洲学者的研究结果更加倾向于H.pylori是保护因素[28].但是, 鉴于目前临床尚未完全完成对GERD发病机制的研究, 关于H.pylori感染对GERD是否有保护作用也要等待进一步研究与发掘,下面就前人对两者的负相关机制展开说明.
3.1 反流物进攻能力的降低机制H.pylori分解尿素酶产生氨中和胃酸, 增高胃内pH值, 使得胃蛋白酶的激活减少, 反流物的酸度降低, 从而对食管黏膜的损害也降低.
H.pylori感染产生炎性介质、毒素、细胞因子等,激活自身免疫系统, 活化胃黏膜中的单核细胞和淋巴细胞, 导致胃黏膜的炎症反应.胃黏膜的分泌腺体在长期炎症反应的影响下逐渐萎缩, 使胃酸形成减少.
H.pylori感染导致炎症反应, 通过促进一氧化氮的释放来诱导炎症细胞因子如IL-1β和TNF-α的生成, 其中IL-1β有很强的抑酸作用, 同时H.pylori产生的内毒素、具有质子泵活性的脂肪酸, 对H+/K+ATP酶产生抑制作用, 大大降低胃酸浓度、升高胃内pH.随之结合胆盐的生成减少, 使食管黏膜上皮化生、致癌的概率降低, 从而缓解GERD的病情进展[29].
H.pylori可以增强质子泵抑制剂的抑酸效果, 可能是因为H.pylori感染后分解尿素酶产生的氨可以使胃内pH升高, 也可能是抑酸治疗改变了H.pylori在胃内的分布, 炎症部位由胃窦变成了胃体, 胃体部分泌胃酸较胃窦处少, 从而使抑酸药物效果增强[30,31].
3.2 抗反流屏障的加固H.pylori感染使炎性介质释放增加, 并且能够影响副交感神经的活性, 刺激胃内促胃泌素释放增加、血清促胃泌素水平增加, 由此收缩消化道括约肌(特别是LES), LES的压力增加, 即抗反流屏障得以加固;H.pylori感染还有保护食管黏膜的作用[32].
3.3 其他 有人认为[33]H.pylori可能通过减少胃反流的可能性来减少敏感人群GERD及其并发症的发生率.也有人认为可能是H.pylori感染导致胃体炎症反应, 炎性介质持续释放损伤食管黏膜, 降低其对酸的敏感性[34](图2).
4 GERD的常规治疗
由于病因与机制未明确, 且病情多变, 目前GERD主要采取个性化治疗[35], 联合治疗疗效更佳, 其治疗方法主要有以下几种: (1)一般治疗: 改变不良生活习惯, 积极减少疾病有害因素, 如戒烟酒、拒绝高脂饮食、减轻压力、积极治疗基础疾病等; (2)药物治疗: GERD的治疗药物最主要是抑酸药, 其中质子泵抑制剂(proton pump inhibitors, PPIs)是临床一线药物, 除此之外还有促胃动力药、抗酸剂、黏膜保护剂等[18,36], 临床上述药物常联合使用; (3)外科治疗: 抗反流手术有腹腔镜食管裂孔疝修补术、胃底折叠术等.对于GERD的典型症状,手术治疗疗效较好, 甚至超过药物治疗[37].选择手术治疗的同时, 要严格遵守手术适应症, 防治手术并发症;(4)内镜下治疗: 由于内镜拥有微创、安全的特点, 更多人愿意接受内镜下治疗.目前我国已开展射频治疗、抗反流黏膜切除、MUSE内镜下胃底折叠术、抗反流黏膜套扎等内镜治疗方法; (5)心理因素治疗: 由于精神心理因素对胃肠疾病发生发展的作用越来越受到重视,对于合并精神心理疾病的GERD患者应及时进行相应干预[38]; (6)中医治疗: 中医治疗可以治疗轻中度GERD,但对于重症以及难治性GERD的疗效不佳, 大量临床试验显示[39,40], 中西医结合治疗重症以及难治性GERD效果更好, 这也为临床治疗GERD指明了新的方向.目前研究[41]有效的中成药包括越鞠丸加味、左金丸、达利通颗粒、加味左金丸、乌贝散等, 针灸治疗[37]也被认为是可行的方案.

图1 胃食管反流病的发生.
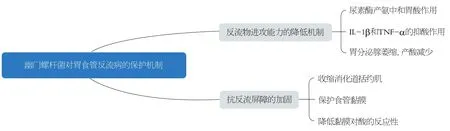
图2 幽门螺杆菌对胃食管反流病的保护机制.
5 H.pylori根除治疗对GERD的影响
除了上述的常规治疗外, 近年来, 对于合并H.pylori感染的GERD是否进行H.pylori根除治疗引发了热议.有人认为H.pylori易导致多系统疾病, 建议根除治疗.也有人认为H.pylori感染可以缓解GERD的病情, 不应给予根除治疗.有报道[42,43]认为根除H.pylori可能是GERD发生发展的一个危险因素.另外有学者[44,45]认为根除H.pylori与GERD的发生发展无明显联系, 除长期使用PPI的患者外,H.pylori的筛查和根除决定应独立于GERD.吴承芳等[23]认为H.pylori抑制胃酸分泌的量难以达到防止食管损伤的程度, 虽然H.pylori在一定程度上对GERD的病程发展起保护作用, 但鉴于H.pylori感染损伤消化道黏膜且导致相关疾病的事实, 根除治疗确实是有好处.
6 结论
目前对于GERD与H.pylori感染的相关性机制存在不同的观点, 大部分研究认为H.pylori可作为GERD的保护因素存在, 而合并H.pylori感染的GERD患者是否根除H.pylori仍无统一意见.
