热水浸提及乙醇沉淀的工艺优化提高猴头菇多糖提取率
2020-02-06胡洋崔春陶倩李文治
胡洋,崔春*,陶倩,李文治
(1.华南理工大学 食品科学与工程学院,广州 510640;2.无限极(中国)有限公司,广州 510665)
猴头菇(Hericiumerinaceus)又名猴蘑、刺猬菌、猴头菌,是一种珍贵的药食两用菌菇,它的分布很广泛,我国的东北各省和河南、河北、西藏、内蒙古等地皆有猴头菇种植[1]。猴头菇富含营养物质和活性成分,据报道,它的糖类、蛋白质、多种氨基酸、矿物质及维生素含量丰富;还含有多糖类、甾醇类、萜类、酚类、脂肪酸类等生理活性物质[2]。猴头菇也是我国一种传统的名贵食材,鲜美的味道和鲜嫩的口感使其获得“山珍猴头、海味燕窝”之美誉[3,4]。
猴头菇资源的研究和应用具有广阔的前景,近年来已开发出多种猴头菇制成的保健食品及调味品,如猴头菇多糖口服液、猴头菇保健醋[5]、猴头菇素肉干[6]、猴头菇香辣酱等,提高了猴头菇的附加值,且更便于消费者获得营养和美味。对于猴头菇富含的活性成分,研究者尤其注重多糖,许多功能性和药理学研究表明它具有抗肿瘤、抗氧化、调节免疫力、护肝养胃等功效[7,8],因此,进一步研究猴头菇多糖的高效提取意义重大。热水法浸提是提取菌类多糖最常用的方法,多数多糖可以溶出到热水中,且热水提取对多糖的破坏较小,这种方法操作工序简单,仪器设备要求不高,被广泛应用于食品工业生产。本试验以东北猴头菇为研究对象,以热水法浸提为提取猴头菇多糖的主要方法,并研究在提取过程中颗粒大小、提取次数、料液比、提取时间对猴头菇多糖提取率及含量的影响。为了进一步提高猴头菇多糖的含量,利用乙醇醇沉的方法对其进行纯化,并对浸提液浓缩体积、醇沉浓度、醇沉时间等因素进行优化,为猴头菇多糖的开发应用及工业化生产提供了一定的参考。
1 材料与方法
1.1 材料和仪器
1.1.1 材料与试剂
猴头菇:敦化市林之特产有限公司。
无水葡萄糖、无水乙醇、苯酚、浓硫酸、3,5-二硝基水杨酸、酒石酸钾钠、无水硫酸钠:分析纯,广州市丛源仪器有限公司。
1.1.2 主要设备
ME204E万分之一电子天平 梅特勒-托利多仪器有限公司;Scientz-18N冷冻干燥机 宁波新芝生物科技有限公司;GL-21M高速冷冻离心机 长沙湘仪离心机仪器有限公司;XW-80A微型漩涡混合仪 沪西分析仪器厂;RE-52A旋转蒸发器 上海亚荣生化仪器厂;UV756扫描型紫外分光光度计 上海佑科仪器仪表有限公司;DHG-9070A电热恒温鼓风干燥箱 上海申贤恒温设备厂。
1.2 试验方法
1.2.1 猴头菇多糖热水浸提工艺流程
猴头菇→烘干→粉碎→过筛→按一定料液比加水→100 ℃多次提取→过滤后合并提取液→浓缩、冻干→测定评价浸提效果。
1.2.2 猴头菇多糖热水浸提工艺优化
将猴头菇在60 ℃烘干后进行多糖热水浸提工艺的优化,依次对粉碎目数(不粉碎、1,3,10,20,40,80目)、提取次数(1,2,3,4次)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30)、提取时间(每次1,2,3 h)进行优化,每次优化试验均以上一次试验优化的结果为基础进行。考察各影响因素对猴头菇粗多糖得率、猴头菇粗多糖含量、猴头菇多糖提取率的影响,确定猴头菇多糖热水浸提的最佳工艺。
1.2.3 猴头菇多糖乙醇沉淀工艺流程
多糖浸提液→蒸发一定比例水分→加乙醇达到规定醇沉浓度→室温下醇沉一定时间→离心分离、沉淀→沉淀复溶后冻干→测定、评价醇沉效果。
1.2.4 猴头菇多糖乙醇沉淀工艺优化
在确定的最佳热水浸提工艺下得到多糖浸提液后,进行猴头菇多糖乙醇沉淀工艺的优化,依次对提取液浓缩体积(浓缩掉20%、40%、60%、70%、80%水)、乙醇沉淀浓度(40%、50%、60%、70%、80%)、乙醇沉淀时间(2,4,6,12 h)进行优化,每次优化试验均以上一次试验优化的结果为基础进行。考察各影响因素对猴头菇粗多糖得率、猴头菇粗多糖含量、猴头菇多糖提取率的影响,确定猴头菇多糖乙醇沉淀的最佳工艺。
1.3 指标测定
1.3.1 苯酚-硫酸法测定总糖含量
测定样品总糖含量,以烘干至恒重的葡萄糖为标准品,根据苯酚-硫酸法建立测定总糖含量的标准曲线[9],见公式(1):
y=0.0155x-0.0043,R2=0.9992。
(1)
式中:x为测定溶液的浓度(μg/mL),y为490 nm处的吸光度;样品测定时,将样品稀释至合适浓度,测定其在490 nm处的吸光值,并计算总糖含量。
1.3.2 DNS法测定还原糖含量
测定样品还原糖含量,以烘干至恒重的葡萄糖为标准品,根据DNS法建立测定还原糖含量的标准曲线[10],见公式(2):
y=18.966x+0.018,R2=0.999。
(2)
式中:x为测定溶液的浓度(mg/mL),y为540 nm处的吸光度;样品测定时,将样品稀释至合适浓度,测定其在540 nm处的吸光值,并计算还原糖含量。
1.3.3 评价指标
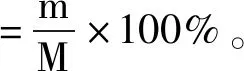
猴头菇粗多糖含量:分别测定干燥的猴头菇粗多糖样品的总糖含量和还原糖含量,即可得到猴头菇粗多糖含量=样品总糖含量(%)-样品还原糖含量(%)。

2 结果与分析
2.1 猴头菇多糖热水浸提工艺优化
2.1.1 猴头菇粉碎颗粒大小对猴头菇多糖热水浸提的影响
不同目数的猴头菇在料液比1∶15、100 ℃下提取2次,每次提取2 h,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图1。
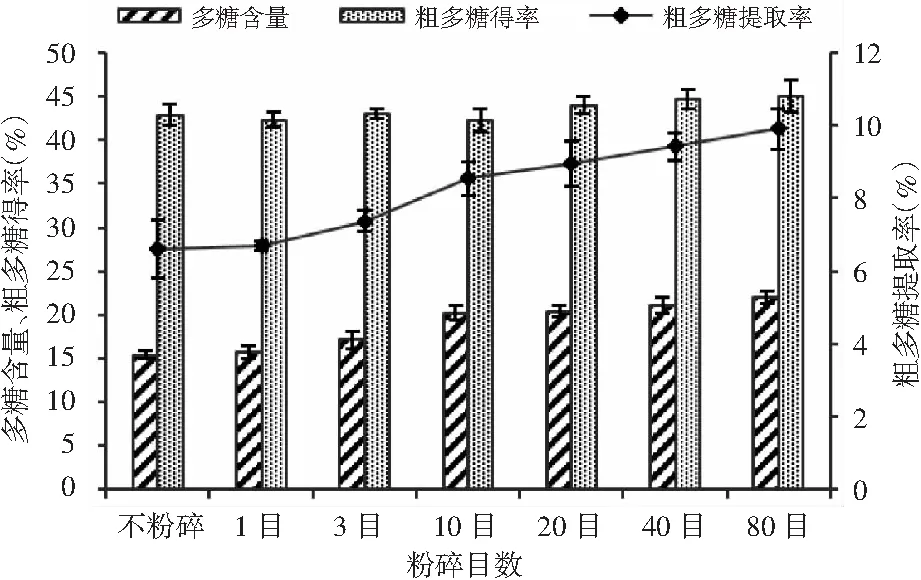
图1 粉碎颗粒大小对猴头菇多糖热水浸提的影响Fig.1 The effect of particle size on hot water extraction of polysaccharides from Hericium erinaceus
由图1可知,随着猴头菇粉碎目数的增加,猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率均不断提高。不粉碎、1目、3目的猴头菇样品的颗粒较大,在此目数下进行提取,粗多糖的含量及提取率较低;进一步粉碎至20目,猴头菇粗多糖的得率达到44.00%,多糖含量达到20.38%,粗多糖提取率达到8.97%,且提取率较不粉碎提高了2.36%,粉碎的目数变大,相对表面积变大,接触增加。虽然继续粉碎提取率还会提高,但考虑到实际生产中,粉碎目数越小,生产难度及能耗也会增加,确定猴头菇粉碎颗粒大小为20目。
2.1.2 提取次数对猴头菇多糖热水浸提的影响
颗粒大小为20目的猴头菇在料液比1∶15、100 ℃下按不同次数提取,每次提取2 h,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图2。
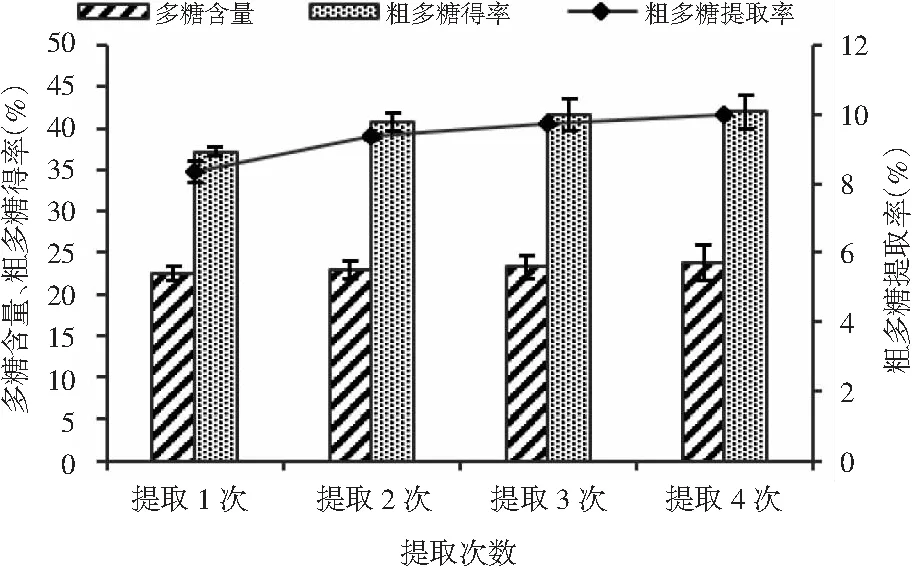
由图2可知,以提取4次得到的总猴头菇粗多糖提取率为100%计算,提取1次可获得83.67%的猴头菇多糖;提取2次可得到93.89%的猴头菇多糖;提取3次可得到97.39%以上的猴头菇多糖。提取3次和提取4次的猴头菇多糖提取率的增加不明显,多次提取操作繁杂,包括加水、升温、提取、离心过滤、再投料等,耗时较长,综合考虑工时、能耗和成本等因素,确定提取次数为2次。
2.1.3 提取料液比对猴头菇多糖热水浸提的影响
颗粒大小为20目的猴头菇按不同的料液比加水,在100 ℃提取2次,每次提取2 h,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图3。
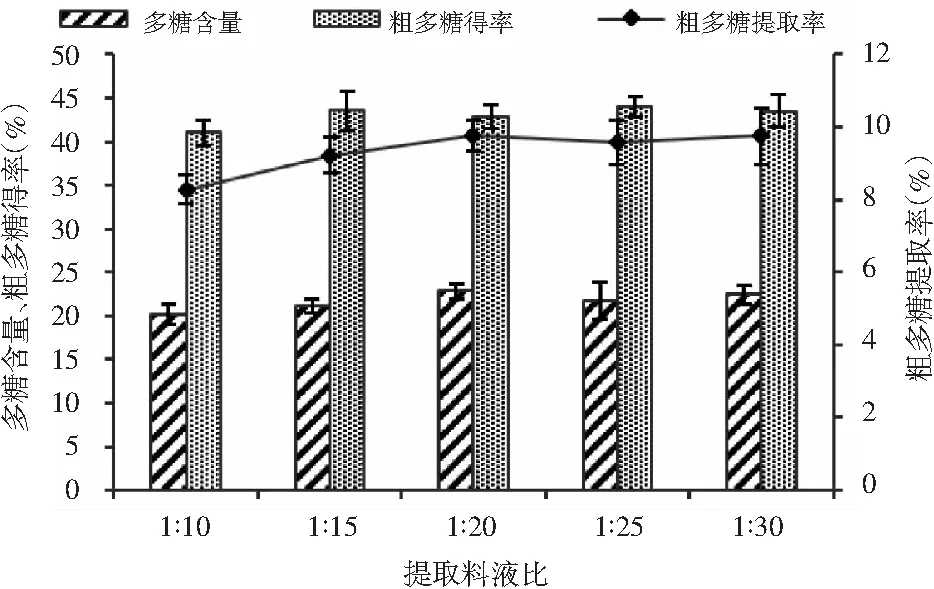
图3 提取料液比对猴头菇多糖热水浸提的影响Fig.3 The effect of solid-liquid ratio on hot water extraction of polysaccharides from Hericium erinaceus
由图3可知,随着料液比的增大,猴头菇粗多糖得率、粗多糖含量及粗多糖提取率呈现先上升后趋于平缓的趋势,在料液比为1∶20时达到最高点。在实际操作中,当料液比太小时,浸提液粘稠,影响生产中的过滤工序且多糖溶出不彻底;料液比增大虽有利于多糖的溶出,但是料液比太大,会给后续的浓缩工序增加更多的能耗。综上,选定料液比为1∶20,此时猴头菇粗多糖得率为42.83%,粗多糖含量为22.80%,粗多糖提取率为9.77%。
2.1.4 提取时间对猴头菇多糖热水浸提的影响
颗粒大小为20目的猴头菇在料液比1∶20、100 ℃下提取2次,按不同时间提取,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图4。
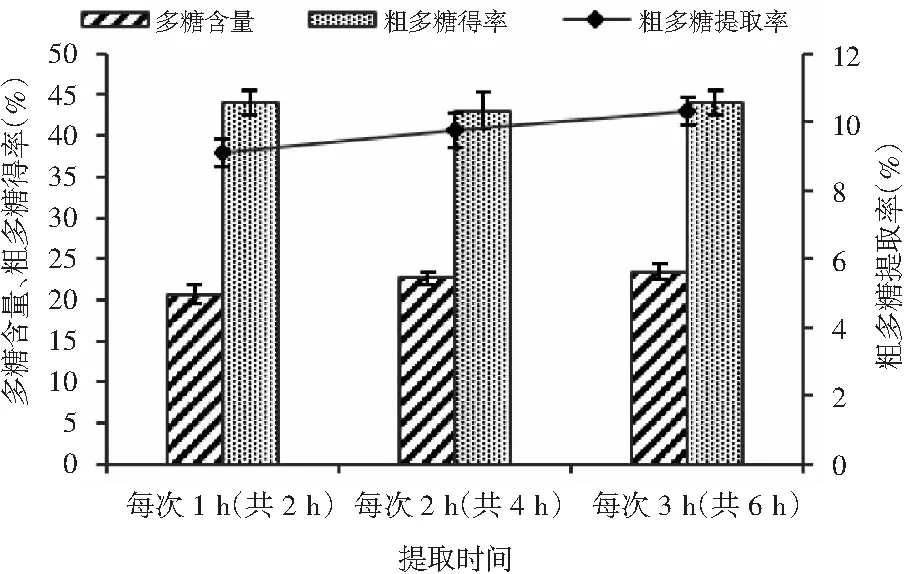
图4 提取时间对猴头菇多糖热水浸提的影响Fig.4 The effect of extraction time on hot water extraction of polysaccharides from Hericium erinaceus
由图4可知,随着提取时间的延长,猴头菇粗多糖得率、粗多糖含量及粗多糖提取率不断提高,因此确定最佳浸提时间为每次3 h共(6 h),此时猴头菇粗多糖得率为44.00%,粗多糖含量为23.43%,粗多糖提取率为10.31%。
2.2 猴头菇多糖乙醇沉淀工艺优化
2.2.1 浸提液的浓缩体积对猴头菇多糖醇沉的影响
将浸提液浓缩不同体积的水分,70%醇沉浓度下醇沉2 h,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图5。
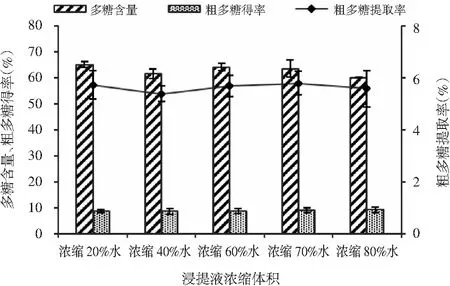
图5 浸提液浓缩体积对猴头菇多糖醇沉的影响Fig.5 The effect of concentrated volume of extract on ethanol precipitation of polysaccharides from Hericium erinaceus
由图5可知,浸提液的浓缩体积对各测定指标的影响不大,但浸提液的浓缩体积对乙醇用量有巨大影响。以1 t猴头菇多糖浸提液为例,选用浓缩20%水这一工艺,将提取液的乙醇含量调整到70%,需要添加1.87 t无水乙醇;而选用浓缩80%水这一工艺,将提取液的乙醇含量调整到相同的酒精度,仅需要添加0.47 t无水乙醇。显然,蒸发水的比例越高,越能节省无水乙醇的用量。浓缩80%水,猴头菇粗多糖得率为9.30%,粗多糖含量为60.15%,粗多糖提取率为5.59%。
2.2.2 乙醇沉淀浓度对猴头菇多糖醇沉的影响
将浸提液浓缩掉80%的水分,在不同醇沉浓度下醇沉2 h,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图6。
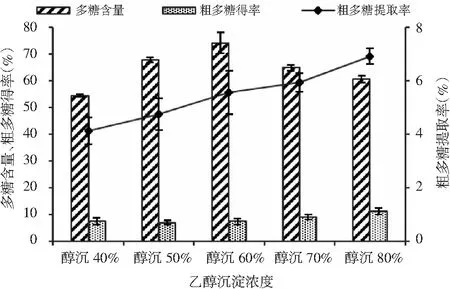
图6 乙醇沉淀浓度对猴头菇多糖醇沉的影响Fig.6 The effect of ethanol precipitation concentration on ethanol precipitation of polysaccharides from Hericium erinaceus
由图6可知,随着醇沉浓度的提高,猴头菇粗多糖得率和粗多糖提取率不断提高,粗多糖含量呈先上升后下降的趋势。较低的醇沉浓度,多糖的沉淀率较低;提高醇沉的浓度有利于多糖的沉淀,但也使沉淀下来的杂质变多,多糖含量降低。蒋俊等[11]的研究也得到了相同的规律,且发现醇沉浓度较低时,得到的粗多糖中分子量较大的占比较高,醇沉浓度提高时,有较多的小分子量多糖沉淀下来。综上,本试验选定乙醇沉淀浓度为80%。
2.2.3 乙醇沉淀时间对猴头菇多糖醇沉的影响
将浸提液浓缩掉80%的水分,80%醇沉浓度下醇沉不同时间,得到的猴头菇粗多糖得率、猴头菇粗多糖含量及猴头菇粗多糖提取率见图7。

图7 乙醇沉淀时间对猴头菇多糖醇沉的影响Fig.7 The effect of ethanol precipitation time on ethanol precipitation of polysaccharides from Hericium erinaceus
由图7可知,不同的醇沉时间对各测定指标的影响不大。静置醇沉不需要额外的能耗,为了方便工厂大生产的操作,因此确定6 h为最优醇沉时间。此条件下,猴头菇粗多糖得率为11.90%,粗多糖含量为57.65%,粗多糖提取率为6.86%。
3 结论
优化的猴头菇多糖的热水浸提工艺为:猴头菇颗粒大小20目,100 ℃提取2次,提取料液比1∶20,每次提取3 h。此条件下,猴头菇粗多糖得率为44.00%,粗多糖含量为23.43%,粗多糖提取率为10.31%。
优化的猴头菇多糖的乙醇沉淀工艺为:浸提液浓缩80%的水分,调整醇沉浓度为80%,室温下醇沉6 h。此条件下,猴头菇粗多糖得率为11.90%,粗多糖含量为57.65%,粗多糖提取率为6.86%。
猴头菇直接热水浸提,得到的猴头菇粗多糖含量较低,但粗多糖得率和粗多糖提取率较高;而猴头菇热水浸提后进行乙醇沉淀,增加了操作工序,多糖在醇沉过程中有部分损失,但得到的猴头菇粗多糖含量较高。因此在实际生产中,可以根据不同的应用目的选择合适的提取工艺。
