紫红曲霉M-4液态发酵产孢子工艺优化
2020-01-18腾军伟周芷寒刘振民苏米亚郑远荣刘景焦晶凯
腾军伟,周芷寒,刘振民,苏米亚,郑远荣,刘景,焦晶凯
(1.光明乳业股份有限公司乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海200436;2.上海商学院酒店管理学院,上海200235)
红曲霉在中国有着相当悠久的历史,古籍中有关于红曲霉用于发酵与保藏食物的记载[1]。近年来,国内外学者研究发现,红曲霉的主要次级代谢产物包括Monacolin K[2-3]、红曲色素[4-6]、γ-氨基丁酸[7]等,这些次级代谢产物大多对人体有益,被广泛用于食品、医药、化妆品等领域中[8-10]。
霉菌成熟干酪是通过直投、浸泡或喷洒等形式接种霉菌成熟剂后,干酪内部和(或)表面的特征霉菌生长从而促进其成熟的干酪,霉菌干酪中较著名的有青纹干酪、卡门贝尔干酪和布里干酪[11-12]等,它们利用其独特的霉菌发酵制作而成。在干酪成熟过程中,霉菌一直被认为是辅助性培养物,因为它们具有发酵代谢乳糖、产生特定质地和风味的能力[13-15]。随着我国对外贸易的发展,国人对干酪文化的认知也逐渐扩大,其中霉菌干酪作为一种特别品类的干酪逐步被消费者接受,其市场消费量逐年提升。利用红曲霉发酵制作的红曲霉干酪不仅具有中国特色,还有较高的营养和功能价值,红曲霉的发酵代谢产物具有降低胆固醇水平[16-17]、调节心血管[18]、抗衰老等功能[19-20]。红曲霉干酪的开发与研究具有很强的中国特色,且更容易被中国消费者接受。红曲霉干酪的制作需要较高浓度的红曲霉孢子液,但是由于工业生产发酵红曲霉的产量低、成本高等问题,阻碍了与之相关的产业发展;且工艺上选择直投式加入红曲霉发酵剂较适合工业化生产,因此提高红曲霉单位体积的产孢子数显得尤为重要,产孢子数能够直接影响红曲霉干酪的质量[21-22]。因此,如何提高红曲霉液态发酵时的产孢子数具有较大的实际意义。
本研究选取不产桔霉毒素[23-24]且有较高色阶的红曲霉菌株紫红曲霉(Monascus purpureus)M-4,此外,液态发酵不容易受到污染、发酵情况好控制、生产效率高,与固态发酵相比较适合大规模工业化生产,采用单因素试验对紫红曲霉M-4的培养基成分和培养条件等因素进行优化,以期提高液态发酵紫红曲霉M-4的产孢子数,为中国特色功能性霉菌成熟干酪的顺利开发提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
紫红曲霉M-4(保藏编号CGMCC No.9712)乳业生物技术国家重点实验室;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)肉汤、马铃薯葡萄糖肉汤(potato dextrose broth,PDB)上海盛思生化科技有限公司;马铃薯浸粉、酵母浸粉、蛋白胨北京陆桥技术股份有限公司;葡萄糖、蔗糖、碳酸钙、氯化钙、氯化钠、氯化镁、硫酸锌、氯化钾国药集团化学试剂有限公司;大米粉华联超市;乳酸上海明富食品科技有限公司。
1.2 仪器与设备
ZWY-2112B水平摇床天津津立仪器设备科技发展有限公司;MJ-250-Ⅱ恒温培养箱杭州蓝天仪器有限公司;DW-40L188医用低温保存箱海尔集团;Thermo1389生物安全柜美国Thermo公司;ME2002E/02电子天平、FE20实验室pH计梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 培养基的制备及培养
基础液体培养基:PDB培养基(葡萄糖20 g/L、马铃薯浸粉4 g/L),pH值自然;固体培养基:PDA肉汤培养基,pH值自然;种子保存液:50%基础液体培养基+50%甘油(质量分数80%),pH值自然。以上培养基均在121 ℃条件下灭菌20 min。
种子培养液制备:在500 mL锥形瓶中装入100 mL的PDB培养基,进行接种,在30 ℃、90 r/min的水平摇床上培养3 d后,从中取20 mL倒入另一瓶装有300 mL PDB培养基的锥形瓶中,在30 ℃、90 r/min的水平摇床中培养1 d后,用无菌4 层纱布对320 mL PDB发酵液进行过滤。在1 mL离心管中装入0.5 mL甘油(质量分数80%)和0.5 mL过滤后的PDB发酵液作为种子液,并将离心管放入-30 ℃低温保存箱中冷冻保存。
液体发酵培养制备:将培养好的种子液按体积分数3%的接种量接种于装有100 mL PDB的500 mL锥形瓶中,用8 层纱布封好,在30 ℃、90 r/min的水平摇床上培养3 d。
1.3.2 培养方法和菌落计数
根据GB 4789.15—2016《食品国家安全标准 食品微生物学检验 霉菌和酵母计数》中的标准,采用梯度稀释和涂布平板法进行孢子数测定。
在已编号的5 0 0m L锥形瓶中装入配制好的100 mL PDB液体培养基,每个锥形瓶中放入玻璃珠10 颗,在高温高压灭菌锅中121 ℃灭菌20 min;待液体培养基温度降至常温时使用种子液进行接种,每瓶接种量3%,不同条件下的液体培养基在接种完成后于30 ℃、90 r/min水平摇床上培养3 d,3 d后在无菌操作台进行梯度稀释和平板涂布。
将90 mL质量浓度0.9 g/100 mL的生理盐水加入10 mL接种培养后的PDB液体培养基,进行10 倍稀释;取1 mL稀释10 倍的菌液,置于装有9 mL生理盐水的试管中进一步稀释,以此类推,本研究具体稀释倍数根据涂布平板菌落计数情况而定。稀释后用固体培养基进行平板涂布,取每个稀释倍数的溶液100 μL进行涂布,并做3 个平行样。涂布完成将平板置于30 ℃恒温恒湿培养箱培养3 d后进行平板计数,根据平行样品的平板计数结果计算平均值。
1.3.3 单因素试验设计
1.3.3.1 氮源种类及添加量对紫红曲霉M-4产孢子数的影响
氮源种类的选择:选用葡萄糖为固定碳源(添加量2.0 g/100 mL),查阅参考文献[2,8,17],选择马铃薯浸粉、蛋白胨和酵母浸膏为氮源(添加量均为0.4 g/100 mL),考察氮源种类对产孢子数的影响。
氮源添加量的选择:选用葡萄糖为固定碳源(添加量2.0 g/100 mL),根据氮源种类试验结果选择氮源,添加量分别取0.2、0.3、0.4、0.5、0.6 g/100 mL,考察氮源添加量对产孢子数的影响。
1.3.3.2 碳源种类及添加量对紫红曲霉M-4产孢子数的影响
碳源种类的选择:固定氮源为每100 mL中添加0.4 g马铃薯浸粉,查阅参考文献[16,20],选择大米粉、甘油、蔗糖和葡萄糖为碳源(添加量均为2.0 g/100 mL),考察碳源种类对产孢子数的影响。
碳源添加量的选择:固定氮源为每100 mL中添加0.4 g马铃薯浸粉,根据碳源种类试验结果选择碳源,碳源添加量分别取1.6、1.8、2.0、2.2、2.4 g/100 mL,考察碳源添加量对产孢子数的影响。
1.3.3.3 pH值对紫红曲霉M-4产孢子数的影响
在基础液体培养基基础上,测定不同pH值条件对紫红曲霉M-4产孢子数的影响。首先对自然状态下的pH值进行测定;在已编号的500 mL锥形瓶中各加入100 mL基础液体培养基,用pH计测定后用乳酸和氢氧化钠将pH值分别调至5.42、5.72、6.02、6.32、6.72、7.02、7.32、7.62,考察pH值对产孢子数的影响。
1.3.3.4 装液量对紫红曲霉M-4产孢子数的影响
在已编号的500 mL锥形瓶中分别加入80、100、120、140、160 mL基础液体培养基,考察装液量对产孢子数的影响。
1.3.3.5 金属离子对紫红曲霉M-4产孢子数的影响
在已编号的500 mL锥形瓶中各加入100 mL基础液体培养基,然后分别加入CaCl2、CaCO3、NaCl、MgCl2、ZnSO4和KCl 6 种金属离子化合物(添加量均为2 g/L),考察金属离子对产孢子数的影响。
1.3.3.6 传代次数对紫红曲霉M-4产孢子数的影响
根据上述试验所得最优条件进行实验。菌株接种培养基发酵3 d后为第1代,进行梯度稀释和平板涂布,从第1代结束时的培养基中抽取发酵液,按照3%接种量接种到新配制的培养基中,培养3 d即为第2代,进行梯度稀释和平板涂布,以此类推得到第3代、第4代和第5代,考察传代次数对产孢子数的影响。
1.3.3.7 培养时间对紫红曲霉M-4产孢子数的影响
根据上述试验所得最优条件进行实验,培养完成后发酵液分别在培养第3、4、5、6、7、8、9、10天后进行梯度稀释,考察培养时间对产孢子数的影响。
1.3.4 响应面试验设计
根据单因素试验结果,选取马铃薯浸粉添加量(A)、葡萄糖添加量(B)和培养时间(C)3 个因素,以紫红曲霉M-4产孢子数(R)为响应值,根据Box-Behnken软件进行中心组合设计,设计3因素3水平的响应面试验,试验因素及水平如表1所示。每组实验重复3 次。

表1 响应面试验因素及水平Table 1 Codes and levels of independent variables used for response surface methodology
1.4 数据处理
采用Excel软件统计实验数据,采用Origin 9.0软件作图,并用SPSS 22.0和Design-Expert 8.0.6软件对数据进行处理和差异显著性分析。
2 结果与分析
2.1 氮源种类及添加量对紫红曲霉M-4产孢子数影响的试验结果
2.1.1 氮源种类的确定

表2 氮源种类对紫红曲霉M-4产孢子数的影响Table 2Effect of nitrogen sources on spore number of Monascus purpureus M-4
由表2可知,在碳源种类和添加量相同的条件下,以马铃薯浸粉作为氮源时,紫红曲霉M-4产孢子数最多,明显高于蛋白胨作氮源时的产孢子数。而以酵母浸膏作为氮源时,计数平板上并没有菌落生长,可能由于酵母浸膏无法被紫红曲霉M-4消化利用,导致菌株无法生长繁殖。蛋白胨中虽然有许多蛋白质及游离多肽,但是马铃薯浸粉中也含有大量蛋白质,以及一些生长因子[25],用于培养霉菌的PDA培养基均以马铃薯浸粉作为氮源,因此紫红曲霉M-4的最佳氮源种类是马铃薯浸粉。
2.1.2 氮源添加量的确定
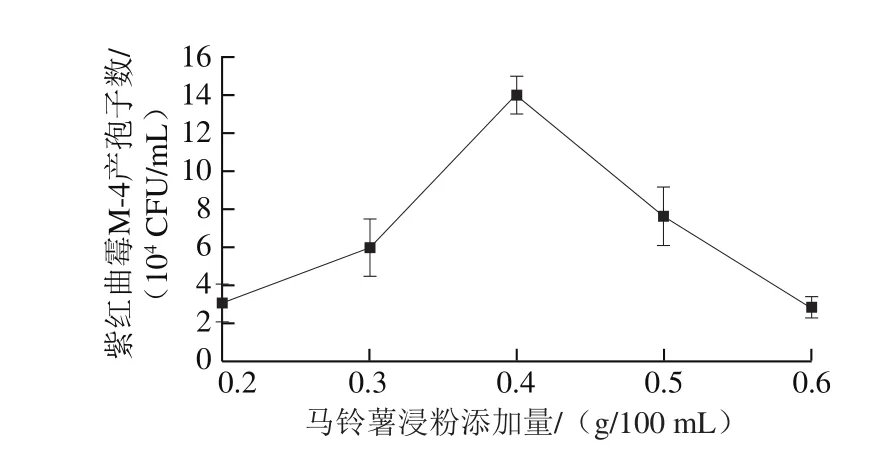
图1 氮源添加量对紫红曲霉M-4产孢子数的影响Fig. 1Effect of nitrogen source concentration on spore number of Monascus purpureus M-4
氮源是紫红曲霉生长代谢过程中必不可少的,氮源过多或过少均对菌株产孢子数有一定影响。由图1可知:在马铃薯浸粉添加量较低时,逐渐增加马铃薯浸粉添加量,紫红曲霉M-4产孢子数也会逐渐增加,当马铃薯浸粉添加量为0.4 g/100 mL时,紫红曲霉M-4产孢子数最多;继续提高氮源添加量时,反而会抑制紫红曲霉M-4的产孢子情况,表明紫红曲霉M-4在营养充足的情况下,菌体会大量繁殖,而产孢子等途径被抑制。因此马铃薯浸粉的最佳添加量为0.4 g/100 mL。
2.2 碳源种类及添加量对紫红曲霉M-4产孢子数影响的试验结果
2.2.1 碳源种类的确定
传统发酵多为固态发酵,固态发酵大都选用大米为碳源,而液态发酵选用的碳源种类较多,有大米粉、葡萄糖、蔗糖、甘油、麦芽糖等[22,25-26]。
在微生物生长期间,紫红曲霉M-4能快速消耗碳源,消耗过程中产生的一些代谢产物累积在培养基中,会对紫红曲霉M-4的生长代谢起到一定的抑制作用。在培养期间,肉眼可观察到用葡萄糖作为碳源的培养基中菌丝体较蔗糖与大米粉作为碳源时多,但是以蔗糖和葡萄糖作为碳源的培养基中菌丝体数量大致相同。

表3 碳源种类对紫红曲霉M-4产孢子数的影响Table 3Effect of carbon sources on spore number of Monascus purpureus M-4
由表3可知,当氮源确定为马铃薯浸粉且添加量为0.4 g/100 mL时,以葡萄糖作为碳源,同等培养条件下紫红曲霉M-4产孢子数明显多于用大米粉、甘油和蔗糖作为碳源时的产孢子数。因此,选用葡萄糖作为紫红曲霉M-4的最佳碳源种类。
2.2.2 碳源添加量的确定

图2 碳源添加量对紫红曲霉M-4产孢子数的影响Fig. 2 Effect of carbon source concentration on spore number of Monascus purpureus M-4
葡萄糖作为能被快速利用的单糖,经常被用来作为霉菌、酵母菌和真菌等微生物的碳源。由图2可知,葡萄糖添加量在1.6~2.0 g/100 mL范围时,紫红曲霉M-4产孢子数逐渐增多,当葡萄糖添加量为2.0 g/100 mL时,紫红曲霉M-4产孢子数达到最大值,之后继续增加葡萄糖添加量,紫红曲霉M-4产孢子数反而降低。葡萄糖虽然是本研究中紫红曲霉M-4的最优碳源,但是葡萄糖添加量过多或过少都对菌株产孢子不利。葡萄糖添加量较少时,由于营养不充足,导致紫红曲霉M-4无法大量繁殖,产孢子数也较少;但当葡萄糖添加量过多时,紫红曲霉M-4生长过程中产生的一些代谢物不断累积,可能会对其生长起到抑制作用,也不利于产生更多孢子。因此葡萄糖添加量为2.0 g/100 mL时最有利于紫红曲霉M-4产生孢子。
2.3 pH值对紫红曲霉M-4产孢子数影响的试验结果
紫红曲霉是嗜酸性菌,大多数菌株的最适pH值在3.5~7.5之间,在偏酸的环境中生长情况更好,特别是在含乳酸的环境中[27]。所有微生物都有适合生长的最适pH值范围,选择最适的pH值更有利于紫红曲霉M-4的生长繁殖。

图3 pH值对紫红曲霉M-4产孢子数的影响Fig. 3 Effect of medium pH value on spore number of Monascus purpureus M-4
由图3可知,初始pH值对紫红曲霉M-4的生长有一定影响,紫红曲霉M-4虽然是嗜酸性菌,但是过酸环境还是会影响其生长代谢及产孢子情况,培养基碱性pH值条件也不利于菌株的产孢子情况。当培养基pH值为5.42~6.32时,随着pH值逐渐提高,紫红曲霉M-4产孢子数逐渐增多;培养基自然条件下pH值(6.72)时,紫红曲霉M-4产孢子数达到最大值;之后继续提高培养基pH值,紫红曲霉M-4产孢子数迅速降低。这可能是由于过高的pH值钝化了紫红曲霉M-4产孢子代谢过程中的酶类,使得菌体产孢子数迅速降低[28]。因此培养基自然pH 6.72条件下最有利于紫红曲霉M-4代谢产生孢子。
2.4 装液量对紫红曲霉M-4产孢子数影响的试验结果
氧元素不仅是大多数微生物生存的必要条件,同时也是生物体重要代谢过程中不可缺少的元素,在好氧微生物的生长代谢中极其重要。紫红曲霉是好氧微生物,在培养过程中,溶氧量也是影响菌株产孢子数的因素。
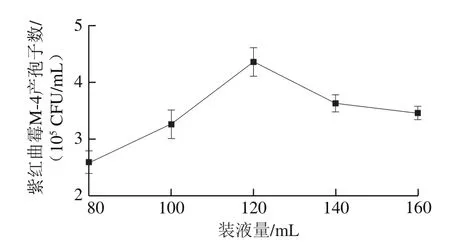
图4 装液量对紫红曲霉M-4产孢子数的影响Fig. 4 Effect of medium volume on spore number of Monascus purpureus M-4
由图4可知,在上述各因素较适值条件下,随着装液量的增加,紫红曲霉M-4产孢子数先上升然后缓慢下降。当装液量为80 mL时,紫红曲霉M-4产孢子数最少;当装液量在80~120 mL之间时,紫红曲霉M-4产孢子数逐渐上升;当装液量为120 mL时,紫红曲霉M-4产孢子数高于其他装液量时的产孢子数,达到最大值;当装液量大于120 mL后,紫红曲霉M-4产孢子数开始缓慢下降。由此可以推测,装液量太多可能不利于培养基中氧气的扩散,会导致菌株发酵供氧量不足,对紫红曲霉M-4的生长和代谢产孢子不利;但装液量太少,氧含量会过多,导致菌株产生大量菌丝体,而产孢子数偏少。考虑到时间和效率综合因素,最有利于紫红曲霉M-4代谢产孢子的装液量为120 mL(500 mL锥形瓶)。
2.5 金属离子对紫红曲霉M-4产孢子数影响的试验结果
金属离子通常只有在低添加量条件下才能对微生物的生长起到一定的促进作用,在高添加量条件下反而会抑制其生长代谢[29],因此设置金属离子添加量仅为2 g/L。
由图5可知,加入不同的金属离子对紫红曲霉M-4产孢子数影响较大。锌离子虽然是多种酶的辅酶,但是在培养基中添加ZnSO4后反而完全抑制了紫红曲霉M-4产生孢子,产孢子数为0;而加入CaCO3的培养基中紫红曲霉M-4产孢子数最大,其次是加入KCl的培养基,再次是加入CaCl2和NaCl的培养基,但2 组的产孢子数较为相近。与不添加金属离子的培养基相比,加入合适的金属离子能明显提高紫红曲霉M-4的代谢产孢子数。因此,对紫红曲霉M-4产孢子数有显著提高作用的金属离子来源是CaCO3。

图5 金属离子对紫红曲霉M-4产孢子数的影响Fig. 5 Effect of metal ions on spore number of Monascus purpureus M-4
2.6 传代次数对紫红曲霉M-4产孢子数影响的试验结果
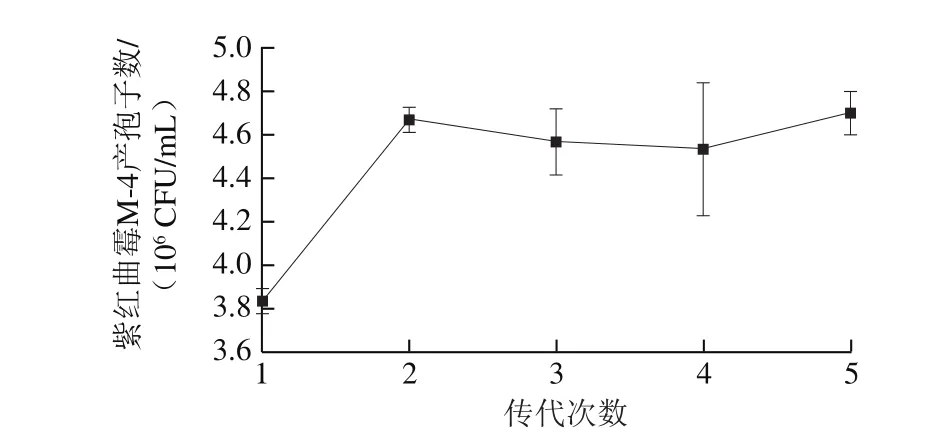
图6 传代次数对紫红曲霉M-4产孢子数的影响Fig. 6Effect of number of passages on spore number of Monascus purpureus M-4
检测紫红曲霉M-4传代后的活性是否优于不经传代的紫红曲霉M-4,同时考察紫红曲霉M-4传代后是否具有稳定性。由图6可知,紫红曲霉M-4从第1代传代到第2代时,产孢子数大幅度提高,从第2代到第5代,菌株产孢子数几乎持平,没有明显增加或减少。说明紫红曲霉M-4经第1代培养后,培养基中已有较多的孢子,再接种到新的培养基时,在营养充足的条件下,菌株开始迅速生长繁殖和代谢产生孢子,之后再接种到新的培养基时,相较于第2代无明显变化。与不经传代比较,紫红曲霉M-4传代1 次后产孢子数明显升高。因此,紫红曲霉M-4产孢子数较高的传代次数为2 代。
2.7 培养时间对紫红曲霉M-4产孢子数影响的试验结果
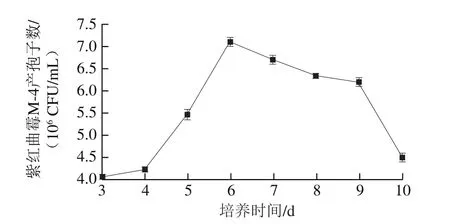
图7 培养时间对紫红曲霉M-4产孢子数的影响Fig. 7 Effect of culture time on spore number of Monascus purpureus M-4
由图7可知:培养3~6 d时,随着时间的延长,紫红曲霉M-4产孢子数逐渐增多,其中4~6 d的增长量最大,第6天时菌落计数最多;但培养6 d后紫红曲霉M-4产孢子数不但没有上升,反而开始缓慢下降,从第9天开始大量减少。由此可见,发酵前期处于紫红曲霉M-4的生长繁殖产孢子阶段,培养第6天时紫红曲霉M-4产孢子数达到最大值,之后开始减少,这可能是由于在发酵后期,营养底物减少、pH值上升、生长空间减少等原因造成菌株产孢子数下降,同时孢子之间竞争营养物质和生存空间,使部分孢子失活,菌落计数减少。
2.8 响应面试验结果及分析
2.8.1 响应面试验结果
根据Box-Behnken试验设计方法进行3因素3水平响应面试验,共设计17 个试验组,其中12 组为分析点,5 组为零点试验,用以估计误差。试验设计方案及结果如表4所示。
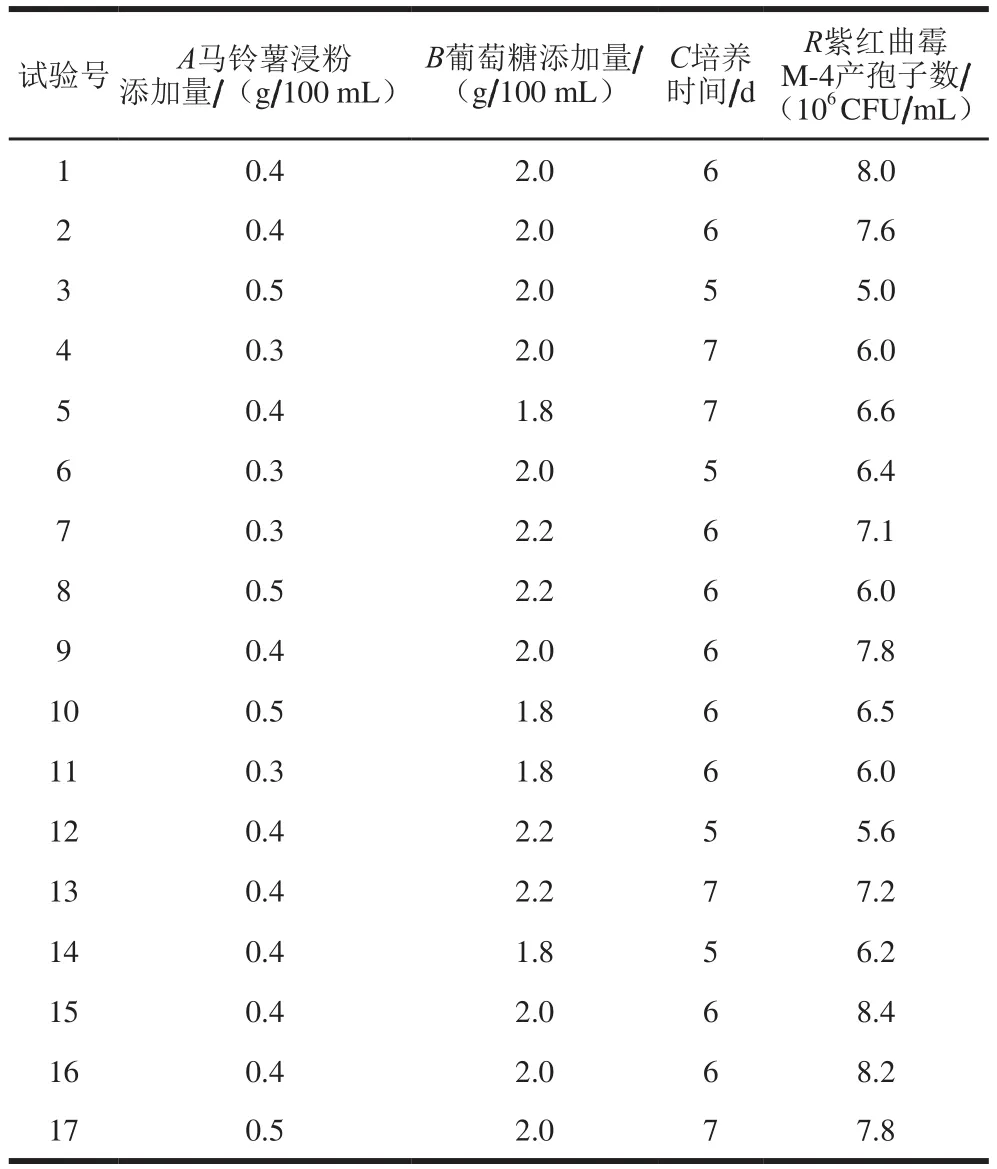
表4 Box-Behnken试验设计方案及结果Table 4 Box-Behnken design with experimental results
2.8.2 回归模型的建立及显著性分析
根据Design-Expert(Version 8.0.6)软件对表4数据及结果进行多元回归拟合分析,得到紫红曲霉M-4液态发酵产孢子数(R)对马铃薯浸粉添加量(A)、葡萄糖添加量(B)和培养时间(C)3 个因素的二次多项式回归模型为R=-0.025A+0.075B+0.550C-0.400AB+0.800AC+0.300BC-0.850A2-0.750B2-0.850C2。
由表5可知,模型的P值远远小于0.01,说明该模型极显著,与实际试验拟合较好。决定系数R2=0.963 3,说明优化所得试验值与模型回归值有良好的一致性。校正系数R2Adj=0.916 0,说明该模型能够很好地解释91.60%的响应值变化,失拟项F值为0.63,P值为0.631 4,大于0.05,表明模型失拟项不显著,能很好地说明该方程充分反映了紫红曲霉M-4的实际产孢子数情况。因此,该模型拟合程度良好,可以用此模型来分析和预测营养和培养条件对提高紫红曲霉M-4产孢子数的影响。
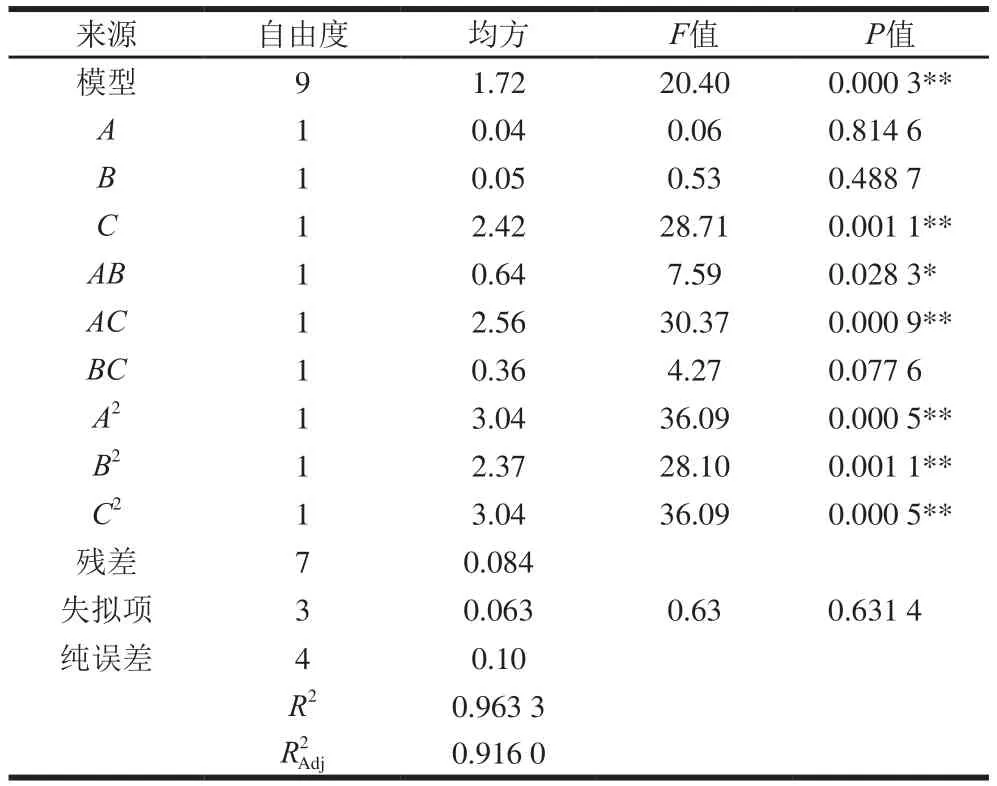
表5 Box-Behnken试验设计结果的方差分析Table 5 Analysis of variance of quadratic polynomial model
2.8.3 各因素交互作用分析
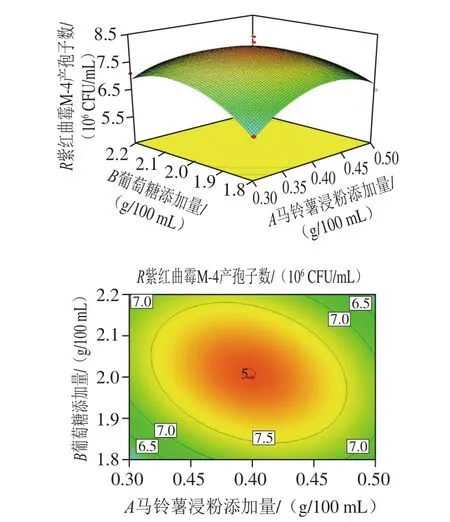
图8 马铃薯浸粉添加量和葡萄糖添加量对紫红曲霉M-4产孢子数影响的响应面图及等高线图Fig. 8 Response surface and contour plots showing the interactive effects of potato and glucose concentration on spore production of Monascus purpureus M-4

图9 马铃薯浸粉添加量和培养时间对紫红曲霉M-4产孢子数影响的响应面图及等高线图Fig. 9Response surface and contour plots showing the interactive effects of potato concentration and incubation time on spore production of Monascus purpureus M-4
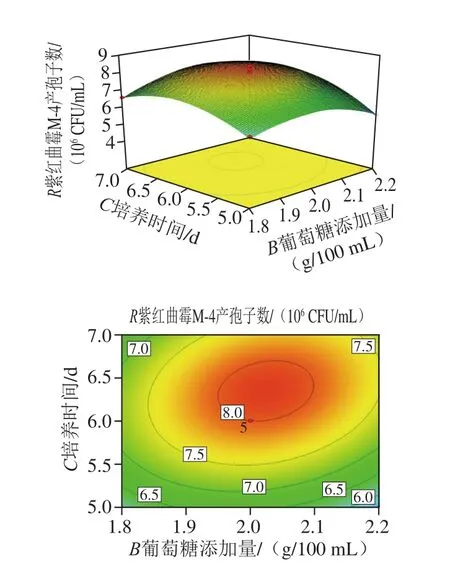
图10 葡萄糖添加量和培养时间对紫红曲霉M-4产孢子数影响的响应面图及等高线图Fig. 10Response surface and contour plots showing the interactive effects of glucose concentration and incubation time on spore production of Monascus purpureus M-4
采用Design-Expert(Version 8.0.6)软件对表4数据进行二次多元回归拟合分析,得到各因素交互作用的响应曲面和等高线图,可以直观地看出不同营养因素和培养条件对紫红曲霉M-4产孢子数的影响。由8~10可知:从等高线图可以看出,马铃薯浸粉添加量与葡萄糖添加量、马铃薯浸粉添加量与培养时间的交互作用均显著;从响应面图可以看出,培养时间对紫红曲霉M-4产孢子的促进作用最大,表现为曲面最陡;马铃薯浸粉添加量的促进作用最小,曲面最为平缓。
2.8.4 最优组合及验证实验结果
由等高线图和响应面图可知,回归模型存在最大值。通过响应面软件分析得到紫红曲霉M-4液态发酵产孢子数的优化条件为马铃薯浸粉添加量0.38 g/100 mL、葡萄糖添加量2.2 g/100 mL、培养时间6.5 d,此条件下理论预测紫红曲霉M-4最大产孢子数为(7.53±0.31)×106CFU/mL。为验证结果的可靠性,采用响应面分析法得到的优化条件进行3次平行实验,结果表明,紫红曲霉M-4产孢子数为(7.47±0.15)×106CFU/mL,与理论预测值的平均误差为0.79%,表明响应面法优化得到的模型参数准确可靠。
3 结论
在红曲霉干酪制作中,二级发酵剂中的孢子数是红曲霉干酪发酵与成熟的重要影响因素,直接影响最终的干酪品质。为提高红曲霉干酪发酵菌种紫红曲霉M-4的产孢子数,对紫红曲霉M-4进行液态发酵,通过优化培养基成分及培养条件,达到提高菌株产孢子数的目的。
在基础液体培养基的基础上,进行单因素试验,结果表明:最佳氮源为马铃薯浸粉,进一步确定其最优添加量为0.4 g/100 mL;最佳碳源为葡萄糖,最优添加量为2.0 g/100 mL;pH 6.72时(自然状态下)紫红曲霉M-4产孢子情况较好;最佳装液量为120 mL(500 mL锥形瓶);CaCO3为培养基的最佳金属离子来源;菌株培养产孢子的最佳传代次数为2 代,此条件下连续培养6 d,菌株产孢子数可达到最高值。通过响应面方法分析得到紫红曲霉M-4液态发酵产孢子数的优化条件为马铃薯浸粉添加量0.38 g/100 mL、葡萄糖添加量2.2 g/100 mL、培养时间6.5 d,此条件下紫红曲霉M-4最大产孢子数为(7.47±0.15)×106CFU/mL,较优化前提高30.13 倍,效果较显著,菌株单位体积的产孢子能力得到大幅度提升。
