胃息肉的诊治进展
2020-01-17苏红霞王玉平关泉林周永宁
李 转, 苏红霞, 路 红, 王玉平, 关泉林, 周永宁
1.兰州大学第一临床医学院,甘肃 兰州 730000; 2.兰州大学甘肃省胃肠病重点实验室; 3.兰州大学第一医院肿瘤外科; 4.兰州大学第一医院消化内科
胃息肉是指起源于胃黏膜上皮的有蒂或无蒂病变,呈局限性并向胃腔内突出。息肉患者一般无明显的临床症状,大多是在因其他原因行胃镜检查过程中发现的[1],随着胃镜检查的普及和人们医疗意识的提高,胃息肉的检出率逐年升高。虽然胃息肉是一种良性病变,但其具有恶变成胃癌的潜能,腺瘤性息肉更是被视为癌前病变。在恶性肿瘤中胃癌的死亡率居第3位,早期胃癌预后较好,但晚期胃癌仍无法治愈,所以胃癌的早期诊断是决定患者预后的关键[2]。为了提高临床医师对胃息肉的了解,辅助胃息肉的诊断及治疗,本文结合胃息肉的研究现状,从其分类、病因、临床特征、检查手段、治疗措施等方面作一概述。通过对胃息肉的深入了解,临床医师可根据患者的实际情况选择最合适的检查及治疗手段并进行随访。
1 胃息肉的分类
1.1 形态学分类山田分型:日本的山田[3]将胃内隆起性病变按其形态的不同,不论其性质将其分为四型。Ⅰ型:呈丘状,隆起的起势部较平滑而无明确的境界;Ⅱ型:呈半球状,隆起的起势部有明确的境界;Ⅲ型:有亚蒂,隆起的起势部略小,形成亚蒂;Ⅳ型:有蒂,隆起的起势部有明显的蒂部。
中村分型:中村则按息肉的形态和组织学改变将其分为三型。Ⅰ型:最多,一般直径不超过2 cm,多数有蒂,也可无蒂,表面比较光滑,呈颗粒状、乳头状或绒毛状,色泽与周围黏膜相同,也可呈暗红色,多见于胃窦部;Ⅱ型:多见于胃窦部与胃体交界处,息肉顶部常发红、凹陷,是由于反复的黏膜缺损,再生修复而形成,合并早期胃癌最多;Ⅲ型:呈平盘状隆起,即息肉部位较周围黏膜稍隆起,但不超过黏膜厚度的2倍。
巴黎分型:根据Paris分类[4-5],若息肉样病变的高度是相邻黏膜厚度的2倍,则将其归类为Paris 0-I,并可进一步分为有蒂(Paris 0-Ip:有窄基)和无蒂(Paris 0-Is:基部和顶部直径相同)息肉,中间形式为半有蒂息肉(Paris 0-Isp)。
胃息肉山田分型及巴黎分型如图1所示。
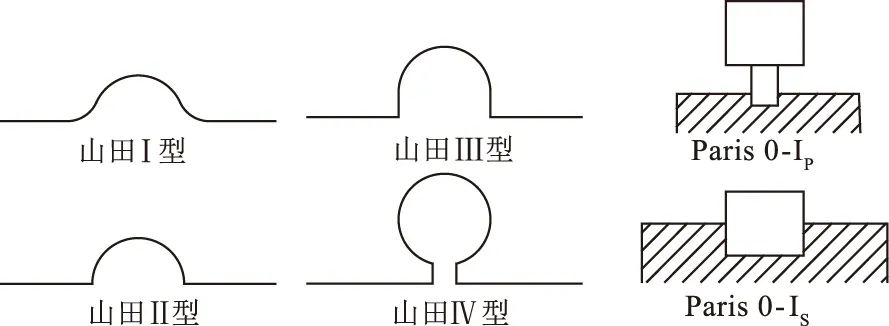
图1 山田分型及巴黎分型
1.2 组织学分类根据世界卫生组织分类[6],增生性息肉(hyperplastic polyps, HPs)、腺瘤性息肉(adenomatous polyps, APs)和胃底腺息肉(fundic gland polyps, FGP)是胃息肉最常见的3种亚型。HPs:HPs是隐窝上皮细胞炎性反应性增生,表现为腺体隐窝增生延长、扭曲或囊状扩张、排列紊乱、间质内有少量炎性细胞浸润。周围胃黏膜表现为慢性胃炎伴幽门螺杆菌(Helicobacter pylori,H.pylori)感染,并可观察到不同部位的肠化生或异型增生[7]。APs:APs是一种肿瘤,内衬着异型增生的上皮细胞,这些上皮细胞可能含有异型增生的杯状细胞、壁细胞和潘氏细胞。FGP:FGP由扩张的胃底泌酸腺组成,内衬有组织紊乱的扁平壁、主细胞或颈黏液细胞,表面则内衬正常的胃凹上皮,周围胃黏膜无萎缩性胃炎或肠上皮化生[8]。
2 胃息肉发生的相关危险因素
胃息肉的发生、发展与多种因素有关。NAM等[9]研究表明,H.pylori感染为增生性息肉的高危因素,在根除H.pylori后部分胃息肉可自行消退。TRAN-DUY等[10]一项Meta分析结果提示质子泵抑制剂的长期使用与胃底腺息肉的发生密切相关。此外,胃息肉的发生与食用高温食物、吸烟、饮酒、进食蔬菜水果等生活方式,与慢性胃炎、胆汁反流、胃食管反流病等疾病之间也存在相关性[11-12]。
3 胃息肉临床特征
3.1 流行状况胃息肉的发病率为1.0%~6.4%[13],且近10年间胃息肉发病率呈上升趋势,在不同时间、不同地区,胃息肉的发病率差异较大[14-16]。然而胃息肉确切的发病率和患病率在普通人群中是未知的,因为这些病变的特点是无明显临床症状,多数是在行上消化道内镜检查中被偶然发现的。
胃息肉多位于胃体、胃窦,分别占比约为37.3%和35.3%,且以单发多见。息肉一般体积较小,直径多<1 cm,直径>2 cm的息肉占比仅约15.0%,在山田分型方面,山田Ⅰ型和Ⅱ型最多见,约占50.3%,Ⅳ型最少[7, 17-18]。胃息肉患者中以女性为主,男女比例约为1∶(1.245~3.21)[19-22]。对于该现象发生的原因,有文献报道[23],可能是由于女性更容易发生十二指肠液的反流,而该反流可导致胃黏膜的炎性增生,甚至影响胃内的pH值和胃体腺体分泌功能,进而导致胃息肉的发生。另有文献报道[7],息肉患者的中位年龄为58岁,而在女性中,其发病年龄超过绝经期的中位年龄,这提示激素可能存在影响。
3.2 临床症状在绝大多数病例中,胃息肉患者无症状或仅有轻微消化系统症状。少数有症状的患者中最常见的是消化不良(38.5%),其次是上腹部疼痛(27.5%)和贫血(11%)[24]。但在某些情况下,胃息肉可伴有较为严重的症状及并发症,如消化道出血、幽门梗阻等。NAYUDU等[25]曾报道过1例胃HPs导致的消化道大出血,最终患者死亡。较大的位于幽门部的息肉可导致幽门梗阻,幽门梗阻在病例报告中被描述为胃窦息肉的一种表现,间歇性地进入或通过幽门[26],但胃息肉导致的幽门梗阻较为罕见[27]。
3.3 病理分型对于胃息肉类型频谱的变化,以前人们普遍认为胃息肉中以HPs占比最高,然而近年来,研究[13]发现,FGP的检出率逐渐高于HPs。为了探讨2004年至2013年中国人群胃息肉频谱的变化,FAN等[16]研究发现,10年来FGP的频率由15%增加至77%,HPs从65%下降至15%,我们在表1中列出了不同国家(尤其是中国)前期研究中胃息肉的频谱及变化[17,20-21,28-30]。对于发生这种变化的原因,有研究[31]表示,FGP发病风险逐年增加与长期使用质子泵抑制剂有关,长期使用质子泵抑制剂可使FGP的发病风险增加4倍。而对于HPs的比例逐年减少,代飞等[32-33]认为,HPs与H.pylori感染呈正相关,而H.pylori感染总的趋势是经济水平高的地区感染率低,因此随着中国社会经济的发展和卫生条件的显著改善,人群中H.pylori感染率呈下降趋势。
4 检查手段
目前胃息肉的检出手段有X线钡餐造影、电子胃镜检查及外科手术等。因胃镜检查创伤及痛苦较小,在观察病变的同时可以取得病变处组织进行病理活检,明确病变性质,并且可行内镜窄带成像技术(narrow-band imaging ,NBI)进行检查[34],故胃镜为最常用的检出胃息肉的手段。NBI是一种内镜成像技术,可增强对浅表黏膜层黏膜微观结构和微血管形态的可视化,用于预测胃息肉样病变的组织病理学,而且,NBI内镜检查仅需在两种光源间进行转换,无需喷洒色素,便捷省时,并避免了色素对人体潜在的损害。现有的胃镜检查主要有普通胃镜及镇静胃镜检查,相对于普通胃镜,镇静胃镜检查更有利于胃息肉的检出,CHEN等[13]为评价镇静胃镜检查(异丙酚,2 mg/kg,静脉注射)在胃息肉检测中的作用,回顾性分析了695例患者的内镜资料,结果显示,镇静胃镜组胃息肉检出率明显高于对照组。且镇静不仅可减少患者在胃镜检查时的痛苦,医师也更容易观察胃体和胃底。
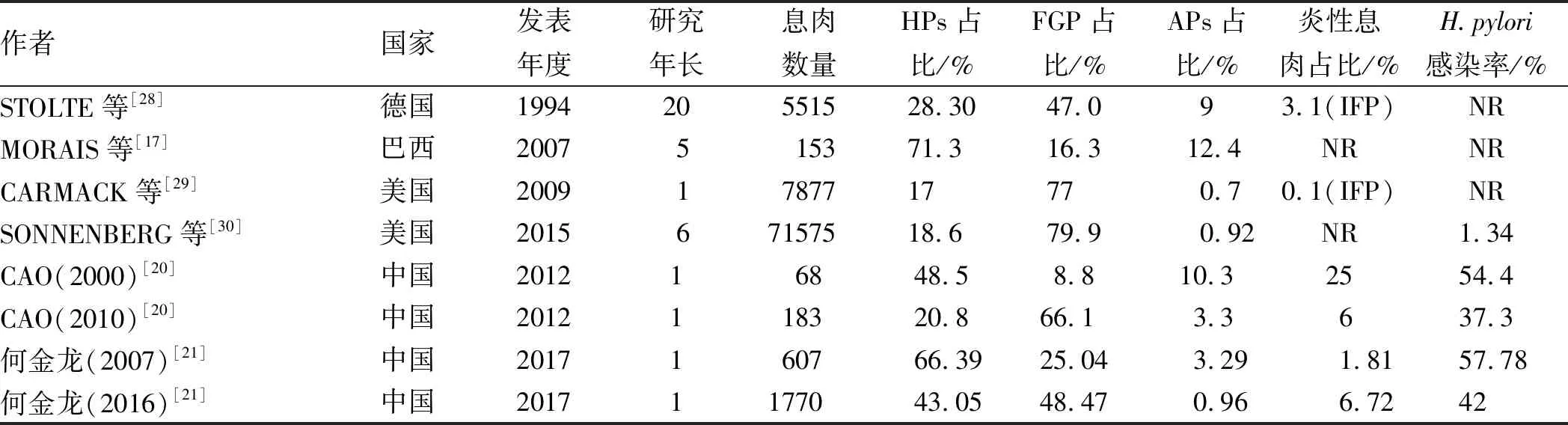
表1 前期研究中胃息肉的频谱及变化
注:IFP:炎性纤维样息肉;NR:未报道。
在胃镜下检出息肉后,需要对胃息肉的病理类型进行确定。通常来说,先对患者进行内镜检查,内镜下发现息肉后进行钳夹活检术(endoscopic forceps biopsy,EFB),根据所得标本的病理检查结果再行相应的治疗是绝大多数医院采取的治疗模式,因此,病理检查结果对患者的治疗方案及判断预后均有重要意义,且其他来源于胃黏膜上皮的病损可以伪装成上皮性胃息肉,包括神经内分泌肿瘤和异位胰腺,这也强调了进行组织学检查的重要性。但胃息肉内镜下EFB所取得的组织仅为病变的一部分,且与行内镜检查者的技术水平有关,因此用来诊断胃息肉不一定可靠。一般来说,对于较小的病变(<0.5 cm),标准EFB进行病理诊断通常足以达到97%的准确率。然而,对于较大的病变(>1 cm),由于标准EFB易出现取样错误,错过局灶性不典型增生和癌的风险增加[8, 35]。因此,对于胃息肉>1 cm时应考虑胃息肉切除术,以获得准确的诊断和治疗。除此之外,一般来说,在有HPs和APs的情况下,应对周围非息肉样胃黏膜进行取样,以排除在肠上皮化生或萎缩性胃炎背景下发生的异型增生,并诊断该患者是否存在H.pylori感染[35-36]。
胃息肉在某些因素的作用下可以逐渐发展成胃癌,JUNG[37]、苏建萍[38]研究表示,若胃息肉呈多发性、直径较大、上皮存在异型改变、周边黏膜色泽异常等,可增加其癌变的风险。不同病理类型的胃息肉分别有不同的恶变潜能,FGP几乎不会发生恶变,HPs极少发生恶变,而APs已被公认为是癌前病变[39]。何金龙等[21]研究表明,异型增生在APs中高达60.47%,而在HPs及FGP中分别为0.53%及0.20%。临床医师应提高对胃息肉的警惕,尤其是癌变率较高的APs,并及时对患者进行治疗。
5 治疗措施及随访
胃息肉的治疗措施主要包括药物缓解症状、内镜下息肉切除、外科手术息肉切除等,其治疗方法主要取决于患者的临床情况、息肉的恶性潜能及已经出现恶变的息肉所处的阶段等。
5.1 内镜下息肉切除对于胃息肉,内镜下息肉切除术是首选的治疗手段,内镜手术具有创伤小、费用低、恢复快等优点,主要包括活检咬除(biopsy)、内镜黏膜切除术(endoscopic mucosal resection, EMR)、内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)、氢离子束凝固术(argon plasma coagulation, APC)、高频电凝切除法、激光及微波灼除法、尼龙圈及橡皮圈套扎等[40-43]。根据指南,所有伴有异常增生灶和有症状的胃息肉都应被完全切除,所有的胃腺瘤性息肉也应被完全切除,且内镜下进行息肉切除术者必须精通内镜下止血技术[44-45]。
5.1.1 EMR:EMR是于胃肠病灶的黏膜下层内注射药物使其形成液体垫后,将大块的黏膜组织进行切除[46]。它很好地结合了内镜息肉高频电切术和内镜黏膜注射术两者的优点,无需开刀,可完整切除,对胃肠组织的损伤最小,且避免了肌肉层和标本的过度热损伤[47]。自20世纪80年代以来,EMR因其良好的远期疗效并且可改善患者的生活质量而被认为是侵袭性手术的替代品[40]。
5.1.2 ESD:ESD于20世纪90年代末发展于日本,是指在内镜下应用末端绝缘切开刀 (IT刀) 、钩刀 (hook刀) 、伸缩刀及辅助设备一次性完整切除较大消化道黏膜及以下病变的一种治疗方法,已经在世界范围内得到了广泛应用[48-49]。与EMR相比,ESD对早期胃癌的整体切除率和组织学完全切除率较高,局部复发率较低,长期疗效好,但其缺点是穿孔并发症发生率较高[41],不过近年来ESD的安全性和成功率已经有了很大的提高。当术前诊断困难时,有时可进行诊断性ESD以进行病理诊断[50],事实上,只有完整的病理标本才能使临床医师获得可靠的诊断,从而规划正确的治疗策略[41, 47]。
5.1.3 APC:APC 首次使用是在20世纪80年代用于开放性外科手术的止血,在1991年首次被用于内镜下治疗,它是一种非接触性息肉切除术,主要是通过高频电流以单极技术的有导电性氩气,引导至需要治疗的组织,产生凝固效应,从而达到治疗目的[51]。与传统的凝固术比较,APC具有自己独特的优势,其凝固自动导向性<3 mm,可避免患者发生消化道穿孔,另外,它也可以对需要治疗的组织表面自动导向,同时可以自行逆向凝固、侧向及轴向凝固,能够准确抵达患者消化道息肉,对病灶进行彻底清除[43, 52]。
5.1.4 高频电凝切除:高频电凝切除法的原理是利用电灼热效应从而产生局部高热, 使得组织因水分蒸发、蛋白凝固变性而被切除,是目前应用最广泛的方法[53-54]。与传统外科切除术相比, 其具有手术创伤极小,可减轻对消化道周围组织的侵扰,可一次性切除多个息肉,同时还可以彻底止血等优势,而且无需住院,可明显提高患者的预后和生活质量[53, 55-56]。
5.1.5 微波灼除术:微波灼除法是利用微波可使极性分子振动产生热效应的原理,而使组织凝固气化进行息肉灼除,且有止血作用,适用于直径<2 cm的无蒂息肉,对较小息肉可一次性灼除,较大者则需多次治疗[54]。微波灼除术有操作简便、安全性高、并发症少等优点,但与高频电凝切除术相比,其消耗时间长,术后不能取息肉进行相关病理检查[57]。而激光法则是将激光器产生的高能量激光经内镜活检孔导入的光导纤维照射病变部位,通过光能转变的热能,使其组织蛋白凝固、变性破坏而达到治疗目的,多用于宽蒂或无蒂息肉的治疗[42]。
5.1.6 尼龙圈套扎息肉:1995年ROSSINI首先报道用尼龙圈套扎息肉,单纯套扎术是以治疗内痔的弹性橡皮圈结扎原理为基础的安全有效、简便易行的治疗方法,其主要通过从息肉基底部结扎其营养血管,既可单独应用于消化道息肉治疗,使息肉缺血缺氧,坏死脱落,自行消失,也可联合高频电切治疗有利于标本回收,判断病变部位性质。另有病理结果证实,治疗后结扎部位肌层完整,仅局限于黏膜及黏膜下层产生局部缺血坏死,故尼龙圈及橡皮圈套扎息肉较安全、并发症少且经济[42, 58-59]。
内镜医师应了解各种切除技术的特点,并根据病变的情况选择合适的术式,以取得良好的临床效果。
5.2 其他治疗方法药物缓解症状主要用于因各种因素不愿或无法行息肉切除治疗的患者,针对胃息肉产生的各种不适采取对症治疗,除此之外,如果HPs和APs患者中存在H.pylori感染,应该根除H.pylori。而外科治疗则用于较大或怀疑已经存在癌变的息肉,较大息肉可行胃部分切除术、胃大部切除术,术中应行冰冻病理检查,以及时发现恶变者。胃息肉摘除治疗过程有消化道穿孔、医源性溃疡、消化道出血等风险,且费用昂贵,复发率高,痛苦大,中医通过辨证治疗,在治疗和预防消化道息肉方面也发挥了重要作用。据报道,中医治疗不但能减少和消除消化道息肉,还能预防消化道息肉的再生,效果显著,因此中医治疗可作为备选治疗方案。
5.3 随访一般认为,应在1年内对所有未切除的有异型增生的胃息肉进行重复内镜检查;或在完成息肉切除术后1年内进行重复胃镜检查,需同时关注息肉处及周围黏膜状况,以期及时发现和治疗具有恶变潜能的息肉。
6 小结
综上所述,胃息肉是一种常见的消化系统疾病,其患者常无明显临床症状,但也有报道胃息肉可出现较为严重的并发症。近年来,胃息肉的检出率逐年升高,主要原因是人们医疗意识的增强及胃镜检查的普及。由于质子泵抑制剂的频繁使用及H.pylori的感染率下降等原因,胃息肉类型频谱发生了较大的变化,FGP占比明显增加,而HPs占比明显降低。胃镜检查是检出胃息肉的主要手段,镇静胃镜较普通胃镜更有优势,EFB是最常用的活检手段,但EFB标本诊断胃黏膜息肉中缺失异型增生或癌灶的风险较大,必要时需考虑行胃息肉切除术。各种类型的胃息肉均有癌变风险,APs癌变率最高。胃息肉治疗手段较多,应根据患者实际情况选择最合适的方案并进行随访。胃息肉虽为一种良性病变,但有恶变为胃癌的潜能,需引起临床医师及患者的足够重视。
