黄芩素对TGF-β1诱导HSC-T6细胞活化的影响及其机制的研究
2020-01-17王丽萍
李 博, 马 俊, 王丽萍, 许 鸣
1.广东省第二人民医院消化科,广东 广州 510317; 2.佛山市第二人民医院消化科
肝星状细胞(hepatic stellate cell,HSC)的激活及转化,是肝纤维化发病的中心事件。干扰和阻断HSC内的信号传导,抑制HSC的活化是肝纤维化治疗策略的重要环节[1]。HSC表达的烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH oxidase,NOX)产生的活性氧(reactive oxygen species,ROS)介导了各种促肝纤维化因子在HSC内的信号传导[2]。黄芩素又称黄芩苷元(Baicalein,BAE)是从唇形科植物黄芩(Radix Scutellariae)的干燥根中提取的黄酮类化合物,有文献报道黄芩素可通过抑制HSC的活化,减少胶原的产生而发挥抗肝纤维化作用,但黄芩素抗纤维化的机制如何?本研究从黄芩素的抗氧化活性入手,旨在观察黄芩素对HSC中NOX活性及ROS的影响,以探索黄芩素抗肝纤维化的作用靶点及机制。
1 材料与方法
1.1 材料大鼠肝星状细胞株(HSC-T6)购自上海复祥生物科技有限公司,为永生化细胞,具有活化HSC的表型;胎牛血清购自吉泰生物公司;RPMI 1640培养基购自Gibco公司;鼠抗ɑ-SMA单克隆抗体购自武汉博士德生物工程有限公司;NOX活性检测试剂盒购自江苏碧云天生物技术公司;ROS检测试剂盒购自Sigma公司。
1.2 方法
1.2.1 细胞的培养与分组:在质量浓度为100 g/L胎牛血清的DMEM高糖培养基,在37 ℃,体积分数为50%的CO2及饱和湿度下培养,待细胞生长为80%~90%密度时,传代至6孔板或15 cm2培养瓶内。待细胞贴壁后除对照组和TGF-β1刺激组外,其他加药组分别加入各终浓度的黄芩素预处理HSC-T6细胞30 min后,再加入含TGF-β1(5 μg/L)的DMEM培养液处理细胞48 h。实验共分6组:A组:空白对照组;B组:TGF-β1刺激组;C组:TGF-β1+125 nmol/L黄芩素组;D组:TGF-β1+250 nmol/L黄芩素组;E组:TGF-β1+500 nmol/L黄芩素组;F组:TGF-β1+1 000 nmol/L黄芩素组。
1.2.2 MTT法检测细胞增殖率:收集对数生长期的MGC803细胞,以每孔5×103个接种细胞于细胞培养板中,按分组加药处理后加入20 μl MTT 溶液,孵育4 h,加入150 μl DMSO 震荡10 min,酶联免疫检测仪490 nm波长处测吸光度值(absorbance,A值)。
1.2.3 免疫细胞化学检测α-SMA表达:取出细胞爬片,洗涤,4%多聚甲醛固定30 min,灭活内源性过氧化物酶,加BSA封闭液,滴加适当稀释的一抗,4 ℃过夜后在37 ℃复温45 min,滴加生物素化二抗,DAB显色:取1 ml蒸馏水,加试剂盒中A、B、C试剂各1滴,混匀加至爬片,室温显色,苏木素轻度复染。脱水、透明、封片。每组图片取6个视野,采取日本OLYMPUS摄像系统和日本MetaMorph/BX41图像数据分析系统测定平均光密度值,平均光密度值越大,代表样本中目的蛋白含量越多。
1.2.4 HSC-T6细胞NOX酶活性的检测:通过分光光度计观察NADPH溶液在340 nm处吸光度值的减少来探测NADPH的消耗量,从而分析NOX的酶活性。计算NADPH消耗总量的摩尔吸光系数为6.22 L·mmol-1·cm-1,结果以pmol·min-1·mg-1表示。
1.2.5 免疫荧光染色检测细胞内ROS表达:用PBS洗细胞,加入终浓度为10 μmol/L的 DCFH-DA 500 μl,混匀重悬细胞,37 ℃、体积分数为5%的CO2培养箱内避光孵育 30 min。PBS洗涤3次,再向每管沉淀内加入PBS 500 μl重新悬浮细胞。荧光显微镜下射片,荧光酶标仪检测分析荧光强度,平均荧光强度表示ROS的相对含量。
1.3 统计学方法采用SPSS 17.0统计软件进行分析,计量数据采用均数±标准差表示,组间均数比较采用方差分析、t检验。检验水准α=0.05为双侧检验。P<0.05为差异有统计学意义。
2 结果
2.1 黄芩素对TGF-β1诱导活化的HSC-T6 细胞增殖的影响MTT 法检测显示,与对照组相比,经TGF-β1 5 μg/L刺激后,HSC-T6细胞的增殖活性明显增强(P<0.01);与TGF-β1刺激组相比,黄芩素处理组HSC-T6增殖能力明显减弱,差异有统计学意义(P<0.05、0.01,F=37.318),且呈浓度相关性。但500 nmol/L、1 000 nmol/L黄芩素处理组抗增殖作用比较,差异无统计学意义(P>0.05)(见图1)。
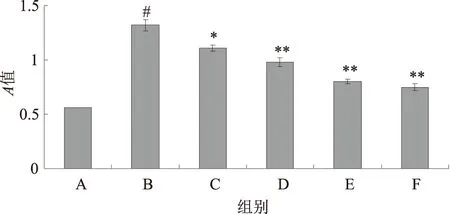
注:A:对照组;B:TGF-β1刺激组;C:TGF-β1+125 nmol/L黄芩素组;D:TGF-β1+250 nmol/L黄芩素组;E:TGF-β1+500 nmol/L黄芩素组;F:TGF-β1+1 000 nmol/L黄芩素组;与对照组比较,#P<0.01,与TGF-β1刺激组比较,*P<0.05,**P<0.01。
图1 黄芩素对TGF-β1诱导活化的HSC-T6增殖的影响
Fig1EffectofBaicaleinonproliferationoftheactivationofHSC-T6inducedbyTGF-β1
2.2 黄芩素对TGF-β1诱导活化的HSC-T6 细胞α-SMA表达的影响免疫细胞化学结果显示,与对照组比较,TGF-β1处理后,HSC-T6细胞α-SMA表达明显增加(P<0.01);黄芩素预处理后,随着黄芩素浓度的增加,ɑ-SMA表达逐渐下降,与TGF-β1处理组比较,差异有统计学意义(P<0.05)(见图2)。
2.3 黄芩素对TGF-β1诱导活化的HSC-T6 细胞NOX活性的影响TGF-β1刺激HSC-T6细胞后检测的NOX活性为(3.05±0.25)pmol·min-1·mg-1,明显高于对照组(1.22±0.15)pmol·min-1·mg-1,差异有统计学意义(P<0.01)。给予125、250、500、1 000 nmol/L黄芩素处理后NOX的活性分别为(2.89±0.35)pmol·min-1·mg-1、(2.55±0.15)pmol·min-1·mg-1、(1.88±0.45)pmol·min-1·mg-1、(1.79±0.45)pmol·min-1·mg-1,显著低于TGF-β1刺激组,差异有统计学意义(P<0.05,F=40.367)。而500、1 000 nmol/L黄芩素组比较,差异无统计学意义(P>0.05)(见图3)。
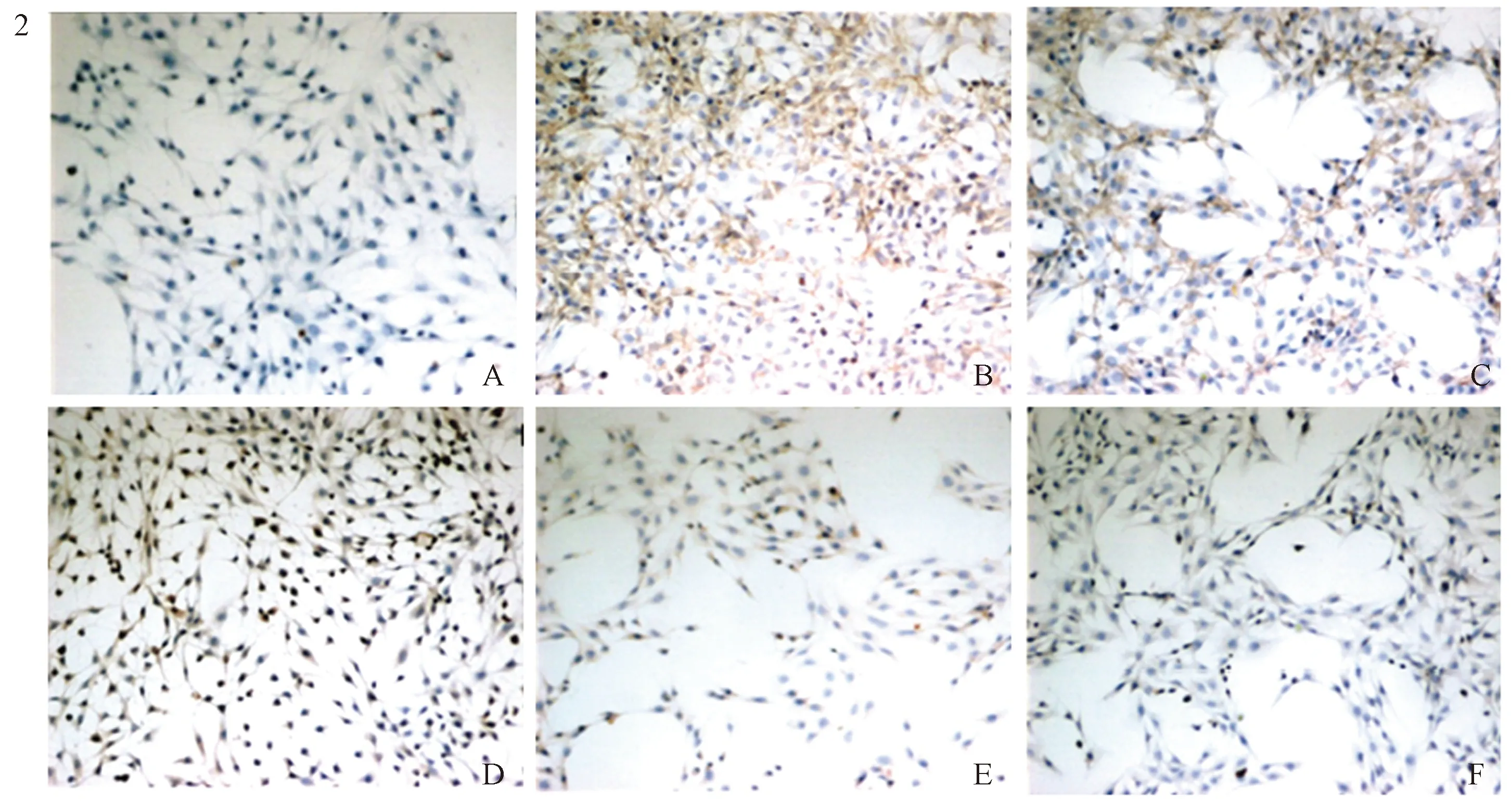
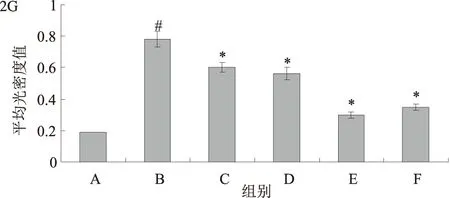
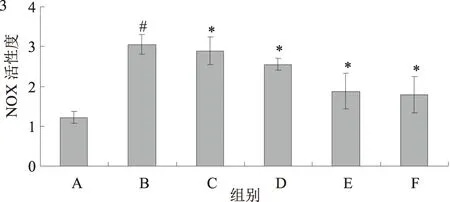
注:A:对照组;B:TGF-β1刺激组;C:TGF-β1+125 nmol/L黄芩素组;D:TGF-β1+250 nmol/L黄芩素组;E:TGF-β1+500 nmol/L黄芩素组;F:TGF-β1+1 000 nmol/L黄芩素组;G:各组α-SMA平均光密度值;与对照组比较,#P<0.01;与TGF-β1刺激组比较,*P<0.05。
图2 黄芩素抑制TGF-β1诱导活化的HSC-T6细胞α-SMA表达(放大200倍);图3 黄芩素对TGF-β1诱导活化的HSC-T6 细胞NOX活性的影响
Fig2Baicaleininhibitedtheexpressionofα-SMAinHSC-T6cellsinducedbyTGF-β1;Fig3EffectofBaicaleinonNOXactivityofHSC-T6cellsinducedbyTGF-β1
2.4 黄芩素对TGF-β1诱导活化的HSC-T6 细胞内ROS的影响TGF-β1刺激HSC-T6后细胞内ROS生成的相对百分比为(47.25±3.15)%,与对照组(8.05±3.22)%相比较,差异有统计学意义(P<0.05)。给予125、250、500、1 000 nmol/L黄芩素预处理后,HSC-T6后细胞内ROS表达分别为(30.01±3.35)%、(20.06±2.15)%、(18.07±1.45)%、(17.06±2.45)%,较TGF-β1刺激组明显下降,差异有统计学意义(P<0.05)(见图4)。
3 讨论
HSC是各种原因导致肝纤维化发生的最终共同途径,各种致肝纤维化因素也是以HSC作为靶细胞。当肝脏受到各种损伤时,HSC活化为具有高度增殖活性和α-SMA表达阳性的肌成纤维细胞,合成大量细胞外基质,导致肝纤维化发生[3]。因此,α-SMA的表达已被认为是HSC激活的显著特征之一。TGF-β是关键的促肝纤维化因子[4]。本实验中我们观察到经TGF-β1刺激后,HSC-T6细胞的增殖活性明显增强,且HSC-T6细胞中α-SMA表达升高。
ROS是一类氧衍生的分子,包括超氧化物、羟自由基、烷氧基、过氧化氢、臭氧等[5]。在炎性反应及炎性反应后阶段,ROS介导了各种促纤维化因子如转化生长因子(TGF-β)、血小板衍生生长因子(PDGF)、血管紧张素Ⅱ(AngⅡ)和瘦素(leptin)等在HSC内的信号传导,使HSC持续激活、增殖、转化,并分泌更多的促纤维化因子,形成恶性循环,促进肝纤维化发展[6]。
因此,清除过多的ROS是防治肝纤维化的重要环节。NOX是由6个亚基构成的多蛋白复合体,包括细胞膜上的催化亚基gp91pohx和调节亚基p22pohx及位于细胞质的亚基p47pohx、p40pohx、p67pohx和小G蛋白Rac,产生ROS,参与信号传导、天然免疫等许多生物学功能[7]。NOX通过产生ROS介导了TGF-β、TGF-8、PDGF、AngⅡ等促肝纤维化因子在HSC内的信号传导[8]。我们在实验中观察到HSC-T6在TGF-β1作用下细胞内NOX活性、ROS水平较对照组明显升高。说明TGF-β1能诱导HSC-T6细胞中NOX活化,产生的ROS介导细胞内信号传导。
黄芩素具有抗病毒、抗炎、抗变态反应、抗氧化、抗凝、清除氧自由基等药理学活性。有报道[9]称,黄芩素可通过抑制HSC的活化,减少胶原的产生而发挥抗肝纤维化作用。本研究发现,HSC-T6给予黄芩素预处理后其增殖程度及细胞内α-SMA表达较TGF-β1刺激组显著下降。说明黄芩素能抑制TGF-β1诱导的HSC-T6细胞的增殖与活化。进一步实验发现,黄芩素预处理的NOX活性及ROS水平较TGF-β1刺激组显著下降。
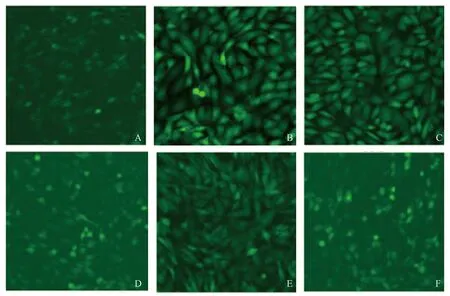
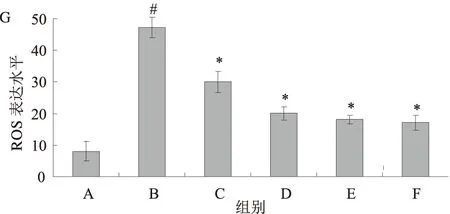
注:A:对照组;B:TGF-β1刺激组;C:TGF-β1+125 nmol/L黄芩素组;D:TGF-β1+250 nmol/L黄芩素组;E:TGF-β1+500 nmol/L黄芩素组;F:TGF-β1+1 000 nmol/L黄芩素组;G:各组ROS表达水平;与对照组比较,#P<0.01,与TGF-β1刺激组比较,*P<0.05。
图4 黄芩素对TGF-β1诱导活化的HSC-T6细胞内ROS的影响(免疫荧光染色,放大100倍)
Fig4EffectofBaicaleinonintracellularROSofHSC-T6cellsinducedbyTGF-β1
综上所述,黄芩素能抑制TGF-β1诱导HSC-T6细胞的增殖与活化,其机制可能与其阻断TGF-β1导致的HSC-T6细胞内NOX激活,抑制ROS产生,从而阻碍了下游细胞内信号传导有关。本实验结果初步揭示了黄芩素抑制HSC-T6细胞活化的作用机制,其对TGF-β1导致HSC-T6活化并向肌成纤维细胞分化的下游信号通路的影响是我们下一步的研究目标。
