光动力肿瘤精准治疗的研究进展
2020-01-15赵凯超刘茄琳刘雨诗严秀平
赵 旭, 赵凯超, 刘茄琳, 刘雨诗, 严秀平,
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122; 2.江南大学国际食品安全联合实验室,江苏无锡 214122; 3.江南大学食品学院,分析食品安全学研究所,江苏无锡 214122; 4.江南大学化学与材料工程学院,江苏无锡 214122)
1 引言
光动力治疗(Photodynamic Therapy,PDT)是一种温和、局部和相对安全的治疗模式,在癌症精准治疗方面展现了独特优势[1 - 3]。自1972年Diamond发现卟啉光敏活性可以杀死肿瘤细胞以来,涌现出了大量PDT在肿瘤治疗领域的应用研究。PDT的作用机制是在外界光源激发下,光敏剂吸收光能由基态跃迁至单重激发态,后经系间窜越至三重激发态,处于三重激发态的光敏剂可与周围的生物分子或氧气等发生电子转移或能量传递,生成对蛋白质及核酸等生物分子具有损伤作用的自由基或活性氧(Reactive Oxygen Species,ROS),从而发挥治疗活性[4 - 5]。可见,光敏剂、光源以及氧气是PDT的三个核心要素。然而,现有光敏剂分子的激发波长大多处于紫外或可见光区,生物组织对该波长范围内光的强吸收与散射使得该类光敏剂难以实现深层组织的有效治疗[6 - 8]。这些大多为“always on”型光敏剂,缺乏肿瘤靶向性及特异性,对邻近正常组织的非特异性损伤亦无法避免[9 - 10]。此外,传统光动力治疗大多依赖于外光源的持续照射来激活光敏剂产生ROS等,易引发光毒性和组织损伤[7,9 - 10]。由于肿瘤生长快速,其血管组织发育不全,导致实体肿瘤所处微环境呈乏氧状态(氧分压<5 mmHg)[11],不充足的氧气补给势必会降低PDT效率。肿瘤细胞内高浓度的还原型谷胱甘肽(Glutathione,GSH)(>10 mmol·L-1)也会消耗PDT产生的ROS等,亦会影响PDT效率[12]。因此,寻求高效可行的方法解决上述问题,对推动PDT的发展具重要意义。
本文从光敏剂、光源和氧气三要素角度,综述近年来发展的各类新型光动力治疗体系,以及它们在肿瘤精准治疗中的研究进展。
2 光敏剂
传统的光敏剂大多为有机小分子类,如已用于临床的光卟啉、四-(间羟基苯基)二氢卟吩、内源性卟啉Ⅸ及5-氨基乙酰丙酸等,缺乏肿瘤靶向性及特异性,易对正常组织等造成非特异性损伤[5,13]。利用肿瘤微环境较正常组织的差异,构建的可激活型光敏剂,可有效降低上述非特异性损伤,受到了人们的广泛关注。例如,Tian等[14]利用肿瘤细胞所处微环境具有弱酸性这一特性,设计并合成了pH激活型二乙胺基苯基及溴苯基修饰的BODIPY类光敏剂(图1a)。该材料在正常体液pH=7.4下无光敏活性,当其被肿瘤细胞内吞进入溶酶体后,被溶酶体所处酸性环境(pH=4.5~5.0)激活,在808 nm激光照射下可产生ROS,进而杀伤癌细胞。随后,Tang等[15]同样以二乙胺基苯基为pH识别基团,合成了另一类pH激活型BODIPY类光敏剂(图1b)。该材料靶向聚集于溶酶体后被溶酶体的酸性环境激活,在氙灯照射下产生,发挥光动力治疗作用。然而,pH接近5.0的酸性环境是溶酶体这一细胞器所固有的,并非癌细胞的特有属性,因此该类pH激活型光敏剂的肿瘤特异性还有待进一步提高。如何得到pH响应范围与肿瘤所处弱酸性微环境相吻合、生物相容性好的特异性光敏剂,并提升其ROS产生能力,仍是亟待解决的难题。
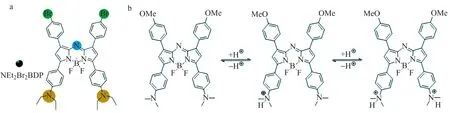
图1 pH激活型光敏剂的结构式[14 - 15]Fig.1 Structures of pH-activatable photosensitizers[14 - 15]
除传统的有机小分子外,新型纳米光敏剂已悄然兴起。肿瘤组织的高通透性和滞留(Enhanced Permeability and Retention,EPR)效应使得纳米光敏剂在肿瘤组织高效聚集,进而有望提升治疗效率。例如,Yang等[16]以商品化TiO2P25为原料,利用水热法合成TiO2纳米棒,并在其表面修饰金纳米簇,制得Au25/B -TiO2-x复合光敏剂。该纳米光敏剂不同于经典无机纳米光敏剂TiO2,可被650 nm光激发,发挥PDT抗肿瘤活性。此外,Wang等[17]通过简单剥离方法获得厚度为2.0 nm的超薄黑磷纳米片,其单线态氧量子产率高达0.91。0.5 W·cm-2的660 nm激光器照射10 min后(材料浓度为0.2 mg·L-1),肿瘤细胞的凋亡率可高达71.5%,在皮下移植瘤的治疗方面已表现出了良好应用前景。然而,肿瘤组织所固有的乏氧、还原性物质GSH过表达等特性对PDT的影响并未消除。如何设计制备性能更加优异的新型光敏剂,进一步提升其治疗效率,仍是亟待解决的问题。
Ju等[18]制备了Cu2+修饰的氮化碳纳米片(Cu2+-g-C3N4)新型光敏剂。该光敏剂在可见光照射下产生多种ROS的同时,还可将肿瘤细胞内的GSH氧化为氧化型谷胱甘肽(GSSG),使得肿瘤细胞的抗氧化能力显著降低,大大提升了其PDT抗肿瘤活性。此外,Xu等[19]设计合成了一个末端含有二硫联吡啶的新型锌酞菁类光敏剂(ZnPc-DTP),并通过分子间π-π相互作用进一步形成纳米光敏剂(ZnPc-DTP NPs),此时光动力效率较低。经尾静脉注射后,ZnPc-DTP NPs经EPR效应在肿瘤组织靶向聚集,进入肿瘤细胞后,二硫键与肿瘤细胞中过表达的GSH反应,将肿瘤细胞中的GSH氧化为GSSG,降低GSH的浓度,进而减弱其对PDT效率的影响。同时,二硫键被切断,原有的纳米结构被破坏,释放出末端含有巯基的锌酞菁(ZnPc-SH)片段,游离的ZnPc-SH具有较高的ROS产生能力,进而实现了肿瘤细胞内原位激活的高效PDT(图2)。
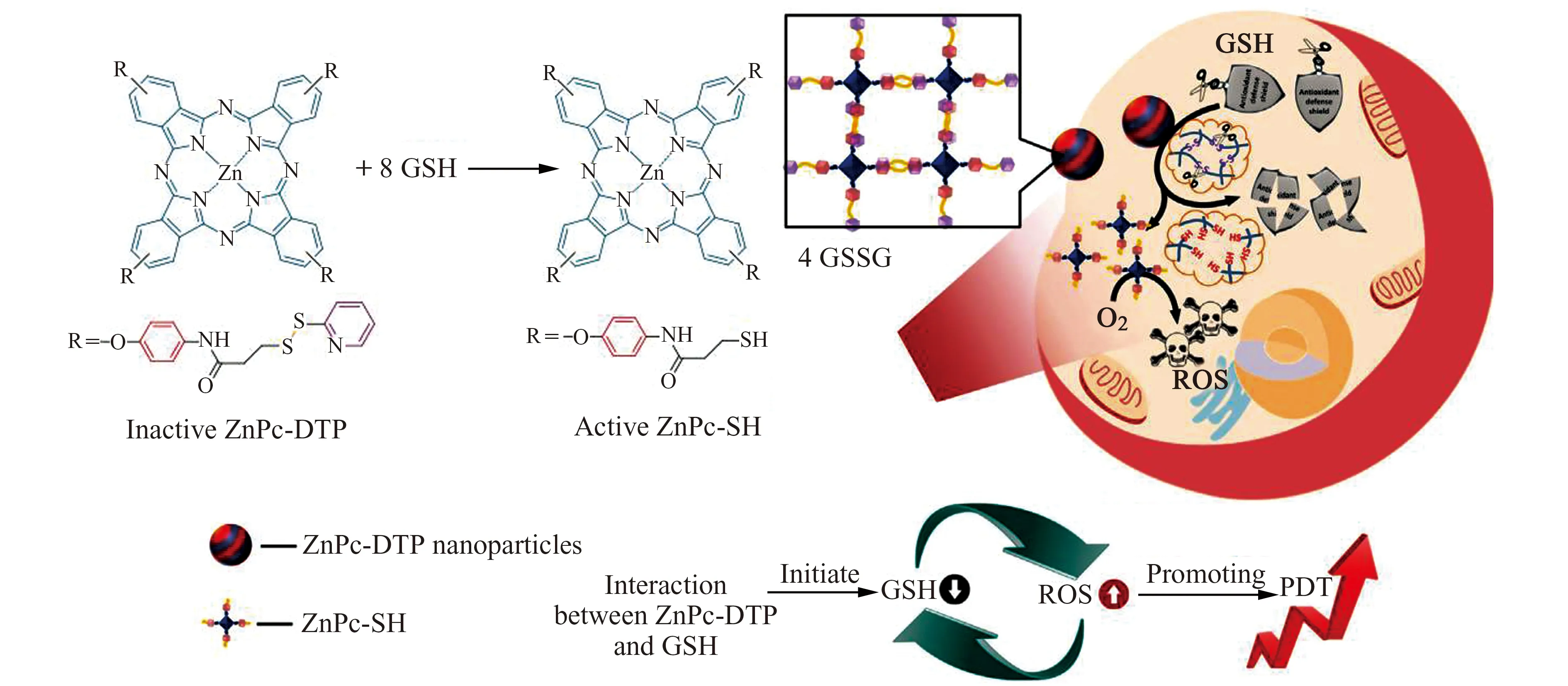
图2 ZnPc -DTP NP的抗肿瘤原理示意图[18]Fig.2 Schematic illustration of the anticancer mechanism of ZnPc -DTP NP[18]
3 光源
现有光敏剂的吸收光谱大多在紫外-可见光区,生物组织对该波长范围内光的强吸收与散射使得该类光敏剂难以实现深层组织的有效治疗[6 - 8]。随着材料科学和纳米科技的蓬勃发展,具有吸收近红外光、发出可见光性质的上转换纳米材料(Upconversion Nanoparticles,UC NPs)的出现,在一定程度上弥补了这一不足,推动了光动力治疗的发展[7,9 - 10]。例如,Li等[20]将光敏剂二氢卟吩(Chlorin e6,Ce6)与pH响应型高分子聚合物偶联,再与UCNPs(NaYF4∶Yb,Er@CaF2)和表面活性剂(Pluronic F68)自组装制得复合纳米材料。到达肿瘤微环境所处弱酸性环境后,复合材料解聚,使得原聚集淬灭的Ce6恢复活性,实现了980 nm 激光激发的PDT。Chen[21]等将光敏剂亚甲基蓝(MB)与金纳米棒(AuNR)修饰的UCNPs(NaYF4∶Yb/Er)结合,进一步修饰靶向配体叶酸(FA),构建了UCNP@SiO2∶MB-AuNRs-FA复合材料。以UCNPs作为转换光源激活MB产生1O2,用于口腔癌细胞的靶向治疗,获得了较好的PDT效果。上述研究克服了因需紫外-可见光照射而造成的组织穿透深度低等缺陷,但治疗过程需外界激发长时间连续照射引起的光毒性和组织损伤等问题不可避免,限制了光动力治疗的进一步发展与深入应用。因此,发展近红外吸收的光敏剂以及降低外光源连续照射引发的光毒性和组织损伤对推动PDT的发展具有重要意义。
长余辉纳米材料(Persistent Luminescence Nanoparticles,PLNPs)是一种新兴的光学材料,可在激发停止后持续长时间发光[7,22 - 23]。尤其是近来研发的Cr3+掺杂镓酸锌和镓锗酸锌等近红外PLNPs,其发射波长处于“生物光学窗口”内,且近红外光能够重复激发其余辉。这种独特的免连续激发、长时间近红外磷光发射特性使得近红外PLNPs除在生物传感、肿瘤诊断及成像指引的治疗等领域颇具优势外[23 - 24],在免外光源连续激发的光动力治疗方面亦崭露头角[7,25 - 27]。本课题组[7]将长余辉发光激活光敏剂的策略引入基于近红外发光PLNPs的PDT体系。设计了一种新型808 nm近红外光激励性近红外发光PLNPs(ZGGO∶Cr3+) 作为PDT的内光源,并将光敏剂硅酞菁(Si-Pc)化学键合在其表面,利用PLNPs的近红外余辉来激活其表面的Si-Pc,持续产生ROS杀死癌细胞,获得了很好的治疗效果。此外,为进一步改善长余辉纳米材料的光学性能和可控形貌,我们系统研究了影响长余辉发光的关键因素,发展了表面活性剂辅助水热/短时间高温煅烧/煅烧后水热再处理方法,成功制备了三元素掺杂的小尺寸单分散超PLNPs(ZGGO∶Cr3+,Yb3+,Er3+)[28]。在此基础上进一步发展了仿生多功能长余辉纳米平台及其转移瘤成像和光动力学/化疗联合治疗(DSPLNPs@hSiO2@CCM)(图3)[26]。以ZGGO∶Cr3+,Yb3+,Er3+为成像单元及内置激发光源,将光敏剂Si-Pc偶联在其表面,为增强材料的治疗效率,在所得材料表面进一步生长介孔硅用以包载化学治疗药物DOX,随后用肿瘤细胞细胞膜包裹以防止药物泄露并赋予材料肿瘤主动靶向识别能力。在无外光源连续激发下,复合材料对肿瘤细胞及荷瘤小鼠模型均表现出了很好的治疗效果。此外,Fan等[27]将长余辉发光材料与聚乳酸-羟基乙酸共聚物(Poly Lactic-co-glycolic Acid,PLGA)制得复合物,并将其植入肿瘤组织作为内光源。尾静脉注射光敏剂HPPH,并在第1 d及第8 d对肿瘤部位照射进行照射(白光LED,每次15 min),亦取得了较好的治疗效果。但受限于现有PLNPs的余辉强度以及生理环境等因素对余辉发光效果的影响,完全利用余辉发光作为内光源难以实现较好的体内治疗效果,仍需借助外光源的再次照射。因此,高性能、长时间发射的新型长余辉材料仍有待开发。
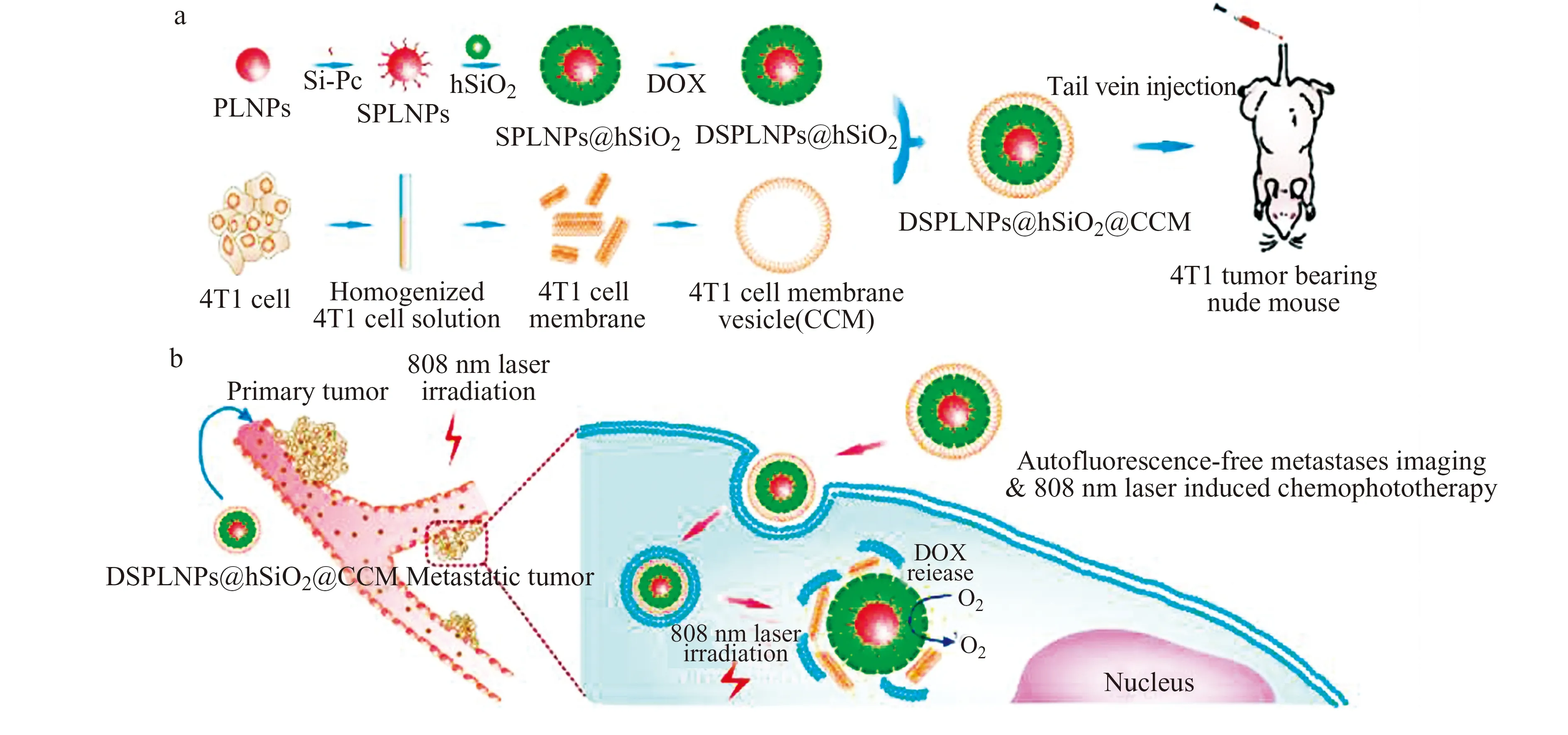
图3 DSPLNPs@hSiO2@CCM用于转移瘤成像和光动力学/化疗联合治疗示意图[26]Fig.3 Schematic illustration of DSPLNPs@hSiO2@CCM for in vivo metastases imaging and chemophototherapy[26]
4 氧气
氧气是PDT发挥活性的关键要素之一。实体肿瘤组织部位的乏氧微环境势必会会降低PDT治疗的效果。因此,寻求有效途径缓解肿瘤乏氧状态,对提升PDT效率有重要意义。为此,已有大量研究着眼于如何增加肿瘤组织部位的含氧量,进而提升PDT效率[29 - 31]。如与光热治疗(Photothermal Therapy,PTT)合用,通过升温加快肿瘤部位血流速度增加氧气供给;共载携氧剂,实现肿瘤组织部位氧气自补给;催化肿瘤细胞内高浓度的H2O2分解释放氧气等。
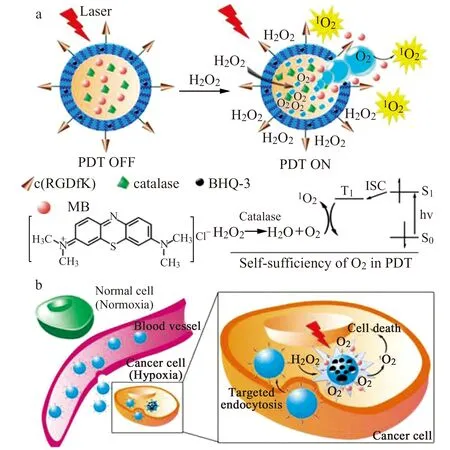
图4 HAOP NP用于乏氧肿瘤细胞的高效光动力治疗示意图[31]Fig.4 Schematic illustration of HAOP NP for efficient PDT against hypoxic tumor[31]
Guo等[29]选用近红外菁类染料Cypate作为光热治疗剂,二氢噻吩作为光动力治疗剂,与两亲性分子mPEG/b-PAsp自组装形成微球,用于荧光/光声双模态成像指引的PDT/PTT治疗,得到了相互增强的治疗效果。Luo等[30]选用近红外荧光探针IR808作为光动力治疗剂,将其键合于聚乙二醇及树枝状聚乙烯亚胺修饰的氧化石墨纳米片(NGO)上,复合材料的联合治疗效果优于单独使用NGO时产生的PDT效果及IR808产生的PTT治疗效果。上述研究虽已证实PDT/PTT相结合可实现相互增强的治疗效果,但这种基于两类不同材料实现的光热/光动力联合治疗仍存在一些不足。两类材料不同的理化性质易造成两类材料在体内分布和对靶向区域的选择并不完全相同,因此很难实现真正的精准的联合治疗;亦或需要两种波长的激发光刺激,延长了治疗时间,增加了副作用及操作难度。因此,发展兼光热及光动力两种功能于一体的新兴治疗剂将更有利于实现肿瘤精准治疗。
Chen等[31]将亚甲基蓝(MB)与过氧化氢酶同时包覆于聚合物纳米粒内部,并引入肿瘤靶向肽(RGDfK)以增强复合材料的肿瘤靶向识别及富集能力。所得复合药物HAOP NP进入肿瘤细胞后,过氧化氢酶催化细胞内高浓度H2O2分解产生氧气,为PDT供氧,实现了乏氧实体肿瘤的高效治疗(图4)。此外,还有多种催化剂催化H2O2分解产氧的研究报道,并取得了较好的治疗效果[32 - 35]。如,铂包钯纳米片(Pd@Pt)、MnO2、锰碳量子点、黑磷/氧化锰复合材料等。
5 结语
如何实现癌症的早期精准诊断及高效的个性化治疗,是当前医学和生命分析化学研究者所面临的重要课题。传统的治疗方法已不能满足肿瘤精准治疗的需求。光动力治疗的出现为肿瘤精准治疗提供了新希望。现有研究也证实了光动力治疗无论是在体外细胞层面还是体内荷瘤小鼠模型水平,都具有良好的治疗效果和应用前景。然而,光动力治疗在肿瘤精准治疗领域仍处于起步阶段,构建生物安全性好、肿瘤主动靶向能力强、治疗效率高、毒副作用小的新型光动力治疗体系,推动PDT的进一步发展及临床转化是该领域未来研究的主要方向。
