受激辐射耗尽超分辨显微成像的研究进展及应用
2020-01-15阮贺飞吴亚运袁景和方晓红
阮贺飞, 吴亚运, 袁景和, 石 彦, 方晓红*
(1.中国科学院化学研究所,分子纳米结构与纳米技术重点实验室,北京分子科学国家研究中心,北京 100190;2.清华大学医学院,生命科学联合中心,北京 100084)
1 前言
1994年,德国科学家Hell等首次提出受激辐射耗尽显微术概念,并在理论上验证了其突破光学衍射极限的可行性[1]。2000年,他们在实验中突破衍射极限并将横向分辨率提高了2倍左右,纵向分辨率提高了6倍左右[2]。随后多种远场光学超分辨技术相继出现并得到快速发展,横向分辨率可以达到几十纳米[3 - 4]。光学超分辨成像技术主要分为两类:一类是基于照明光路空间调制的受激辐射耗尽(Stimulated Emission Depletion,STED)显微术[2]、结构光照明显微术(Structured Illumination Microscopy,SIM)[5]等;另一类是基于单分子高精度定位的光活化定位显微术(Photo-Activated Localization Microscopy,PALM)[6]、随机光学重构显微术(Stochastic Optical Reconstruction Microscopy,STORM)[7]等。与PALM和STORM技术相比,基于共聚焦显微镜点扫描成像模式的STED显微镜具有更快的时间分辨,以及更加精细的三维解析能力,因此成为生化研究中重要的超分辨成像工具。凭借对STED超分辨显微镜发展所做出的突出贡献,Hell获得2014年度诺贝尔化学奖。
本文结合我们课题组近年来在STED显微成像研究方面的工作,首先从STED成像的基本原理、荧光探针的选择、多色及三维成像以及STED与其他技术的联用等方面,综述了STED显微成像技术的研究进展,然后介绍了STED显微镜在不同亚细胞结构成像中的应用,最后对STED显微成像技术的发展前景进行了展望。
2 受激辐射耗尽显微成像技术的研究进展
2.1 超分辨成像原理
1873年,Abbe提出著名的光学衍射极限理论:任何理想物点经光学系统成像后都不可能得到一个理想像点,而是得到一个弥散光斑即艾里斑,这样两个弥散光斑靠近后就无法分辨,进而限制了系统的分辨率,用公式表述横向分辨率为[8 - 9]:
(1)
STED显微镜其基本原理是采用两束激光同时照射样品[10],其中一束激光用来激发荧光分子,使艾里斑范围内的荧光分子处于激发态;同时,用另外一束中心光强为零的环形损耗激光(STED光)与之叠加,使艾里斑边沿区域处于激发态的荧光分子,通过受激辐射损耗过程返回基态而不自发辐射荧光,因此只有中心STED光为零的区域中的荧光分子可自发辐射荧光,从而获得衍射极限范围内的荧光发光点。从理论上来讲,由于STED损耗光为环状光束,其强度符合高斯分布且环状中心强度为零,因而环状损耗光强度越强,则激发光激发的荧光分子自发辐射荧光的区域就越小,其横向分辨率就越高,用公式表示为[1,3]:
(2)
其中,Δr为两个物点的最小分辨距离,λ为激发光波长,n为介质折射率,θ为物镜孔径角的一半,Idep为损耗激光强度,Isat为荧光分子饱和激发强度。
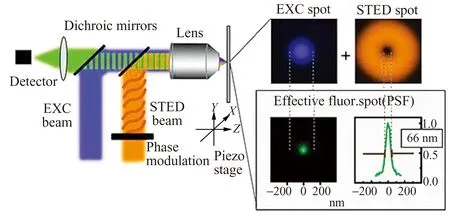
图1 STED超分辨荧光显微镜成像原理示意图[11]Fig.1 Schematic diagram of STED super-resolution fluorescence imaging[11]
当Idep/Isat比值很大时,横向分辨率Δr就无限小,因此STED显微术没有理论分辨率极限。图1为STED超分辨率荧光显微镜成像原理示意图。
2.2 荧光探针
荧光成像过程中,细胞或者组织等生物样品需要用具有荧光发色团的荧光探针进行标记。理论上所有的荧光发色团均能发生受激辐射过程,应该都可以用于STED超分辨成像。然而,实际成像过程中为了实现超分辨成像,使用的受激辐射光强度非常高(一般为共聚焦激发光的100倍),往往会导致荧光发色团的快速漂白。另外,活细胞生物成像要求荧光探针具有良好的生物相容性、细胞穿透性和特异性标记能力。目前报道的荧光探针主要包括三类:荧光蛋白、有机染料和荧光纳米颗粒。
荧光蛋白由于其优越的基因编辑和特异性标记效果以及多种颜色可选的特性,已成为生物大分子和细胞结构原位荧光成像的主要标记策略[12 - 13]。2006年,Hell等报道了使用绿色荧光蛋白(GFP)进行STED成像,达到了70 nm的分辨率,实现了病毒和内质网的超分辨成像[14]。Tønnesen等使用GFP和黄色荧光蛋白(YFP)标记观察活体脑切片中前突触和后突触的结构[15]。然而,目前可用于STED成像的荧光蛋白只有GFP和YFP。红色荧光蛋白的稳定性和亮度相较于其他荧光蛋白更差,无法用于STED成像。荧光蛋白的稳定性和亮度难以与有机染料和荧光纳米颗粒相比,目前依旧难以满足STED成像的要求。
有机染料作为小分子荧光探针目前被广泛应用于生物成像领域。由于STED成像需要高强度受激辐射光猝灭周围荧光信号,必须选择具有优越抗光漂白性质、亮度高的有机小分子荧光探针进行标记。有机染料分子相比于荧光蛋白普遍具有更小的尺寸、更好的荧光稳定性和亮度,因而标记密度更高,成像效果更好。目前STED生物成像采用的荧光探针主要是结构优化过的有机染料分子,具有良好的抗漂白性质和生物相容性,已经有多种商品化产品可供选择(Atto系列、Abberior系列染料)。如特殊结构优化的染料PB430能够进行250 s的持续STED成像并保留70%的荧光强度[19],SiR染料能进行长达1 500 s的STED成像并保留67%的荧光信号[20]。多种组合的染料对已经被用于双色STED生物成像和活细胞成像中,为研究细胞器和生物分子在活细胞内的相互作用提供了重要工具。Bottanelli等采用Atto590和SiR两种染料结合SNAP和Halo-tag的标记方法,实现了长达3 min的活细胞双色STED示踪细胞器相互作用[21]。此外,具有点亮荧光性质(Fluorogenic)的染料[22]和大斯托克斯位移的染料[23]也被用于STED成像,能够有效消除背景信号干扰和简化显微镜光路系统。
近年来,荧光纳米颗粒因其优越的光学性质,包括高亮度、抗漂白性和光开关性等,被广泛应用于超分辨成像和单分子示踪领域,量子点(QDs)[24]、上转换纳米颗粒(UC NPs)[25]、荧光纳米钻石(FNDs)[26 - 27]、碳点(CDs)[28]、聚集诱导发光纳米颗粒(AIE NPs)[29]、染料复合等离子体纳米颗粒[30]等新型荧光纳米探针正在被逐渐应用于STED成像领域。相比于荧光蛋白和有机染料,荧光纳米颗粒具有更高的亮度和抗漂白性质,能够进行长达数十分钟到数小时的持续STED成像。不过荧光纳米颗粒的一些缺点也无法忽视,例如较大的尺寸和活细胞标记困难。另外,QDs和AIE NPs具有双光子效应,发光点周围会产生一圈由损耗光激发出的虚影从而降低了信噪比[24,31]。UC NPs和染料复合等离子体纳米颗粒只需要较低的受激辐射光强度就能实现超分辨成像,但UC NPs由于较低的量子产率和较长的荧光寿命限制了成像速度,染料复合等离子体纳米颗粒则会因为等离子体颗粒的热效应导致染料和颗粒的分解。
我们课题组曾报道了具有优异抗光漂白性能的荧光导电聚合物点(PDs)作为纳米探针,并用于长时间的STED生物成像[32]。将具有优良光学性质的红色荧光半导体聚合物(668 nm)包裹于两亲性聚合物中,得到粒径为40 nm的PDs,并进一步偶联生物素,实现肿瘤细胞内吞囊泡的标记,得到了70 nm的分辨率和长达2 h的持续STED成像(图2),并能够实时动态观察内吞囊泡的融合和分离过程。该PDs与商品化STED染料(Atto 565)和包裹染料的聚苯乙烯微球相比,具有更好的亮度和荧光稳定性,成像2 h无明显荧光衰减,是目前STED成像荧光稳定性最高的荧光探针。我们的研究也发现,不同分子结构的PDs的荧光稳定性有明显差异。因此,PDs可以作为一类有潜力的新型受激辐射损耗超分辨成像荧光探针,进一步设计开发新结构的荧光聚合物,有望满足广泛应用STED成像的要求。
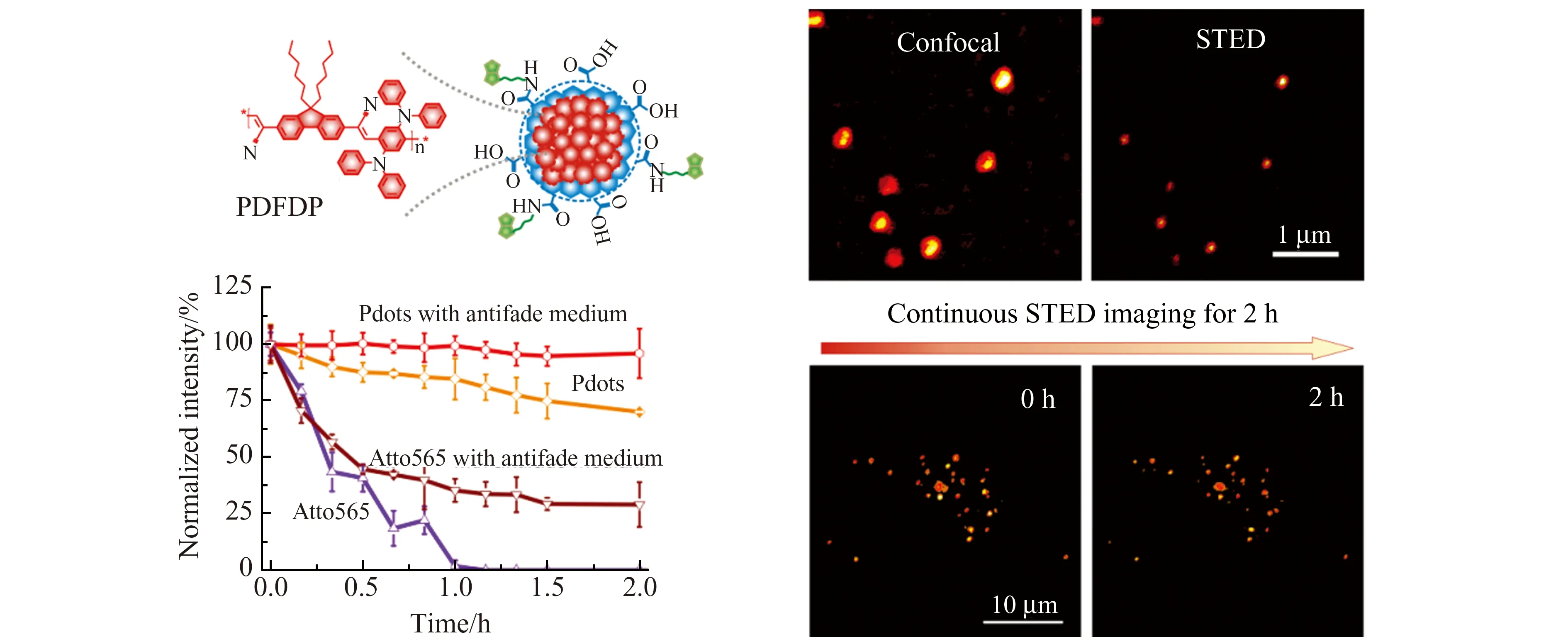
图2 荧光聚合物点(Pdots)用于长时间STED生物成像[32]Fig.2 Fluorescent polymer dots for long-term STED bioimaging[32]
2.3 多色及三维成像
为了精细解析细胞内不同组分的空间分布和相互作用,发展STED多色成像和三维成像成为新的趋势。例如,Neumann等利用双色STED显微镜观察到三种线粒体孔蛋白(hVDAC)亚型在线粒体上的不同分布,并发现hVDAC3与I型己糖激酶的共定位比例要高于hVDAC2和hVDAC1[33]。Pellett等利用改进的SNAP和CLIP标签技术,实现表皮生长因子和受体相互作用的双色STED成像表征[34]。Li等人利用双色STED显微镜观察到单纯性疱疹病毒(HSV-1)基因组的复制过程[35]。北京大学席鹏等使用连续激光器实现双色CW-STED,获得了71 nm的空间分辨率,并对人类呼吸道合胞病毒(hRSV)蛋白的共定位情况进行了分析[36]。
STED多色成像面临的一个重要问题是如何解决通道间的交叉干扰(串色)和简化成像光路。从成像装置及光路设计上来说,目前研究人员主要通过以下两种方式来实现多色STED成像:(1)选择激发光谱和发射光谱可以截然分离的多种荧光分子进行标记,装置上使用相应的多束激发光和多束STED损耗光来实现多色STED超分辨成像[37];(2)选择激发光谱不同,发射光谱相近的多种荧光分子进行标记,装置上使用多束激发光且共用一束STED损耗光的成像模式[38 - 39]。然而,无论使用哪种方法,仅仅使用滤波片对不同通道的荧光信号进行分离是无法彻底消除串色问题的。虽然基于图像的后期处理也能实现多色成像[15,40 - 41],但是难以实现不同通道信号的彻底分离,并且容易产生假象。目前研究人员使用基于点扫描模式的时间门分离法来彻底消除串色问题,但是该方法需要较高的激光脉冲频率,并且对脉冲时序的调控要求极为严格且装置复杂,不仅需要严格控制单一通道内的荧光激发、损耗和探测顺序,还需要控制多通道之间的门控顺序,因此实现起来比较困难。我们课题组提出通过不同通道间线切换扫描的方式实现门控多色STED成像,该方法在彻底消除串色问题的同时,还解决了点扫描时间门分离模式下装置复杂、难以控制的问题。
基于共聚焦成像模式的STED显微镜本身具有三维层析能力,为细胞内的三维成像提供便利,但是如何提高轴向分辨率具有一定的挑战性。提高轴向分辨率比较经典的方法是4Pi技术[43],需将两个反向的物镜聚焦在同一焦平面上,并通过将所有的光束相干叠加来实现轴向分辨率的显著提高,但此方法比较复杂,实现起来有一定难度。另一种方法是Hell等设计并使用了一块0/π位相板对损耗光进行位相调控,经过物镜汇聚后得到一束轴向中空的光斑,进而在单物镜成像系统中实现轴向分辨率的显著提高。受全内反射荧光显微镜(TIRFM)成像原理启发,北京大学席鹏等使用镜面代替显微镜载玻片成功的将STED显微镜轴向分辨提高了6倍[45]。
2.4 受激辐射耗尽显微成像与其他技术联用
将超分辨荧光显微术与纳米表征和操纵等技术联用,可实现纳米尺度上生物样品的同时多模态成像和纳米操纵,具有重要的发展前景。
原子力显微镜(AFM)的生物成像分辨率与STED成像接近,但是其探针不具有生物分子特异性识别功能。将AFM技术和STED显微技术联用,可实现纳米尺度下的光学信号和力学信号同时成像,同时STED显微镜可为纳米尺度的AFM微操纵提供更精确的引导。我们课题组基于三态弛豫(T-Rex)概念成功研制了超连续脉冲激光激发的SC-STED显微镜,获得了好于40 nm的成像分辨率。在此基础上实现了与AFM的联用,并开发了同时成像和引导成像两种联用成像模式,在国际上首次实现了荧光和力学信号的同时同步获取。利用STED成像精确引导AFM成像,能够结合两种成像的优点,既可以快速找到感兴趣的区域,又能准确获取光学信息、形貌特征和力学参数。如图3所示,我们利用同时成像模式实现了细胞伪足表面形态和原位肌动蛋白微丝的超分辨荧光表征[46]。
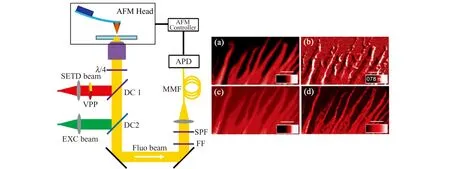
图3 STED显微镜与AFM联用的原理示意图[46]。左边为联用光路示意图,右边为细胞伪足的原位光学信息和形态特征。(a)共聚焦图像;(b)AFM图像;(c)STED图像;(d)STED去卷积图像Fig.3 Schematic diagram of the integrated STED microscope and AFM[46].The left figure shows the optical path of integrated system,and the right figure shows in situ optical imaging and morphological characteristics of the cellular pseudopod.(a) Confocal image;(b) AFM image;(c) STED image;(d) STED deconvolution image
与共聚焦模式下的荧光相关光谱(Fluorescence Correlation Spectroscopy,FCS)技术相比,基于STED显微镜的FCS技术可将有效探测体积减小到Confocal-FCS的十分之一,进而可用于探测浓度更高的生物样品。因此,STED -FCS技术更有利于研究细胞膜上高密度的蛋白受体寡聚化、脂筏和脂质分子的动力学信息。如细胞膜上的微结构域脂筏,由于具有较小的尺寸(直径5~200 nm)和高度的动态特性,普通荧光显微镜无法对其进行直接表征和研究,其存在与否一直都具有争议性。Hell等使用STED -FCS联用技术,直接观察到鞘磷脂和糖基磷脂酰肌醇锚定蛋白(GPI-anchored proteins)能够被胆固醇富集的微结构域(~20 nm)短暂的(10~20 ms)捕获,而其他的一些磷脂不具有这种行为,直接证明了细胞膜上微结构域的存在[47]。
光镊技术(Optical Tweezer)广泛用于生物样品的微操纵,STED显微技术与光镊微操纵技术的联用将进一步帮助我们在纳米尺度上精确解析生物样品结构。例如,我们知道DNA双螺旋结构表面上紧密的分布着多种多样的功能蛋白,它们在DNA的复制和修复过程中具有重要作用。为精确解析和追踪单一蛋白在双螺旋结构上的分布,Wuite等实现了STED技术和光镊技术的联用,首先利用光镊技术控制DNA双螺旋结构的构象和张力,同时利用高时间分辨(<50 ms)和空间分辨(50 nm)的STED显微镜来解析和追踪蛋白的位置变化[48]。
3 受激辐射耗尽显微镜在细胞成像中的应用
3.1 细胞膜蛋白和微结构域
细胞膜既是细胞生存的屏障,又是细胞与外界发生信息、物质和能量交换的直接介质。其中,生理状态下细胞膜受体的聚集状态往往与其信号识别和转导密切相关,同时细胞膜上的微结构域又能直接影响膜受体的激活和聚集,因此利用STED超分辨显微镜在纳米尺度上研究细胞膜受体聚集程度及微结构域的变化有助于进一步了解细胞信号转导的分子机制。
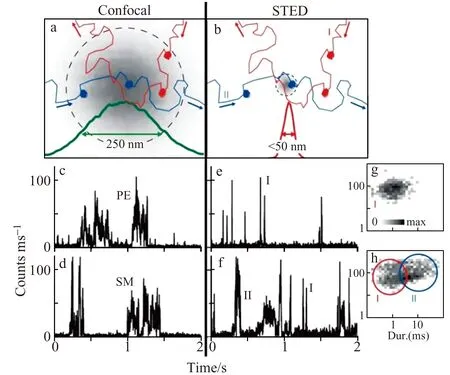
图4 活细胞细胞膜上脂质分子的Confocal-FCS和STED -FCS分析[47]Fig.4 Confocal-FCS and STED-FCS analysis of lipids on living cell membrane[47]
在细胞膜受体聚集研究方面,Garcia-Parajo等利用STED超分辨荧光成像研究发现,在内源或者外源性脂类抗原刺激下,抗原呈递分子CD1d在抗原呈递细胞THP-1表面形成平均尺寸为78 nm的纳米团簇,从而调控免疫细胞iNKT的激活。进一步的成像结果显示,当破坏细胞骨架或者切除CD1d分子的胞内端时,CD1d分子能够形成更大尺寸的纳米团簇,进而增强免疫细胞iNKT的激活效应[52]。Hell等也利用STED超分辨成像发现CHO细胞表面的乙酰胆碱受体(AChR)以平均直径55 nm左右的纳米团簇存在,并且纳米团簇的尺寸和分布同样受到细胞骨架和胆固醇去除的影响[53 - 54]。图4为活细胞细胞膜上脂质分子的Confocal-FCS和STED -FCS分析。
STED -FCS联用技术为在活细胞上研究细胞膜脂肪分子、微结构域的动态行为及相互作用提供有利条件。例如,Hell等利用STED -FCS联用技术在活细胞细胞膜上观察到鞘磷脂的受限扩散,直接证明细胞膜微结构域的存在[47]。Eggeling等利用STED -FCS技术研究活细胞细胞膜上直径30 min区域内的多种脂质分子的动态行为及相互作用,发现磷酸甘油酯之间形成弱的相互作用,而鞘磷脂之间能够形成强的相互作用,直接证明鞘磷脂是细胞膜微结构域成分之一[55]。
3.2 细胞器和细胞结构
细胞质中的细胞骨架、细胞核和多种细胞器组成了细胞的基本结构,维持细胞的正常工作和运转。基于共聚焦成像模式的STED显微镜能够实现细胞各个层面的超分辨成像,为在纳米尺度上研究各细胞器中蛋白质的分布和功能提供帮助,弥补了普通荧光显微镜在分辨率上的局限。
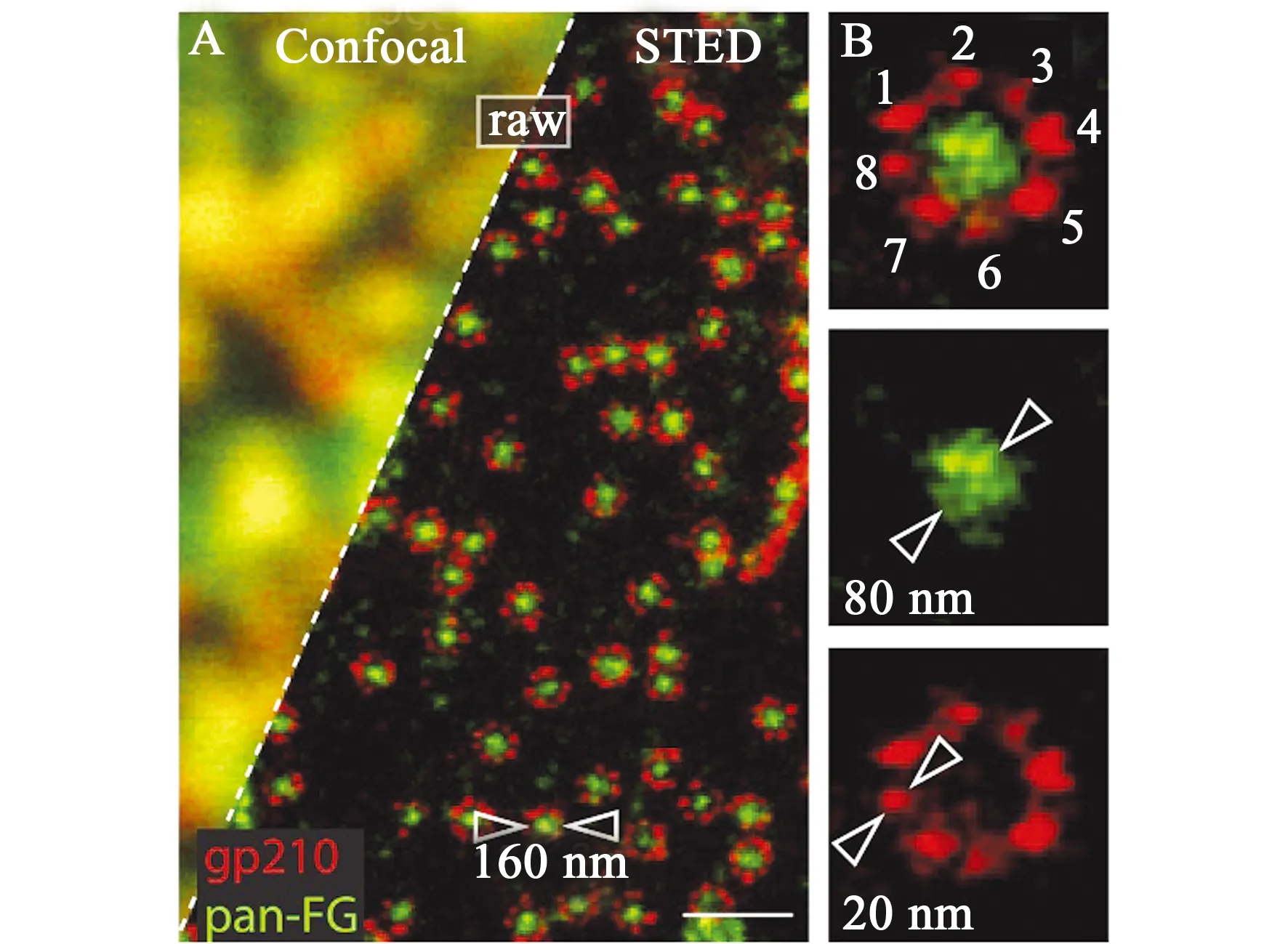
图5 核孔复合体中蛋白分布的confocal和STED成像图[39]Fig.5 Confocal and STED imaging of protein distribution in nuclear pore complexes[39]
线粒体内膜上覆盖着很多寡聚化的蛋白复合物,它们对维持线粒体的结构和功能至关重要,并与一些人类疾病相关,但是它们在内膜上的分布情况并不明确。Stefan Jakobs等利用STED超分辨显微镜发现哺乳动物细胞中三种已知蛋白mitofilin、MINOS1、和CHCHD3在线粒体内膜组织系统中形成相似的、有规则的团簇结构,并且发现位于细胞核附近的线粒体内膜系统要比边缘处的丰富[56]。
在细胞核结构的研究中(图5),Hell等利用分辨率好于20 nm的双色STED显微镜观察到核孔复合体中gp210蛋白的八倍体对称分布,并对核孔的大小和蛋白复合物的尺寸进行了表征[39]。Stave Kohtz等则利用STED显微镜观察到核孔蛋白NUP62和NUP64在核孔复合体中的微观不均一性分布[57]。
3.3 转运囊泡
转运囊泡在不同细胞器和细胞结构之间扮演重要的物质运输作用,但因其尺寸较小,传统荧光显微镜往往对其无能为力。例如,直径为1 μm左右的突触前神经末梢内富含大量直径约为40 nm左右的突触囊泡,它们的运动及转运行为就无法用传统的荧光显微镜来表征。Hell等利用每秒可以拍摄28帧图像的STED超分辨显微镜追踪到突触囊泡的转运行为,并发现这种囊泡在没有神经节的区域运动速度会更快[58]。我们课题组利用自主搭建分辨率可达40 nm的STED显微镜实现了后高尔基体囊泡的超分辨成像。如图6所示,观察到转化生长因子Ⅱ型受体(TβRⅡ)后高尔基体囊泡的环状轮廓结构,并发现TβRⅡ在到达细胞膜之前,在后高尔基体囊泡膜上以聚集体的形式存在,这样有利于其上膜后的信号转导效率[59]。我们还通过发展适用于STED超分辨成像的新型导电聚合物点,发现活细胞中内吞囊泡结合和解离的动态变化[32]。
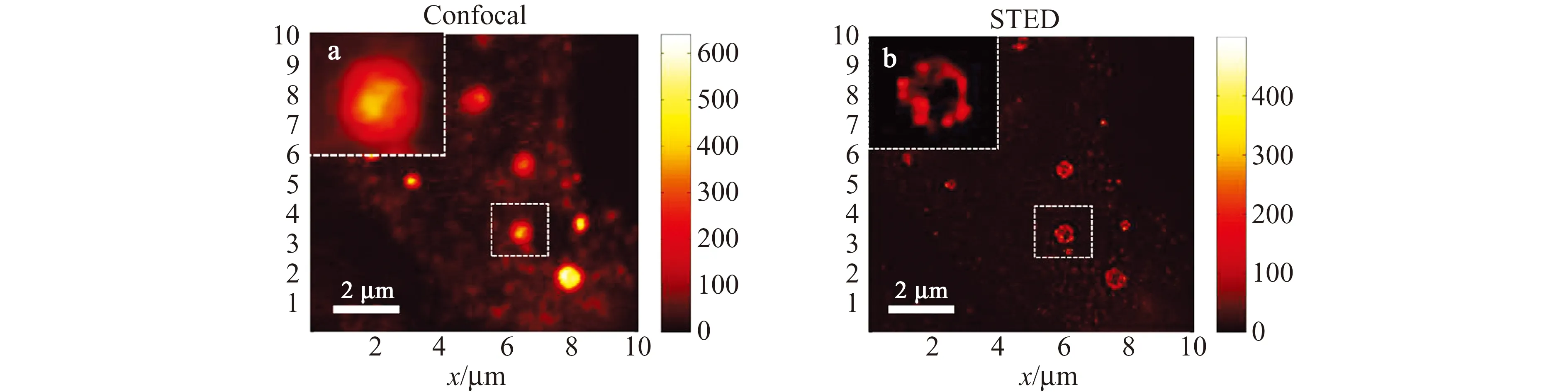
图6 Tβ RⅡ在后高尔基体囊泡上分布的Confocal和STED成像图[59]Fig.6 Confocal and STED imaging of Tβ RII distribution on the post-Golgi vesicles[59]
3.4 神经元结构
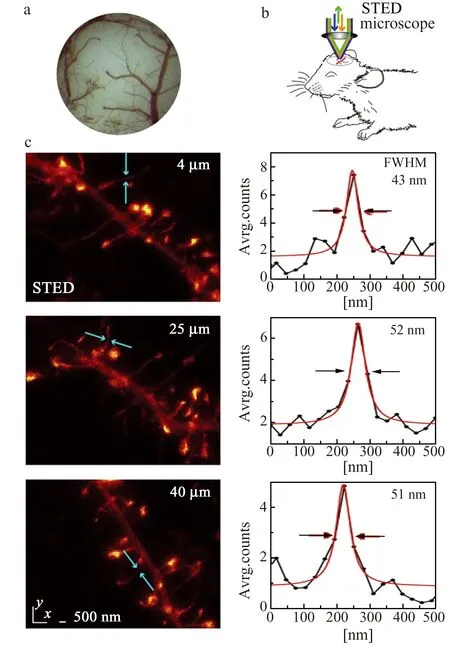
图7 活体小鼠视觉皮层树突中肌动蛋白微丝的超分辨成像[66]Fig.7 Super-resolution imaging of actin filaments in visual cortex dendrites of living mice[66]
神经元是神经系统最基本的结构和功能单位,可以通过树突和轴突来接受和传递信号。在神经生物学研究中,人们发现树突棘的形态结构与其功能密切相关,因此研究其结构变化有助于解释相关疾病的发生机制。然而树突棘尺寸位于衍射极限范围内(40~500 nm)[60],再加上高密度分布的树突结构,使得对它们结构细节的研究非常困难。
超分辨荧光显微技术从早期发明开始就被广泛应用于神经科学研究中。例如,Nägerl等利用自主搭建分辨率达70~80 nm的STED显微镜,在海马切片中获得了树突棘结构的三维重构超分辨图像[61],并在另一篇报道中详细解析了海马神经元中树突棘颈的宽度和树突棘头的曲率[62],他们还在脑切片中实现了深度达120 μm的突触肌动蛋白微丝的动态超分辨成像[63]。进一步利用STED超分辨成像发现,在小鼠的正常生长发育中,随着年龄的增长,树突棘的头会变小,颈部会变小和变宽,但是与普遍认知所不同的是,他们发现患脆性X染色体综合症小鼠的树突棘的头和颈并不会受到损伤,而是同样随着年龄的增长而变小变宽[64]。Brismar等利用双色STED超分辨显微镜发现磷蛋白DARPP-32和D1R在树突棘结构中呈离散分布,但是在树突棘的头和颈部呈聚集状态分布[65]。
另外,与其他超分辨技术相比,STED显微镜独特的三维层析能力使得其具有更深的成像深度,为其在活体成像应用中提供优势。如图7所示,Hell等利用STED显微镜在活体小鼠大脑视觉皮层中,实现了深度达40 μm的树突棘中肌动蛋白微丝的超分辨表征,并在43~70 nm的分辨率下揭示了树突棘形态的动态变化[66]。
4 总结与展望
凭借其超高分辨率,STED显微成像在生命科学相关领域已发挥了重要的作用,证实了对一些亚细胞尺度细胞结构的猜想,发现普通荧光显微镜无法观察到的新现象[67]。但是,STED显微术的应用仍面临诸多挑战,包括成像装置复杂、荧光探针抗漂白能力差难以实现长时间追踪、STED损耗光可能具有光毒性、高时间分辨和空间分辨难以同时获得等,这些问题的解决都将促进STED显微术的进一步发展。例如设计合成结构更加稳定的荧光染料、具有更小尺寸和更高亮度的纳米颗粒荧光探针、发展适用于活细胞的特异性标记策略将为STED成像领域的应用带来新的契机;开发灵敏度更高、探测速度更快的探测器,将有效地提高活细胞和活体的成像质量和速度;简化STED光路系统、发展小型STED显微镜等将会降低装置的复杂性和成本,有利于STED显微镜的更广泛使用;促进STED显微镜与其他成像表征技术的联用,将帮助我们同时获取更多的样品信息等。随着STED超分辨显微术的发展和应用,它将成为研究生命过程中分子机制的重要分析技术。
