叶片衰老诱导FLP重组酶删除转基因烟草外源基因的研究
2020-01-15秦利军李启龙赵德刚
秦利军,李启龙,赵德刚,2
1 贵州大学农业生物工程研究院/山地植物资源保护与种质创新省部共建教育部重点实验室,贵州贵阳甲秀南路 550025;
2 贵州省农业科学院,贵州贵阳金欣社区1号 550006
自1983年首次获得转基因烟草后,转基因技术已广泛应用到多种农作物中[1],但转基因作物可能存在的环境及食品安全问题也备受关注[2]。标记基因剔除是利用特异位点重组实现转基因植物中选择标记基因的清除,从而获得无选择标记基因的植物(Marker-free transgenic plants,MFTPs)[3]。目前,在众多标记基因清除技术中以位点特异性重组系统(Site-specific recombination)应用最为广泛[4]。最常用的两种位点特异性重组系统包括噬菌体(Phage)Pl的Cre/LoxP系统和啤酒酵母(Saccharomyces cerevisiae)的FLP/FRT系统[3,5-7]。Dale等[8]首次利用Cre/LoxP系统转化烟草,成功实现了Cre重组酶对荧光素酶基因(Luc)、选择标记基因(Hpt)的有效清除,清除率高达90%。之后该技术又成功应用到烟草(Nicotiana tabacum)[9]、拟南芥(Arabidopsis thaliana)[10]、玉米(Zea mays)[11]、水稻(Oryza sativa)[12]、大豆(Glycine max)[13]、马铃薯(Solanum tuberosum)[14]、番茄(Lycopersicum esculentum)[15]等多种作物中。FLP/FRT系统也同样能删除报告基因Gus和筛选基因NptⅡ,创立安全的转基因水稻和玉米新品系[16,17]。但这两种系统在应用上也存在一定的弊端,如可能引起基因重排和导致物种出现特异性缺陷等[18,19],使其应用受到一定限制。2007年,Li实验室最先将噬菌体P1的Cre/LoxP系统和酵母(S.cerevisiae)的FLP/FRT系统融合成新的重组酶识别位点LF(LoxP-FRT),开创了“外源基因清除(Gene-Deletor)”技术。特异性启动子驱动重组酶Cre或者FLP在适当的时间和空间表达后,重组酶即可识别两个融合识别位点LF之间的序列(也包括重组酶自身基因序列),进而将这些序列在特定的时间和特定的部位从植物器官的细胞基因组中全部清除(图1)。
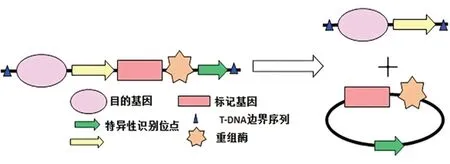
图1 重组酶介导的标记基因删除系统[20]Fig.1 Selectable gene-deletor system induced by site-specific recombinase
有研究者将该技术与特异性启动子(如,花粉或种子特异表达启动子)相结合,成功了实现了转基因植物花粉或种子中外源基因的100%清除,为该系统的广泛应用奠定基础[21,22]。已有文献报道,拟南芥(A.thaliana)SAG12基因可编码半胱氨酸蛋白酶(cysteine protease),该基因表达不仅严格受发育调控的衰老途径所特异性调节,而且仅在衰老组织中表达。启动子缺失和片段重组的研究表明,SAG12启动子的一个高度保守区域负责衰老特异性调控。从不同叶龄(年轻和衰老)的拟南芥叶片中分离到可与SAG12启动子元件结合的差异结合因子[23]。Calderini[24]利用SAG12启动子特异性地控制的IPT基因表达,从而延缓了紫花苜蓿(Medicago sativa)叶片的衰老。本研究以含有衰老特异表达基因SAG12启动子驱动“LoxP/FRT”系统表达的转基因烟草为材料,通过分析转基因株系不同叶龄叶片、花药及花粉中GUS的表达活性,研究转基因烟草叶龄与GUS蛋白活性及除草剂草铵膦的抗性关系,探讨“LoxP/FRT”系统在叶片中引起的外源基因清除效率;另外,通过转基因烟草植株花粉中GUS染色数目的统计分析,计算外源基因清除系统在不同转基因烟草株系花粉中的清除效率,为利用“LoxP/FRT”系统快速培育不含外源基因的转基因烟草新种质提供一定参考。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 试验材料
供试材料:野生型栽培烟草K326(N.tabacumL.cv.K326)、转基因烟草株系Q1、Q2和Q3株系含有以拟南芥(A.thaliana)衰老基因SAG12启动子PSAG12驱动重组酶FLP识别重组位点“别重组位点FRT”表达的清除系统和含有普通烟草(N.tabacum)泛素蛋白基因Ubi启动子PUbi启动的草甘膦筛选和GUS报告的融合基因Gus::Bar,其植物表达载体pGM626-SAF-Ucn(见图2A),Q1和Q3株系均含1个外源基因拷贝,Q2株系含2个外源基因拷贝;转基因株系Q0中所转的表达元件除不含FLP基因,其它与Q1、Q2和Q3株系相同,其植物表达载体pGM626-SA-Ucn(见图2B)。
将野生型K326、Q0、Q1、Q2和Q3株系的种子撒播于烟草育苗盘上进行漂浮培养。待烟苗长至3~5叶期时,各取25株生长良好、长势一致的转基因及野生型烟草,分别移栽至含培养基质(菜园土∶Hawita泥炭土=3∶1)的花盆(高16 cm,直径20 cm,培养基质10 kg)中继续生长,每盆种1株苗。每盆施1~2 g复合肥(N ∶ P2O5∶ K2O=10∶ 10∶12),期间追肥1次。种植条件:相对湿度70~80%,16 h光照 /8 h 黑暗,25~28 ℃。
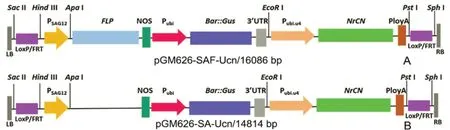
图2 植物表达载体pGM626-SAF-UCn和pGM626-SA-Ucn图谱Fig.2 Construction of plants expression vectors pGM626-SAF-UCn and pGM626-SA-Ucn
1.1.2 试剂
草铵膦(Phosphinothricin,PPT)购自美国Sigma公司;Plant DNA Kit购自天根(北京)生物科技有限公司;Plant RNA Kit购自美国 OMEGA Bio-Tek 有限公司;DL 2000 DNA Marker购自日本 Takara(大连)生物公司;MultiScribeTMReverse Transcriptase Kit、Power SYBR®Green PCR Master Mix购自于美国Applied Biosystems公司;可溶性糖测定试剂盒购自南京建成生物工程研究所;引物由上海旭冠生物科技有限公司合成。
1.2 方法
1.2.1 转基因烟株的PCR鉴定
根据Plant DNA Kit试剂盒操作说明书提取萌发至3~5叶期烟株的总基因组DNA。以基因组DNA为模板,用引物FUbi.U4(5'-AGGAGCCTCTTTGTTCCC-3')和RUbi.CN(5'-TCATTCAAACAC -CACCTCG-3')对特异性片段U4-CN(含550 bp烟草PUbi.U4序列和257 bp CN基因序列)进行扩增。PCR扩增条件:94℃ 3 min;94℃ 20 s,58℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min。
1.2.2 转基因烟草不同组织GUS活性分析
以移栽 25 d、30 d、45 d、60 d 转基因烟草叶片和现蕾期花药为材料,分析GUS蛋白在两者中的表达活性。分别对移栽 25 d、30 d、45 d、60 d 时的相同叶位转基因烟草小叶块(约1 cm2左右)进行GUS活性分析,每个株系选3个单株取样进行叶块染色实验另剪取现蕾期转基因烟株的花药(每个株系各取8个花药)和收集盛花期转基因烟株的花粉(每个株系单株套袋收集花粉),分别置于含有GUS染液的0.5 mL离心管中进行GUS染色。将浸没于GUS染色液的烟草叶块、花药及花粉分别置于真空浓缩仪(ZLS-1)中,以25 Kpa压力抽真空15 min后放入37℃恒温培养箱中孵育过夜。次日依次以95%乙醇、75%乙醇、50%乙醇和20%乙醇逐级梯度浸提叶片色素,以便观察GUS染色结果。GUS染色液配置:100 mmol/L Tris-HCl,0.5 mmol/L NaCl,0.02 mmol/L K3Fe(CN)6,50 mmol/L CH3OH,8.65 μmmol/L X-Gluc(5-溴 -4-氯 -3-吲哚 -β-D-葡萄糖苷酸)。以野生型植株叶块、花药及花粉为对照。
1.2.3 转基因烟草对草铵膦敏感性分析
转基因烟草含有Bar::GUS融合筛选报告基因,其中Bar基因对除草剂草铵膦具有抗性。分别对不同转基因株系上、中和下部叶片(不同叶位叶片代表叶龄的差异)进行草铵膦(4 mg/L)涂抹处理,观察草胺膦处理 5 d、9 d、16 d后对烟株上、中和下部叶片形态变化的影响,每个株系选3株进行处理,以野生型烟草处理为对照。
1.2.4 叶片外源基因的表达量分析
根据Plant RNA Kit操作说明书提取不同移栽天数(移栽后 10 d、25 d、40 d 和 60 d)转基因株系叶片的总RNA,并反转录成cDNA。采用反转录PCR(Reverse transcription PCR,RT-PCR)和实时荧光定量PCR(Real-time PCR,PCR)技术对外源Bar::Gus和FLP基因的表达量进行分析,以Actin为内参。每个转基因株系各取5株,为5次重复,以非转基因烟草为对照,基因引物序列见表1。

表1 外源基因表达量分析的引物序列Tab.1 Primer sequences of relative expression analysis for exogenous genes
1.2.5 外源基因删除率的分析
转基因烟草植株花粉进行GUS染色后,在光学显微镜下分别记录各烟株花粉细胞的染色情况,每个株系各选5个单株进行花粉染色观察。分别统计各单株的蓝色和白色花粉数目,并以此计算外源基因在转基因烟草花粉中的删除率。计算公式:
GUS染色阳性率=染色呈蓝色花粉数/总花粉数×100%
1.2.6 数据处理
采用 Microsoft Excel 2003 及 SPSS 16.0 软件进行数据处理,Duncan法分析其差异显著性。
2 结果
2.1 转基因烟草移栽及鉴定
对萌发至苗期的T2代转基因烟草植株进行GUS染色和PCR扩增检测,共获得3个独立转基因株系及空载体对照烟草植株54株,其中Q1株系13株、Q2株系10株、Q3株系15株,Q0株系16株,种植的转基因植株中部分在生长过程中死亡,移栽存活的株系GUS染色和PCR扩增均呈阳性(图3A,3B)。农艺性状测定结果表明,各转基因烟株在旺长期、盛花期和成株期的株高、叶片数、开花期等形态指标与野生型烟株相比均无显著差异(图4)。
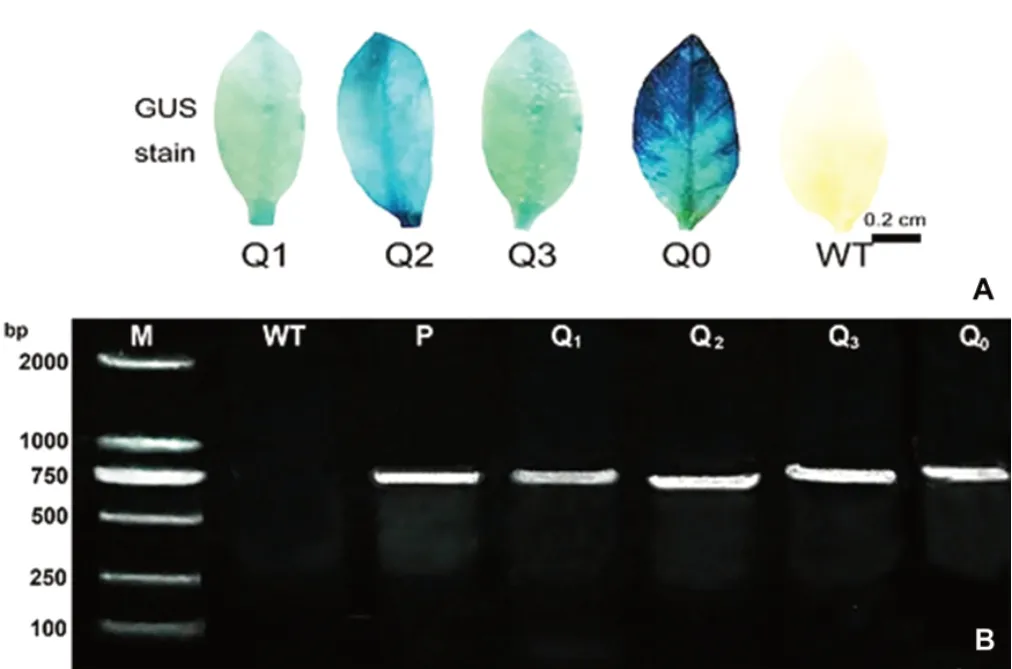
图3 转基因株系GUS染色及PCR鉴定Fig.3 GUS staining and PCR identification of transgenic lines

图4 转基因烟草与非转基因烟草形态特征比较Fig.4 Comparison of morphological characteristics between transgenic lines and wild type lines
2.2 转基因烟草GUS染色活性分析
转基因植株同一生长期叶片GUS组织化学染色表明,各独立转基因株系中GUS表达强弱有一定的差异,以Q2株系活性最强,Q3株系次之,Q1株系最弱(图5),说明不同株系表现出的GUS蛋白活性差异可能是由外源报告基因GUS的拷贝数不同所引起,之前的外源基因拷贝数分析结果表明转基因植株含有1-2个拷贝的外源基因[25]。为了进一步分析外源基因清除效率与叶片衰老间的关系,对不同移栽天数(25 d、30 d、45 d 和 60 d)转基因烟草叶块进行GUS染色,结果表明三种独立转化的烟草株系(Q1、Q2和Q3)叶片GUS活性均表现随取材的衰老而逐渐降低(图5)。当烟株移栽60 d后,Q1株系低叶位叶片中几乎检测不到GUS蛋白活性,说明叶片的衰老引起了外源GUS蛋白表达量下降。另外,转基因烟草花粉染色结果显示,不同转基因株系(Q1、Q2及Q3)花粉中也表现出了不同程度的外源基因清除(图6A)。其中以Q1株系花粉中外源基因平均清除效率最高,其次是Q3,而Q2植株中外源基因清除效率最低。不同转基因烟株其花药GUS着色表现出一定程度的差异(图6B)。

图5 不同转基因株系及不同叶龄叶片GUS组织化学染色观察Fig.5 Observation of GUS stain in different transgenic plants and at different leaf stages
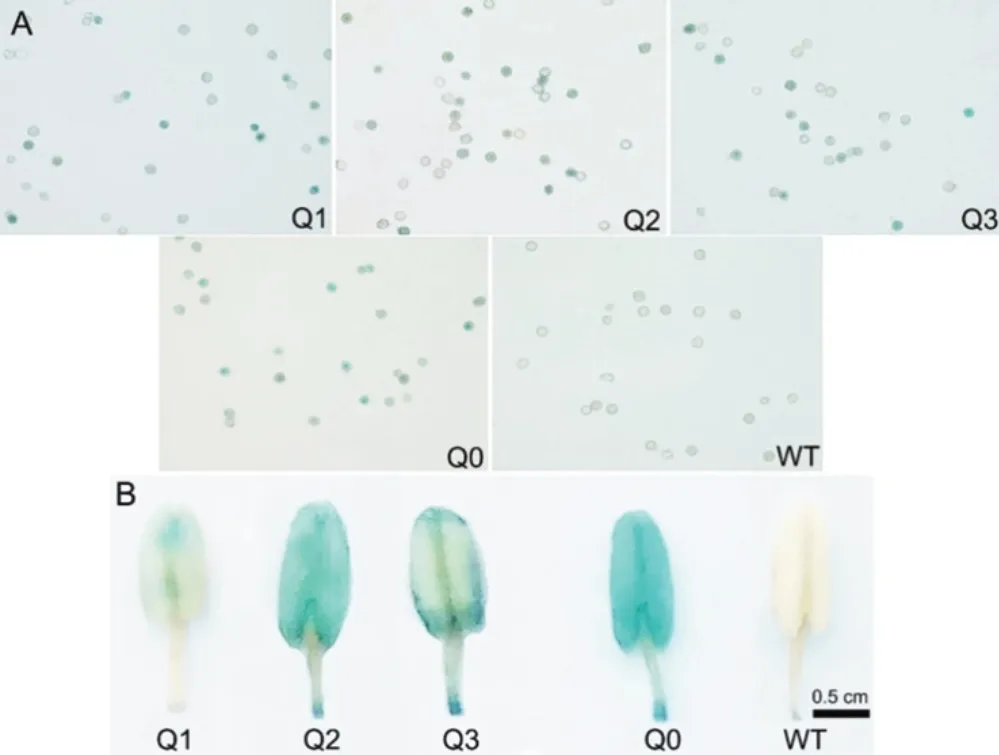
图6 不同烟草株系花药及花粉粒GUS组织化学染色Fig.6 GUS stain for anthers and pollen grains in different tobacco lines
2.3 转基因烟草除草剂抗性分析
分析不同生育期烟草叶片对除草剂PPT的敏感性,结果显示PPT处理烟草植株5 d时,转基因和非转基因烟草植株立即出现对PPT敏感的应答差异。Q2植株对草铵膦的敏感性最低,表现为草铵膦处理后叶片没有出现明显的黄化现象,而野生型对除草剂表现最为敏感,处理5 d后嫩叶出现明显变黄特征。当草铵膦处理9 d时,转基因株系Q1和Q3中部及下部叶片对PPT的敏感性逐渐增强,其中以Q3株系敏感性增幅最为显著,此时Q2株系中部叶片仍对PPT表现出较弱的敏感性(图7)。但随着植株的生长成熟,各独立转基因株系叶片均表现对草铵膦敏感,且部分转基因植株下部的叶片对草铵膦表现出的敏感性与野生型植株相当,说明随着转基因植株叶片的衰老,外源筛选基因Bar也逐渐发生了清除。
2.4 转基因烟草外源基因表达量分析
外源基因Real-time PCR分析结果表明,不同转基因烟株外源基因(重组酶FLP基因和筛选报告Bar::GUS融合基因)表达量变化表现出一定差异。随着移栽天数推移、叶片的生长发育,叶片中外源FLP基因起始表达且表达水平呈逐渐上升趋势,移栽第40 d时FLP基因的表达水平最高,分别比移栽第60 d时增加1.21倍(Q1株系)、2.52倍(Q2株系)和1.35倍(Q3株系);另外,外源筛选报告融合基因Bar::GUS表达水平总体呈现随着移栽天数的推移而下降的趋势,但以Q1和Q3株系中Bar::GUS基因量的降幅最大,移栽第60 d时这两个株系中的Bar::GUS基因几乎无表达,但Q2中仍能检测Bar::GUS基因表达(图8A),这一实验结果与之前发表的研究结果一致[25]。外源基因的RT-PCR分析结果也表明,移栽第10 d时转基因株系Q1、Q2和Q3中均有较高水平的Bar::Gus表达,Q2中Bar::Gus表达量最高,之后在移栽第40 d时转基因各株系中Bar::Gus基因表达随之下降,以Q1和Q3植株中外源基因表达量降幅最显著;而FLP基因在移栽早期(10 d)在所有转基因植株中都有表达但表达量不高,移栽后期(40 d)FLP基因在Q1和Q3株系中表达量极低,在Q2中表达量较高(图8B)。

图7 转基因烟草不同生育期叶片对除草剂草铵膦的抗性比较Fig.7 Comparison of phosphinothricin-resistance in leaves at different growth periods between transgenic and wild type tobacco plants

图8 转基因烟草叶片中外源基因表达量分析Fig.8 Expression analysis of exogenous genes in transgenic tobacco plants
2.5 转基因烟草花粉中外源基因清除效率统计
不同株系不同单株间花粉外源基因清除效率统计见表2,统计结果显示外源基因清除效率介于51.3~83.6%之间,说明叶片衰老特异启动引起的外源基因清除事件也可在配子细胞的外源基因清除中具有一定作用。

表2 转基因烟草花粉中外源基因清除效率(GUS蛋白为标记)Tab.2 Excision efficiency of exogenous gene in pollen of transgenic tobaccos
3 讨论
转基因育种在培育高产、优质、抗逆、广适的作物新品过程中具有高效、稳定、周期短、成本低等优点,是当前作物育种的一种新策略[26],但转基因作物可能存在将其外源基因以多种途径扩散到自然界并破坏生态平衡的潜在风险[2,7]。2007年,美国康涅狄格大学李义教授领导的研究小组建立了“GM-genedeletor”技术,利用该技术不仅实现当代转基因烟草中外源基因的100%删除,而且还证明这种“清除系统”能在无性生殖后代中可得到稳定的遗传[21]。本研究以含PSAG12::LoxP/FRT元件的转基因烟草为材料,分析叶片衰老特异表达基因SAG12启动子驱动外源基因清除的效率,分析结果表明不同转基因株系外源报告基因GUS表达有一定差异,以Q2植株GUS着色最深,Q3植株次之,Q1植株最弱,推测Q2植株中GUS的高表达可能与GUS基因拷贝数多有一定关系。但这三个株系GUS活性均具有随叶片的衰老而降低的特点;同样转基因烟草对PPT的抗性实验分析表明,Q2对PPT的抗性最强,Q3株系和Q1株系较弱。烟草叶片对PPT的抗性也表现为随叶片衰老,抗性由强至弱的变化趋势,与GUS染色结果一致,说明Bar::GUS基因表达与叶龄呈负相关,即叶片的衰老导致了低外源筛选报告基因的表达水平。转基因植株中Bar::GUS的Real-time PCR和RT-PCR分析结果也验证了叶龄与外源筛选报告基因表达的负相关性。同时,对外源重组酶基因FLP的基因表达分析显示,FLP表达量表现为移栽早期低、中期高、后期低的变化趋势,说明转基因植株随着发育、成熟,SAG12基因启动子驱动的FLP基因起始表达且表达水平随叶片衰老而不断增强,进而引起FLP启动包含特异位点两端间的外源基因片段删除,故移栽后期FLP和Bar::GUS基因均发生了清除,这个结果与之前的研究一致[25]。高媛媛等[27]利用热击蛋白hsp18.2基因启动子驱动热击诱导的FLP表达,获得外源基因清除的转基因烟草;之后李岩等[28]也将该热击启动删除系统应用到矮牵牛(Petunia hybrida)中,实现了转基因矮牵牛中报告基因GUS的清除。以上结果表明,“GM-gene-deletor”系统能与目标启动子结合实现外源基因的特异时空的清除。转基因烟株花粉GUS活性测定表明,Q1植株外源基因清除效率平均为78.32%、Q2为54.66%、Q3为75.24%,说明叶片衰老特异基因SAG12启动子也能在烟草花粉中表达,实现花粉细胞中外源基因的删除,表明该系统不仅能有效启动衰老叶片中外源基因的清除,同时也会引起成熟花粉中外源基因的清除,且外源基因清除效率介于51.3—83.6%之间。尽管Noh等[23]报道认为,SAG12的表达严格受发育调控的衰老途径所特异性激活,而不受应激或激素控制的途径所调节,但SAG12启动子的完全活性至少需要2个结构域协同发挥作用。Grbić等[29]在研究拟南芥(A.thalianaL.)植物的SAG2和SAG12基因表达模式时也发现SAG12基因同样也会在衰老花粉中特异性表达。综上所述,利用“GM-gene-deletor”系统结合不仅可以实现外源基因的清除,同时可以通过将“GM-gene-deletor”系统中启动子序列进行替换实现外源基因特异性的删除(如开花启动删除、乙醇诱导删除等),进而保障和提高转基因植物的安全性,为培育不含选择标记的转基因烟草新种质提供理论基础。
4 结论
转基因烟株叶片衰老可诱导外源重组酶基因FLP表达,其表达产物FLP重组酶特特异性识别LoxP/FRT融合位点,进一步引起包括筛选报告融合基因GUS::Bar及外源重组酶基因FLP在内的所有外源基因的清除。该启动子还能诱导烟株配子细胞中外源基因的删除。
本研究可为利用该系统实现转基因植株中外源基因的特定时空清除、培育不含选择标的转基因烟草新种质提供支持。
