两种异臭化合物β-环柠檬醛和β-紫罗兰酮在氯化过程中消毒副产物的生成及其影响因素
2020-01-14郑旭辉高乃云
郑旭辉,安 娜,高乃云,吴 敏,徐 斌
(同济大学环境科学与工程学院,污染控制与资源化研究国家重点试验室,上海 200092)
目前,工业生产发展迅猛、城市人口日益增加,日益增多的任意排放造成了饮用水水源的污染,导致许多水体处于富营养化状态。藻类的大量繁殖不仅消耗了水中的溶解氧,同时释放臭味物质,导致饮用水异臭问题的暴发。在我国,许多地区的水源甚至自来水都出现过异臭问题[1-3],尤其是2007年震惊中外的无锡市饮用水嗅味突发事件,导致上百万的无锡市民无水可饮[4]。随着人类生活水平和环境意识的普遍提高,居民对水质的要求不断提高。其中,严重影响水质感观性状和评价的异臭化合物逐渐成为近年来水质改善研究的热点[5-6]。将异臭按照特性整理成如下几类:酸味;甜味;咸味;苦味;霉臭味、土臭味;氯气味、臭氧味;青草味;硫磺味、腐败臭味;芳香味、水果味;鱼腥味;药味、酚味;化学品味等[7]。β-环柠檬醛(2,2,6-trimethyl-1-cyclohexene-1-carboxaldehyde, β-cyclocitral)属于草味物质,β-紫罗兰酮[4-(2,6,6-Trimethyl-1-cyclohexenyl)-3-buten-2-one, β-ionone]属于芳香味物质[7],两种物质的物理化学性质如表1所示[8]。β-紫罗兰酮与β-环柠檬醛主要由蓝藻中的微囊藻属产生[7,9],而在4月-12月,铜绿微囊藻是太湖流域的优势藻种,β-环柠檬醛是蓝藻中微囊藻的专属异臭物质(表1)。

表1 β-环柠檬醛和β-紫罗兰酮的基本物理化学性质[10]Tab.1 Basic Physical and Chemical Properties of β-Cyclocitral and β-Ionone[10]
氯消毒是世界上许多国家饮用水的主要消毒措施。单质氯和水相互作用形成的次氯酸在氯消毒过程中起主要作用。次氯酸(HOCl)分解形成的氢离子和次氯酸根离子可以干扰细胞的通透性,HOCl易于进入细胞内杀死微生物[11]。次氯酸具有强氧化作用,有利于杀灭水中的微生物,但也可与水中的有机/无机物反应形成消毒副产物(DBPs)。长期饮用消毒副产物超标的水,有毒有害物质可能会在人体内富集,对抵抗力差的人体健康带来害处,诸如增大患癌症的可能性以及影响身体发育和生殖系统等[12]。异臭化合物是生成消毒副产物的前体物[13],相对早期的研究主要关注藻类细胞和胞外产物氯化产生的消毒副产物,例如微囊藻和叶绿素[14],而不是将嗅味物质作为消毒副产物的单独前体物。许多嗅味化合物是萜类化合物,例如土臭素、2-MIB、β-紫罗兰酮和β-环柠檬醛等,在氯化过程中,被认为是重要的三卤甲烷(THMs)前体物[15]。而β-紫罗兰酮和β-环柠檬醛在氯化过程中不同消毒副产物的生成情况及其影响因素受关注较少。
1 材料和方法
1.1 试验材料
试验中所用药剂β-环柠檬醛、β-紫罗兰酮、DCAL(二氯乙醛,dichloroacetaldehyde)、TCAL(三氯乙醛,trichloroacetaldehyde),EPA551 A和EPA551B混合物标准溶液购买自Sigma-Aldrich (St.Louis,USA)。EPA551 A混合物标准溶液中含有TCM(三氯甲烷,trichloromethane,CHCl3)、DCBM(二氯一溴甲烷,dichlorobromomethane,CHCl2Br)、DBCM(二溴一氯甲烷,dibromochloromethane)和TBM(三溴甲烷,tribromomethane)、EPA551B混合物标准溶液中含有DCAN(二氯乙腈,dichloroacetonitrile)、TCAN(三氯乙腈,trichloroacetonitrile)、BCAN(溴氯乙腈,bromochloroacetonitrile)、DBAN(二溴乙腈,dibromoacetonitrile)、TCNM(三氯硝基甲烷,trichloronitromethane)、DCP(二氯丙酮,dichloropropanone)和TCP(三氯丙酮,trichloropropanone)。腐植酸(富里酸≥90%)、甲基叔丁基醚、抗坏血酸、次氯酸钠和用于配置缓冲溶液的磷酸盐购自阿拉丁工业公司(中国上海)。所有的溶液配制用水均为Milli-Q超纯水(18.2 MΩ·cm)。
1.2 试验方法与装置
将β-环柠檬醛和β紫罗兰酮溶于甲醇,浓度为500 mg/L,作为储备液。配制消毒用次氯酸钠储备液,自由氯质量浓度大概在5 g/L左右,保存于棕色玻璃瓶中,并置于4 ℃冰箱。进行氯消毒试验前,根据需求计算稀释比后取用,自由氯浓度与计算结果相比会偏低,再使用余氯检测仪(美国哈希)对储备液中的自由氯浓度重新标定。根据需要配制不同pH的磷酸盐缓冲液,经0.22 μm滤膜过滤后,于常温条件下保存。对于氯消毒的所有试验,除研究加氯量的影响外,β-环柠檬醛和β-紫罗兰酮均为0.05 mmol,消毒剂与β-环柠檬醛和β-紫罗兰酮的摩尔比为20∶1。将所有加氯后的样品储存在40 mL棕色顶空瓶中,在黑暗、室温(25.0±0.2) ℃条件下静置24 h。为了研究影响消毒副产物形成的因素,分别控制加氯量(自由氯与底物的摩尔比比值)为2、5、10、20、30、40,pH值为5.0、6.0、7.0、8.0、9.0,控制腐植酸质量浓度分别为1.0、2.0、5.0 mg/L。
1.3 分析方法
TCM、DCAL、TCAL、DCP和TCP用甲基叔丁基醚(MTBE)液液萃取(基于美国环保局551.1方法),后用气相色谱/质谱法测定(GC/MS,Shimadzu-QP-2010+0 Ultra,Japan),检测器采用对卤族有机物灵敏度较高的电子捕获检测器(ECD)。样品的简要处理方法步骤:(1)试验中经24 h反应的水样用抗坏血酸(加氯量的1.5倍)淬灭余氯后,移取10 mL至萃取小瓶;(2)加入2 mL MTBE,拧紧瓶塞,在旋涡震荡器上震荡5 min,静置10 min;(3)取上层有机样1 mL,进气相色谱-质谱仪检测。以上物质检测限均低于1.0 μg/L。试验中测定消毒副产物浓度时,GC/MS进样口温度为180 ℃,载气柱流量为1 mL/min,检测器温度为290 ℃。每种物质的柱温参数如表2所示。

表2 检测TCM、DCAL、TCAL、DCP和TCP的柱温参数Tab.2 Column Temperature Parameters for Analysis of TCM,DCAL,TCAL,DCP and TCP
2 结果与讨论
2.1 两种异臭化合物氯化后消毒副产物的生成
分别配置初始质量浓度C0=0.05 mmol/L的β-环柠檬醛和β-紫罗兰酮,分别投加浓度为1 mmol/L自由氯,在25 ℃恒温、pH值为7.0的黑暗条件下反应24 h后,分别检测β-环柠檬醛和β-紫罗兰酮加氯反应后消毒副产物的生成潜能,如图1所示。使用GC-MS定量检测了5种消毒副产物,包括TCM、DCAL、TCAL、DCP和TCP,全部有检出。对于2种嗅味物质,生成的消毒副产物均主要为TCM,且β-环柠檬醛氯化后TCM的生成量明显高于β-紫罗兰酮。而对于其他消毒副产物,β-环柠檬醛氯化后生成的TCAL和TCP高于β-紫罗兰酮,而DCAL和DCP则恰好相反。
2.2 加氯量对消毒副产物生成量的影响
为考察加氯量对氯化β-环柠檬醛和β-紫罗兰酮生成消毒副产物的影响,改变NaClO的投加量,控制自由氯与底物的摩尔比比值分别为2、5、10、20、30和40,并分别配置初始质量浓度C0=0.05 mmol/L的β-环柠檬醛和β-紫罗兰酮,在25 ℃恒温、pH值为7.0的黑暗条件下反应24 h后,检测所生成的消毒副产物。β-环柠檬醛和β-紫罗兰酮在不同加氯量条件下消毒副产物的生成情况分别如图2和图3所示。
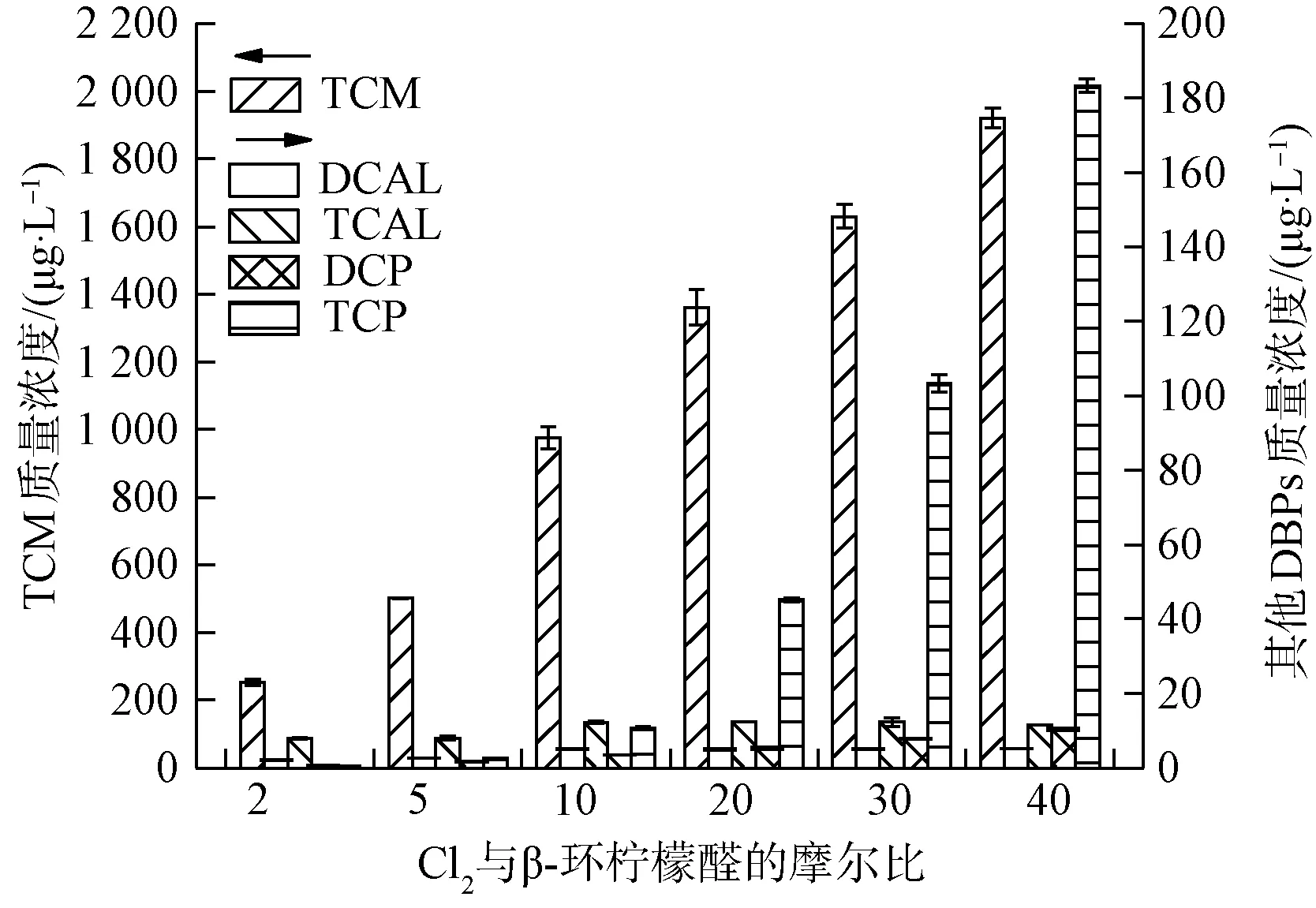
图2 加氯量对β-环柠檬醛氯化后生成消毒副产物的影响Fig.2 Influence of Chlorine Dosage on Formation of Chlorination DBPs of β-Cycloconcitral
由图2可知,β-环柠檬醛氯化后,TCM、DCP和TCP的生成量随着加氯量的提高而增加,且在自由氯与β-环柠檬醛的摩尔比比值由2增大到10这段区间内,TCM生成量由252.8 μg/L迅速增加到975.8 μg/L,平均每摩尔比的增加量为90.4 μg/L。在自由氯与β-环柠檬醛的摩尔比比值由10增大到40这段区间内,TCM生成量由975.8 μg/L相对缓慢增加到1 920.8 μg/L,平均每摩尔比的增加量为31.5 μg/L。TCP生成量则是随着加氯量的增加升高得越来越快,从平均每摩尔比的增加量为1.5 μg/L增加到8.0 μg/L。DCAL和TCAL的生成量随着加氯量的增加表现出先缓慢增加后基本不变的趋势,均是在自由氯与β-环柠檬醛的摩尔比比值达到10后,表现出加氯量饱和或过量的状态,反应速率变得相对平缓。

图3 加氯量对β-紫罗兰酮氯化后生成消毒副产物的影响Fig.3 Influence of Chlorine Dosage on Formation of Chlorination DBPs of β-Ionone
由图3可知,β-紫罗兰酮氯化后,TCM、DCP和TCP的生成量随着加氯量的增加而增加,这一变化趋势与β-环柠檬醛相同,但TCM生成量增长相对缓慢,平均每摩尔比的增加量为6.7 μg/L。TCP生成量则同样是随着加氯量的增加而升高得越来越快,从平均每摩尔比的增加量为0.3 μg/L增加到6.1 μg/L。DCAL和TCAL的生成量随着加氯量的增加无明显的变化,即使在自由氯与β-紫罗兰酮的摩尔比比值达到10之前,DCAL和TCAL的生成量也一直保持在一个平稳的水平。
2.3 pH对消毒副产物生成量的影响
为考察pH对氯化β-环柠檬醛和β-紫罗兰酮生成消毒副产物的影响,设定5个不同值(5.0、6.0、7.0、8.0、9.0)进行试验,配置初始质量浓度C0=0.05 mmol/L的β-环柠檬醛和β-紫罗兰酮,控制自由氯与底物的摩尔比比值为20,在25 ℃恒温、pH值=7.0的黑暗条件下反应24 h后,检测所生成的消毒副产物。β-环柠檬醛和β-紫罗兰酮在不同pH条件下消毒副产物的生成情况分别如图4、图5所示。

图4 pH对β-环柠檬醛氯化后生成消毒副产物的影响Fig.4 Influence of pH Value on Formation of Chlorination DBPs of β-Cycloconcitral

图5 pH对β-紫罗兰酮氯化后生成消毒副产物的影响Fig.5 Influence of pH Value on Formation of Chlorination DBPs of β-Ionone
由图4可知,β-环柠檬醛氯化后TCM的生成量随着pH的增大而增加,碱性条件有利于TCM的生成。CHU等[16]发现,酪氨酸氯化后TCM的生成量随pH的增大而增加,原因是在碱性条件下,氢氧根(OH-)的增加对水体的去碳化(decarboxylation and desamination)有促进作用,促进氯化过程中TCM前体物的生成,这也说明β-环柠檬醛氯化生成TCM属于碱促反应模式而非酸促反应模式[17]。DCAL生成量在酸性和中性条件下基本不变,而在pH值为8.0时,生成量出现了明显的减小,且在碱性条件下,随着pH的增大,生成量略有缓慢的减小,说明碱性条件不利于DCAL的生成,而碱性的强弱对生成量的影响有限。TCAL生成量在酸性条件下随pH的增大而增加,而在碱性条件下则随pH的增大而减小,在pH值为7.0时,生成量达到最大值,说明中性或接近中性的条件有利于TCAL的生成。DCP生成量在酸性条件下随pH的增大而增加,而在碱性条件下,生成量急剧下降,当pH值为9.0时,下降到无法检出。TCP的生成量随pH值的增大而减小,生成量同样在pH值由7变为8时发生了明显的下降,碱性条件下的生成量明显降低。这与Sun等[18]研究剑水蚤氯化后消毒副产物的生成情况类似,碱性条件下氯代丙酮类消毒副产物生成量较少的原因是碱性条件下氯代丙酮会加速水解成TCM。
由图5可知,与β-环柠檬醛相似的是,β-紫罗兰酮氯化后TCM的生成量同样随着pH的增大而增加。在pH值为9.0时,增加量尤为显著,可以推断β-紫罗兰酮生成TCM同样属于碱促反应模式。DCAL生成量随着pH的增大而总体上呈平稳下降趋势,但在pH值为8.0时,生成量出现了一个峰值,说明强碱性条件不利于DCAL的生成,但影响有限。TCAL生成量随着pH值的增大呈现先增大后减小的趋势,较强的酸性或碱性均可以抑制TCAL的生成。DCP和TCP生成量随pH的增大而减小,分别在pH值为7.0和8.0时出现了急剧下降,与β-环柠檬醛作为底物的试验得到了相同的结论,即氯代丙酮在碱性条件下会加速水解成TCM。
2.4 腐植酸对消毒副产物生成量的影响
为考察腐植酸浓度对氯化β-环柠檬醛和β-紫罗兰酮生成消毒副产物的影响,配置初始质量浓度C0=0.05 mmol/L的β-环柠檬醛和β-紫罗兰酮,试验于反应液中投加浓度分别为1.0、2.0、5.0 mg/L的腐植酸,控制自由氯与底物的摩尔比比值为20,在25 ℃恒温、pH值为7.0的黑暗条件下反应24 h后,检测所生成的消毒副产物。β-环柠檬醛和β-紫罗兰酮在不同腐植酸浓度条件下消毒副产物的生成情况分别如图6和图7所示。
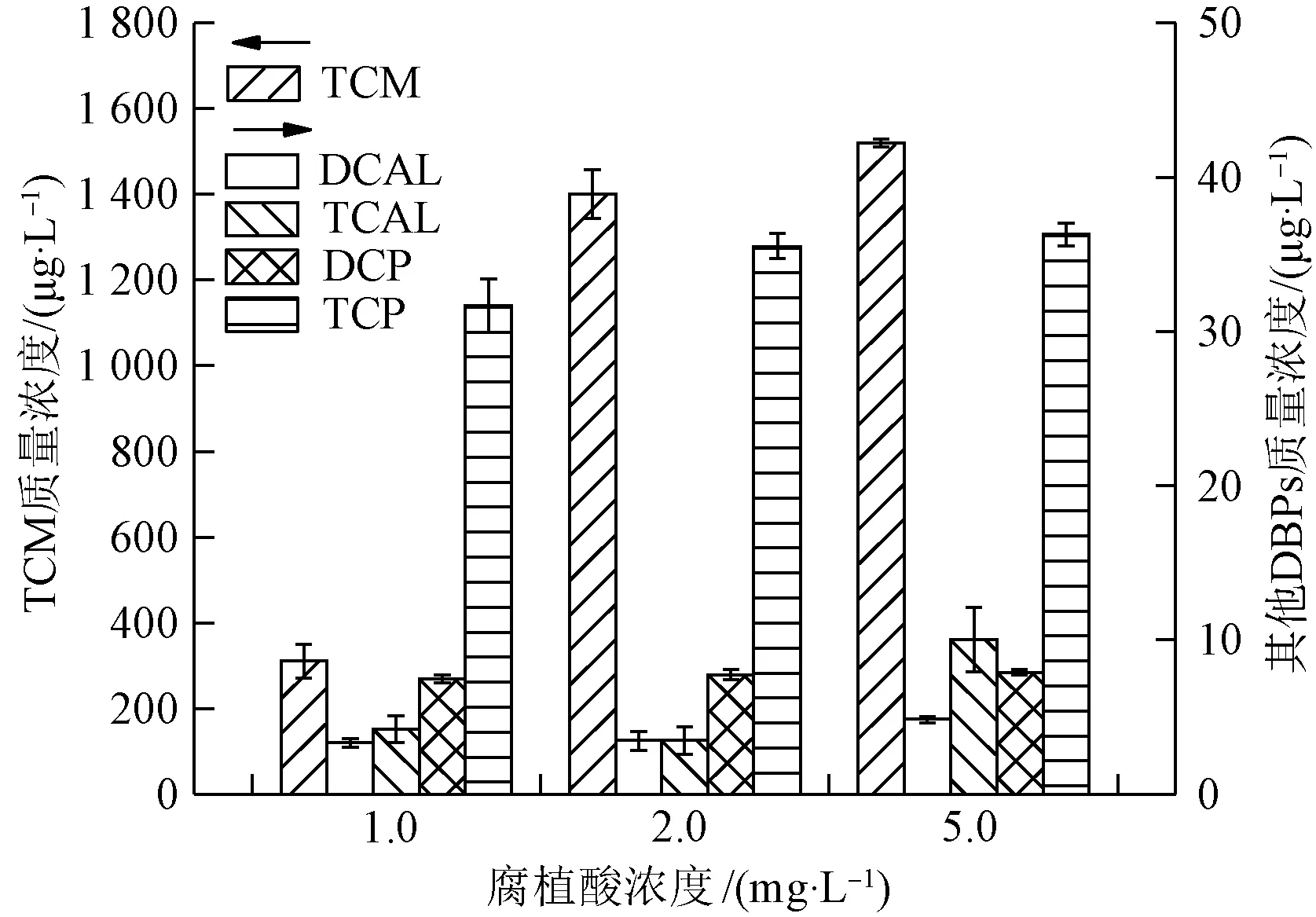
图6 腐植酸浓度对β-环柠檬醛氯化后生成消毒副产物的影响Fig.6 Influence of Humic Acid Concentration on Formation of Chlorination DBPs of β-Cycloconcitral
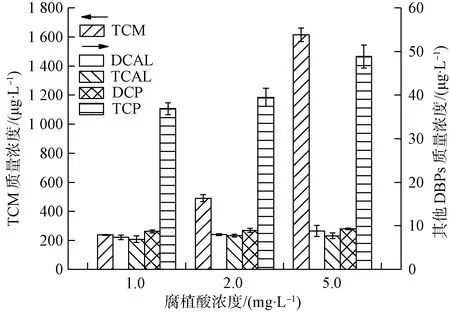
图7 腐植酸浓度对β-紫罗兰酮氯化后生成消毒副产物的影响Fig.7 Influence of Humic Acid Concentration on Formation of Chlorination DBPs of β-Ionone
由图6可知,β-环柠檬醛氯化后TCM的生成量随腐植酸浓度的增大而增加,在腐植酸质量浓度由1.0 mg/L增大到2.0 mg/L时,TCM生成量由311.1 μg/L迅速增加到1 400.2 μg/L,而未加腐植酸时,TCM的生成量为1 361.3 μg/L,说明低浓度的腐植酸对TCM的生成有抑制作用。DCAL和TCAL的生成量均在腐植酸质量浓度达到5.0 mg/L时呈现明显的增加趋势,而在腐植酸质量浓度低于5.0 mg/L时,生成量比较平稳。DCP和TCP的生成量受腐植酸浓度的影响不大,TCP的生成量仅在腐植酸质量浓度由1.0 mg/L增大到2.0 mg/L时出现了小幅的增加。
由图7可知,β-紫罗兰酮氯化后TCM的生成量随腐植酸浓度的增大而增加,在腐植酸质量浓度由2.0 mg/L增大到5.0 mg/L时,TCM生成量由489.9 μg/L迅速增加到1 614.9 μg/L。腐植酸浓度对β-紫罗兰酮氯化后DCAL和TCAL的生成量无明显影响,与β-环柠檬醛在低腐植酸浓度条件下的氯化得到了相似的结论。DCP和TCP的生成量随腐植酸浓度的增大而缓慢增加,总体变化不大,这同样与β-环柠檬醛氯化后结论相似,说明腐植酸不参与和影响DCP和TCP的形成。
3 结论
(1)β-环柠檬醛和β-紫罗兰酮在氯化过程中均有较强的DBPs生成能力,除β-环柠檬醛在氯化后TCM的生成量明显高于β-紫罗兰酮外,DCAL、TCAL、DCP、TCP的生成量相近。
(2)加氯量对β-环柠檬醛和β-紫罗兰酮的氯化过程有着相似的影响,TCM、DCP、TCP的生成量随着加氯量的增加而增大,而加氯量对DCAL和TCAL的生成量影响有限。
(3)pH对β-环柠檬醛和β-紫罗兰酮氯化后消毒副产物生成情况的影响大致相同。碱性条件对TCM的生成过程均有促进作用,推测DCP和TCP在碱性条件下会加速水解成TCM是导致该结果的一个因素。β-环柠檬醛和β-紫罗兰酮氯化后DCP和TCP生成量在碱性条件下都随pH的增大而急剧下降,甚至当pH值=9.0时,β-环柠檬醛氯化后不再能检出DCP。碱性条件会抑制DCAL的生成,而酸性条件会抑制TCAL的生成。
(4)β-环柠檬醛和β-紫罗兰酮氯化后TCM生成量均随腐植酸浓度的增大而增加,β-环柠檬醛在腐植酸质量浓度由1.0 mg/L增大到2.0 mg/L时,TCM生成量迅速增加,而β-紫罗兰酮则是在腐植酸质量浓度由2.0 mg/L增大到5.0 mg/L时出现了相似情况。除β-环柠檬醛氯化后DCAL和TCAL的生成量在腐植酸质量浓度达到5.0 mg/L时呈现了明显的增加趋势外,腐植酸浓度对β-环柠檬醛和β-紫罗兰酮氯化后DCAL、TCAL、DCP和TCP生成量影响均较小。
