18F-FLT PET/CT对食管鳞癌放化疗效果预测研究
2020-01-10任文佳吴式琇陈俊强陈亚楠陈维维艾沓杉蒋国梁赵快乐
任文佳 ,周 敏,吴式琇,陈俊强,陈亚楠,陈维维,艾沓杉,陈 贇,蒋国梁,赵快乐
1.复旦大学附属肿瘤医院放疗中心,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院核医学中心,复旦大学上海医学院肿瘤学系,上海 200032;
3.中国医学科学院肿瘤医院深圳医院放疗科,广东 深圳 518117;
4.福建省肿瘤医院放疗科,福建 福州 350014;
5.张家港第一人民医院,苏州大学附属张家港市医院,江苏 张家港 215600;
6.盐城市第三人民医院,南通大学第六附属医院,东南大学附属医院,江苏 盐城 224001
食管癌是中国发病率及死亡率较高的恶性肿瘤之一。同期放化疗是局部进展期食管癌的标准治疗手段之一[1-2]。长期以来,如何通过治疗前的各种临床、影像、生化或分子标志物的评估来区分肿瘤的恶性程度,以进一步判断肿瘤患者的疾病发展和生存预后,并指导治疗方案的选择,一直是临床医师十分关注的问题。正电子发射断层显像(positron emission tomography,PET)/计算机断层扫描(computed tomography,CT)是一种无创的功能显像技术,以氟代脱氧葡萄糖(18F-FDG)PET/CT应用最为广泛,在对肿瘤的诊断鉴别、分期、治疗后评价等方面有着独特的优势。目前,已有较多研究关注18F-FDG PET/CT在食管癌放化疗过程中及治疗后的参数变化预测患者的预后,但结论并不一致,这与炎症组织对FDG同样有较高摄取有关[3-5]。18F-氟代胸苷(18F-flurothymidine,18F-FLT)是另一种PET显影剂,作为胸腺嘧啶核苷的类似物,通过被胸腺嘧啶激酶(thymidine kinase 1,TK-1)单磷酸化而进入细胞。TK-1的活性在细胞周期的S期显著升高,可以反映组织中处于S期的细胞比例。因此,18F-FLT的浓度特异性的在S期细胞中升高,从而反映出增殖细胞的比例。研究表明,18F-FLT摄取与肿瘤增殖指标如Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA),S期细胞比例等相关性良好[6-7],而在炎症细胞中浓度无明显升高[8]。因此可能在肿瘤治疗的疗效评价中有着重要的价值。本研究旨在初步探索食管鳞癌根治性放疗/放化疗患者在治疗前及治疗中后期18F-FLT PET/CT的相关参数是否与患者的初期疗效及远期生存有关。
1 资料和方法
1.1 患者入选标准
患者入选标准包括:①年龄18~75岁,组织学确诊为食管鳞癌;② 未经手术、放疗、化疗或靶向治疗;③经影像学及临床评估无远处转移;④ 无严重的造血功能、心、肺、肝、肾功能异常和免疫缺陷;⑤ 白细胞≥3×109/L;中性粒细胞≥1.5×109/L;血红蛋白≥10 g/dL;血小板≥100×109/L;总胆红素<1.5倍正常值上限;谷草转氨酶(AST或SGOT)/丙氨酸氨基转移酶(ALT或SGPT)≤2.5倍正常值上限;肌酐≤1.5倍正常值上限;⑥ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分;⑦ 签署知情同意书。排除标准包括:①临床或影像学检查证实有远处转移;② 有胸腹部放疗或手术史(诊断性活检除外);③近1个月内接受过化疗;④ 有糖尿病史;⑤ 有其他影响患者接受规范治疗的躯体疾病;⑥ 育龄期女性妊娠试验阳性;⑦ 活动性精神障碍;⑧ 存在其他研究者认为不宜参加本试验的情况。
1.2 治疗方法及研究流程
所有患者均在治疗前接受完善的治疗前评估。包括:完整的病史询问和体格检查;胃镜检查及食管原发肿瘤病理学检查;外周血常规;肝肾功能;心电图;X线钡餐造影。治疗开始前两周内和放疗第4周时,分别行18F-FLT PET/CT扫描。
治疗方法采用根治性同步放化疗。放疗用适型调强放射治疗(intensity-modulated radiation therapy,IMRT)技术,1.8 Gy/次,每天1次,总剂量为61.2 Gy/34次。放疗第1天开始同期化疗。化疗方案以铂类、紫杉类或氟尿嘧啶类药物为基础,不能耐受静脉化疗的患者口服S1。不能耐受化疗或拒绝化疗者,行单纯根治性放疗。
1.3 PET/CT扫描显像
18F 由本中心加速器生产[Eclipse ST(40 mA_11 MeV);Siemens,Knoxville,Tennessee,USA],参照王明伟等[9]发表的标准方案合成18F-FLT,放化纯浓度大于95%。图像采集由Siemens Biograph 16 HR PET/CT完成。低剂量CT扫描所用电压为120 KV,CT、PET显像的层厚、层距均为5 mm。由OSEM技术完成重建,Wizard工作站自动进行PET和CT图像融合。检查前,患者需禁食至少4 h,不限制血糖水平和肢体运动。注射剂量按7.4 MBq/kg计算,注射后1 h进行全身显像。
1.4 PET/CT参数采集
对肿瘤病灶行标准摄取值(standard uptake value,SUV)半定量分析。18F-FLT PET/CT中肿瘤边界以该患者所有扫描层面中SUVmax的40%;测定食管原发病灶及区域转移淋巴结SUV的最大值,分别记为SUVmax-T和SUVmax-N;记录原发病灶长度及阳性区域淋巴结个数。
1.5 随访
在治疗结束后到两年之内每3~6个月随访1次,2年以上5年以内,每0.5~1.0年随访1次。随访资料主要来自于患者门诊复查,选择在当地医院进行复查的患者电话随访。总生存期(overall survival,OS)定义为开始治疗时间到死亡,失访或截至末次随访时间仍存活记为删失;无进展生存期(progression-free survival,PFS)定义为开始治疗时间到死亡或影像学提示或病理学检查证实的原发病灶复发或有新出现的转移,失访或截至末次随访时间疾病无进展记为删失。
1.6 统计学处理
连续变量的采用平均数或中位数进行描述,采用独立样本t检验进行差异分析。分类变量用率表示,采用秩和检验或Fisher精确概率法检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析确定诊断的灵敏度和特异度,采用Kaplan-Meier法进行生存分析,组间差异采用log-rank检验。采用X-tile软件进行最佳截断值的选取。单因素及多因素分析采用COX回归。所有分析采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 入组患者基本临床资料及治疗情况
2012年5月—2016年11月,共有39例患者入组,均完成了治疗前的PET/CT扫描,临床特征见表1。其中,25例患者完成了第2次18F-FLT PET/CT检测。3例患者放化疗过程中因不良反应,中断放疗7、18和53 d,恢复后完成了放疗。1例患者因放疗23.4 Gy/13次时气管食管瘘中止治疗。所有完成两次扫描的25例患者均按计划完成了放疗或放化疗。
随访至2018年2月29日,39例患者中,共有16例患者死亡,其中12例死于疾病进展,1例死于脑卒中,3例死亡原因不详。患者1、2、5年OS率分别为75.4%、45.9%、30.6%,1、2、5年PFS率分别为38.4%、29.87%及19.92%。
2.2 放疗4周时肿瘤原发病灶PET/CT参数变化情况
如表1所示,食管鳞癌患者根治性放化疗开始4周后,18F-FLT PET/CT显像中,原发病灶SUVmax-T由平均6.63下降到1.22(P<0.0001),淋巴结S U Vmax-N由平均3.6 9 下降到1.8 4(P=0.003)。SUVmax-T下降比例平均为82.20%(28.10%~100.00%),中位数100%(表2)。13例患者放疗4周时原发灶的18F-FLT摄取减少至正常。图1为1例患者治疗前及治疗4周后的扫描图像,可见放化疗后SUV值有明显下降。
生存分析显示治疗前18F-FLT PET/CT的SUVmax-N对患者的预后有影响。以5为截断值,低SUVmax-N的患者OS(中位生存时间:Undefinedvs13.75个月,P=0.002)及PFS(Undefinedvs9.53个月,P=0.01)均明显优于高SUVmax-N组(图2A)。而治疗前18F-FLT PET/CT的SUVmax-T以中位数6.30为截断值,SUVmax-T<6.30及SUVmax-T>6.30的患者,其OS(中位生存时间:22.70个月vs45.27个月,P=0.564)及PFS(中位生存时间:15.40个月vs15.13个月,P=0.865)差异无统计学意义。对患者的OS行单因素及多因素分析,基线SUVmax-N是患者OS的独立预测因子。
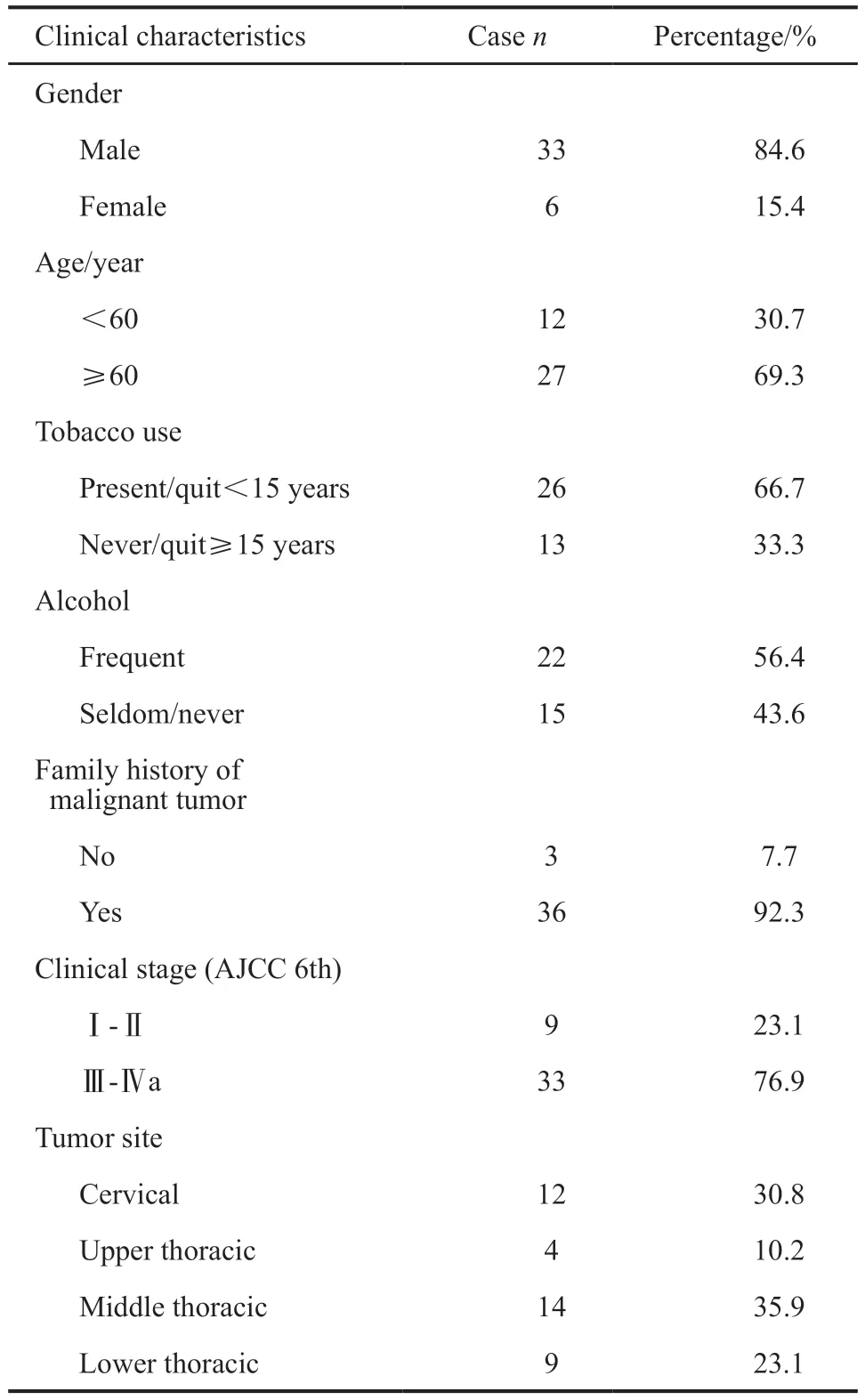
表1 患者临床特征Tab.1 Clinical characteristics of patients
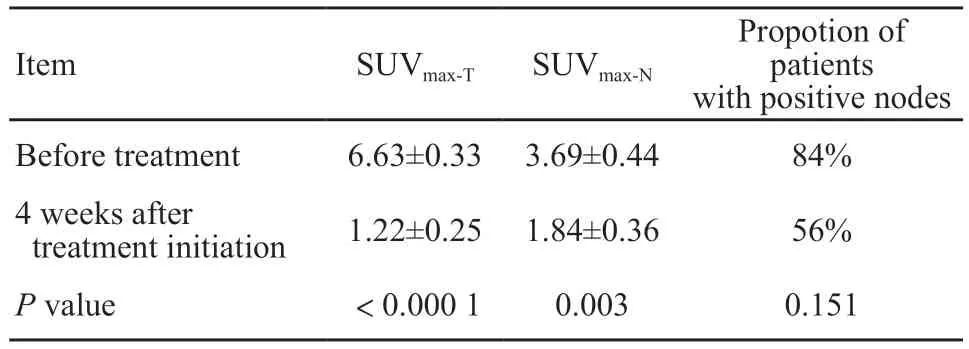
表2 患者治疗开始4周后与基线18F-FLT PET/CT参数对比Tab.2 Comparison of 18F-FLT PET/CT parameters between patients before and 4 weeks after treatment initiation
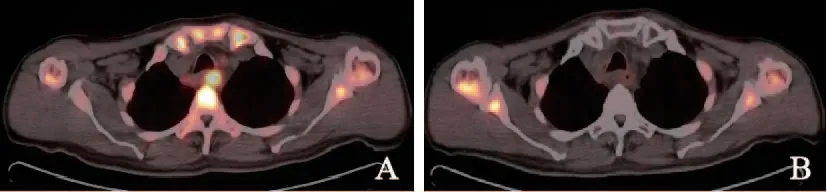
图1 同一患者放疗前后18F-FLT PET/CT图Fig.1 Images of 18F-FLT PET/CT before and after radiotherapy initiation of one patient
2.3 治疗中较基线18F-FLT PET/CT参数变化与患者预后的关系
尽管放疗可以明显降低肿瘤的代谢及增殖活性,然而,生存分析并未提示放疗4周时肿瘤SUV值下降的比例与预后相关。取SUVmax-T下降比例的中位数为截断值,18F-FDG PET/CT显像中,SUVmax-T减少比例<61.2%的患者与≥61.2%的患者的OS(P=0.587)及PFS(P=0.882,图2B)差异均无统计学意义。

图2 治疗前18F-FLT PET/CT的SUVmax-N对患者OS的影响(A)及放疗开始4周后 SUVmax-T较基线降低百分比与OS的关系(B)Fig.2 Kaplan-Meier curves of OS in patients with different SUVmax-N(A) and decrease of SUVmax-Tfrom baseline scan (B)

表3 患者OS时间的单因素及多因素分析Tab.3 Univariate and multivariate analyses of clinical parameters and OS in patients with esophageal squamous carcinoma treated with radical radiotherapy
3 讨 论
尽管18F-FLT PET/CT被认为可能较18F-FDG PET/CT具有更好的肿瘤特异性,但目前其应用仍多处于临床试验阶段,并非如同18F-FDG PET/CT那样已进入肿瘤的诊疗常规。18F-FLT PET的优势在于,细胞接受放射治疗或化学治疗后,其增殖能力迅速下降,且几乎不受炎症的影响。有研究表明,食管癌在放疗开始后2~4周18F-FLT PET/CT摄取值即明显下降,降到与治疗结束后2~4周相仿的水平,而18F-FDG PET/CT则在治疗开始后不断缓慢下降[10-11]。因此18F-FLT PET/CT参数的变化有望成为早期预测肿瘤治疗效果的标志物。尽管许多研究者为此做出了有益的尝试和积极的探索,目前关于食管鳞癌中18F-FLT PET/CT价值的报告仍较为有限。
我们发现,尽管18F-FLT PET/CT显像中食管原发病灶的SUVmax值不能很好地预测患者的长期生存,但淋巴结的SUVmax则可作为患者预后的危险因素。SUVmax-N<5.00的患者OS(P=0.002)及PFS(P=0.010)均明显优于高SUVmax-N≥5.00的患者。同时可以发现,治疗开始4周后的18F-FLT PET/CT与基线相比,SUVmax-N的下降幅度均远小于SUVmax-T,这提示淋巴结的肿瘤细胞与原发病灶可能具有不同的放射敏感性,淋巴结对放化疗更不敏感,也更容易成为疾病进展的来源。然而,由于本研究样本量较小,限制了结果的可靠性。但据我们所知,既往研究多关注于肿瘤原发病灶的功能影像变化,我们的研究支持进一步探索转移淋巴结的摄取活性与患者预后的关系。
我们发现,18F-FLT PET/CT显像在治疗后的早期变化情况无法较好地预测患者的生存预后。这与Chen等[11]的研究结论相左。该研究对根治性放化疗的食管鳞癌患者进行了3次18F-FDG 及18F-FLT的PET/CT,分别在治疗前、治疗开始后4周、治疗结束后2周,发现第2次较第1次18F-FLT摄取值下降>60%的患者有着明显较好的OS和PFS,且预测能力优于FDG标准摄取值的变化。该研究使用的放射剂量及化疗方案均与本研究类似,结果不一致可能与该研究入组的患者较本研究病期更早有关。该研究有38.2%的N0患者,2年生存率为61.8%,高于本研究的47.9%。FLT早期预测疗效的准确性或与肿瘤分期有关。
本研究并未发现FLT的SUV值在放疗进行4周时的改变与预后有关。由于本研究样本量小,FLT在食管鳞癌疗效监测中能发挥何种作用,仍需大样本的更多研究进一步加以讨论。
