观赏植物铜钱草的组织快繁技术研究
2020-01-09唐凝李旭东裴冬丽
唐凝,李旭东,裴冬丽
(商丘师范学院 生物与食品学院,植物与微生物互作河南省高校重点实验室,河南 商丘,476000)
0 引 言
铜钱草(Hydrocotylevulgaris)又名香菇草,是伞形科天胡荽属多年生草本植物,原产欧洲、北美及美洲中部地区[1].铜钱草叶片呈翠绿,外形如铜钱,小巧玲珑,具有适应性强,生长旺盛的特点.铜钱草生长环境湿润,对其周围水源有去除氮、磷和有机物的功能,可以起到净化城市污水的作用[2];作为室内观赏植物,铜钱草能够吸收甲醇等有害气体,净化室内环境[3].随着近年来大量外国观赏植物被引入国内,铜钱草逐渐受到消费者的喜爱,成为热门的水生观赏植物,同时也广泛应用于园林绿化及湿地造景[4].
观赏植物组织培养就是在无菌操作条件下,分离观赏植物体的花、茎尖、茎段、叶片或幼胚等部位,并配合营养物质与生长调节物质,通过人工模拟生长环境,控制温度、光照等因素,使其迅速繁殖,短期内选育出大量遗传性状统一的幼苗,又称植物克隆育苗技术[5].植物克隆育苗技术培育优质组培苗,可作为提高铜钱草人工种植效率、培育新品种、选育更优性状的重要技术手段.通过诱导叶片愈伤组织增殖,经诱导分化、壮苗生根后能够培育出大量优质的铜钱草苗.本试验通过优化组培快繁方法,提高分化效率,建立高效的铜钱草离体再生培育体系,为优质铜钱草苗的培育提供理论依据和应用价值.
1 材料与方法
1.1 材料
生长良好,无病虫毒害的铜钱草植株购自商丘市花卉市场.移栽至实验室光照培养箱培养一周后,采用其叶作为外植体.
1.2 培养基及培养条件
以每1000 ml MS培养基(Murashige and Skoog)加入7 g琼脂、30 g蔗糖,作为基础培养基.每1000 ml 1/2MS培养基加入7 g琼脂、15 g蔗糖,作为1/2MS基础培养基,pH调整为5.8.光照培养室温度25 ℃;诱导愈伤和继代培养为暗培养;分化和生根诱导时,给予每天12 h光照(光强1200 lx)[6].
1.3 消毒处理
分别以0.1%氯化汞和2%次氯酸钠进行外植体消毒试验.将健康的铜钱草叶片,在流水中冲洗20 min,转入超净工作台,75%乙醇浸泡30 s,无菌水冲洗5次,用0.1%氯化汞或2%次氯酸钠消毒6 min、8 min、10 min或12 min,最后用无菌水冲洗叶片4次,置于灭菌滤纸上,吸干表面水分.将消毒后的叶片用有弧度的刀片切去边缘部分,成1 cm×1 cm正方形.接种至MS+1.0 mg/L 6-BA+0.5 mg/L NAA培养基,10 d后观察统计外植体的污染情况,20 d后观察不同处理的外植体的愈伤组织诱导情况,并进行数据统计,选出最适消毒方式.
1.4 不同激素配比对愈伤组织诱导分化的影响
基础培养基MS,添加不同浓度的6-BA、NAA生长调节剂,6-BA质量浓度设为0.5 mg/L、1.0 mg/L、1.5 mg/L 3个水平,NAA质量浓度设为0.1 mg/L、0.5 mg/L、1.0 mg/L 3个水平,共9种组合方法.各个组合接种9瓶,每瓶接种3个叶片为外植体.20 d后察看并记录下外植体愈伤组织生长情况.45-50 d之后观察不定芽分化,并统计数据.
1.5 生根培养
不定芽生长到1-2 cm时,将其转接到以基本培养基MS,添加NAA、IBA不同质量浓度的诱导生根培养基内,NAA浓度均为0.1 mg/L,IBA浓度为0 mg/L、0.05 mg/L、0.10 mg/L、0.15 mg/L、0.20 mg/L,共5种组合方法,25 d后观察并记录其生根情况,计算不同组合下不定芽生根率和平均生根长度.
2 结果与分析
2.1 不同消毒试剂及消毒时间对外植体消毒的影响
采用不同时间的0.1%氯化汞或2%次氯酸钠进行外植体消毒处理,研究不同消毒条件对外植体成活的影响.消毒试剂浓度过高或消毒时间过长会导致外植体褐化死亡;消毒时间过短或消毒不彻底则会引发外植体的大量污染.本试验不同灭菌处理对外植体的影响结果见表1,采用0.1%氯化汞作为消毒试剂时,消毒10 min的外植体污染率最低4%,消毒8 min的外植体成活率最高62%;采用次氯酸钠作为消毒试剂时,处理10 min,外植体的污染率最低6%,出愈率最高86%.综合分析不同处理组的消毒效果,使用2%次氯酸钠处理10 min,75%酒精处理30 s的消毒方法,外植体污染率最低,出愈率最高,为最适消毒方法.
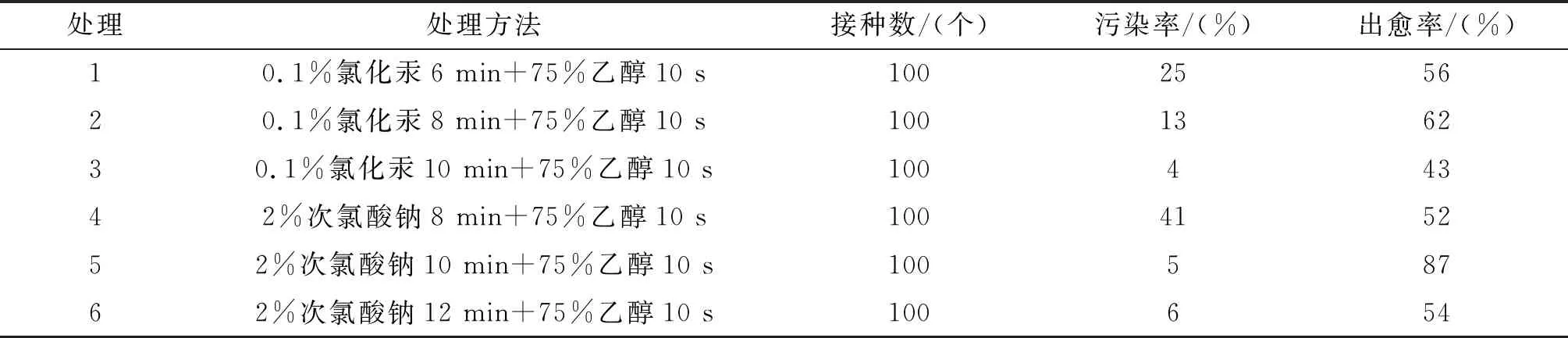
表1 不同灭菌处理对外植体的影响
2.2 不同激素配比对铜钱草叶片愈伤组织诱导分化的影响
以叶片作为外植体,本试验研究了用不同激素(6-BA与NAA)浓度组合进行愈伤组织诱导分化培养,得到以下数据(表2).在20 d时观察的愈伤组织成长状态(图1A),比较其出愈率,其中培养基9的出愈率最高.待45 d之后观察到培养基2、3、9中有较多的的愈伤组织分化出不定芽,茎延伸生长(图1B).9号培养基的分化率最高,达到95.06%.2号培养基虽然出愈率高,但其分化率很低.8号培养基的生长情况与2号类似.1号、7号培养基只有少量外植体诱导形成不定芽,且不定芽的长势较弱.4号培养基的出愈率和分化率都很低.比较出愈率和分化率,选择最适的诱导分化培养基为9号培养基,即MS+6-BA1.5 mg/L+NAA1.0 mg/L.

图1 铜钱草组培苗的培养及扩繁A:胚性愈伤组织;B:不定芽;C、D:生根培养Figure1 Culture and multiplication of Hydrocotyle vulgarisA: Embryonic callus multiplication;B: Bud seedlings;C,D: Roots development
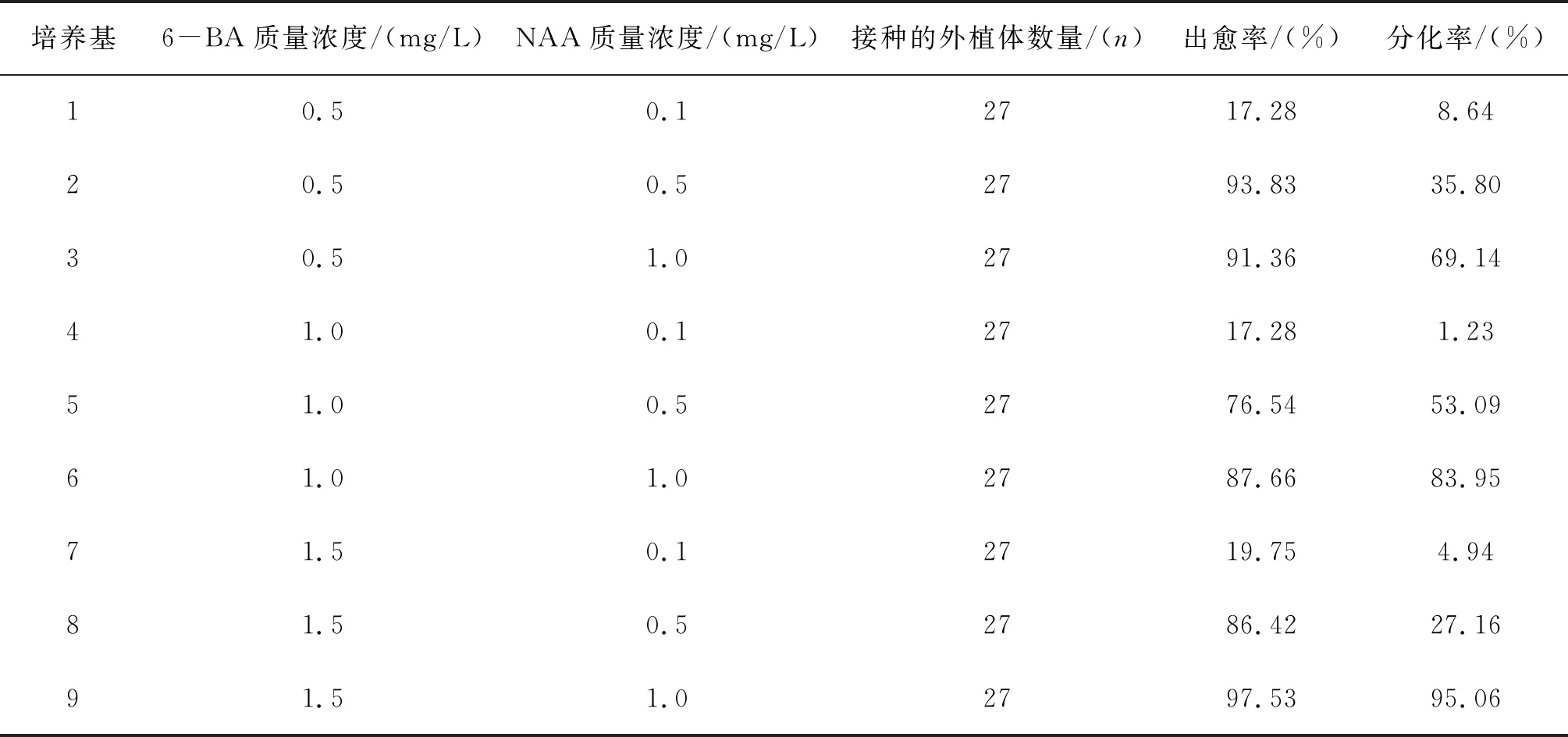
表2 不同植物生长调节剂配比对愈伤组织诱导分化的影响
2.3 不同激素配比对铜钱草苗根系生长的影响
用0.1 mg/L NAA与不同浓度的IBA的1/2MS培养基进行不定根诱导,探究不同浓度生长素IBA对诱导不定根的影响.不定芽接至生根培养基,25 d统计不定根数目,测量不定根长度,计算生根率与平均根长,图1C、1D为诱导生根培养.结果见表3,采用加入0.05 mg/L IBA的1/2MS培养基生根率最高,为96.30%,平均根长2.30 cm;0.10 mg/L IBA的1/2MS培养基生根率91.36%,平均根长为2.47 cm.综合分析,平均根长接近,生根率接近的情况下,生根率高且所需激素量越小的组合生产效率更高,因此,0.1 mg/L NAA+0.05 mg/L IBA的1/2MS为最佳生根培养基.
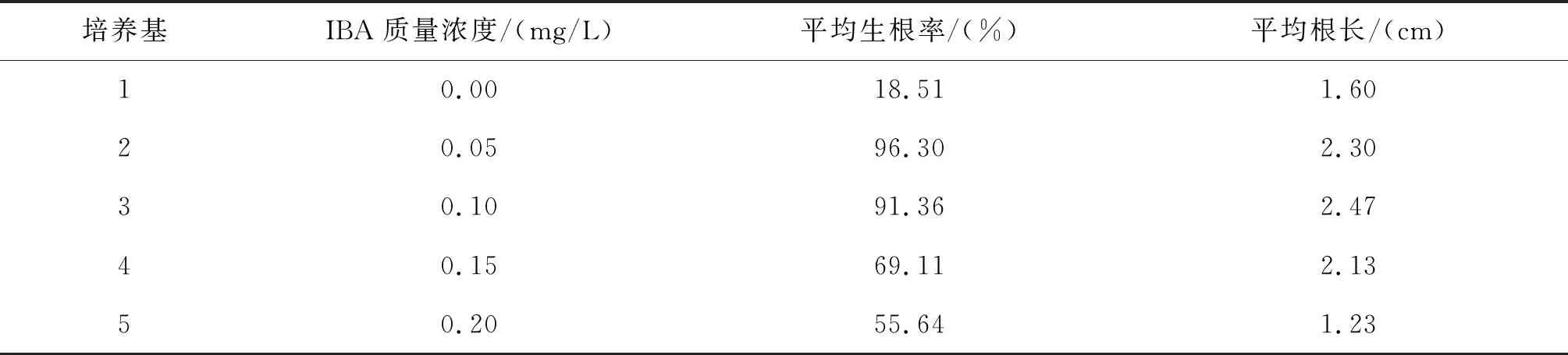
表3 不同植物生长调节剂配比对生根的影响
2.4 炼苗和移栽
组培条件为无菌高营养环境,组培苗抗逆性差,根系活力低,直接移入土壤中成活率低.为增加成活率,待苗高度为3-4 cm时,需要将组培瓶口打开炼苗1周,之后将组培苗取出,在自来水下小心冲洗除去根部的培养基,移栽至珍珠岩∶草炭∶蛭石为1∶1∶1的基质中.每4 d浇灌一次1/3MS营养液,24 ℃光照培养室培养,定期浇水,保持土壤湿润[7-8].植株移苗后涨势良好,出现新芽.
3 讨 论
组织培养已广泛应用于观赏植物的幼苗培养、品种选育、标准化生产等环节,相较于有性繁殖,组织培养铜钱草苗能够增加产量、提高效率、优化性状,但铜钱草的组织培养方法报道少,且培养效率不高[9].众所周知在标准化生产组培苗的过程中,外植体消毒成功率直接影响组培苗的产量.黎海利等[10]在组织培养报春花科聚花过路黄植物时,选用氯化汞浸泡6 min的方法对外植体进行消毒处理,但消毒效率不高.本试验为提高铜钱草外植体消毒成功率,探究了不同试剂与不同处理时间对外植体消毒效果的影响.本试验采用2%次氯酸钠消毒处理10 min的方法使外植体成活率达到86%,值得注意的是次氯酸钠安全性明显优于氯化汞,毒害性小.杨洪元等[11]认为MS基础培养基中加入1.5 mg/L 6-BA+0.18 mg/L NAA可作为广金钱草的继代培养基,可诱愈伤组织,但形成的愈伤组织形状不规则,易褐化.为实现铜钱草的高效增殖扩繁,本试验用不同浓度6-BA和NAA组合的MS培养基进行愈伤组织诱导和分化培养、不同浓度NAA和IBA组合的1/2MS培养基进行生根培养,得到一组分化率达95.06%,生根率达96.30%的铜钱草快速扩繁体系.组织培养的铜钱草苗具脱病毒、增殖倍数大、繁殖材料少、苗株大小一致等优点.本试验成功建立了高效的铜钱草组培体系,对标准化、规模化生产优质铜钱草苗、提升培育质量提供了理论依据和实用价值.
