反应动力学拆分法合成(2S,4R)和(2S,4S)-6-庚烯-2,4-二醇
2020-01-07熊高伟刘永军任君李焰
熊高伟,刘永军,任君,李焰
(湖北大学化学化工学院,湖北 武汉 430062)
0 引言
(2S,4R)和(2S,4S)-6-庚烯-2,4-二醇属常用的1,3-二醇手性砌块,可广泛应用于多羟基类手性药物或天然生物活性物质的合成中,如(2S,4R) -6-庚烯-2,4-二醇可用于鱼类病原海洋分枝杆菌分离得到的天然生物活性物质mycolactone F合成中[1]; (2S,4S)-6-庚烯-2,4-二醇可用于有抗癌活性天然产物misakinolide A[2]、天然产物F-肌动蛋白抑制剂Swinholide A[3]和天然植物药用活性物质(+)-cryptocarya diacetate[4]等的合成中,目前国内外合成(2S,4R)和(2S,4S)-6-庚烯-2,4-二醇的方法主要是使用不对称合成法,如Kim等使用手性磺胺配体诱导的烯丙基锰试剂加成反应合成法[1],Shin等使用手性膦配体的Ir(III)催化剂的不对称C-H烯丙基化反应合成法[2-3]; Yadav等使用Sharpless不对称环氧化反应合成法[4];Smith等使用手性Rh (III)催化剂的Markovnikov 硼氢化反应合成法[5];Robertson, J.等人使用手性酒石酸催化硅烷羰基烯环化反应合成法[6]等,此外,Nogawa等使用syn-二醇的碳酸酯为原料的生物酶水解合成(2S,4R) -6-庚烯-2,4-二醇[7], 上述这些方法除存在合成成本高,原料难得,不适合大量制备等问题外,也存在1,3-二醇类化合物合成中通常出现的含不同比例的anti/syn-二醇异构体难分离的问题. 2002年Muller小组曾报道了使用1,3-二醇丙酮叉保护产物为原料,利用其盐酸酸性水解时反应速度不同,成功将非手性的anti/syn-二醇异构体分离开[8].
本研究借鉴此文献设想,利用anti/syn-1,3-二醇异构体进行丙酮叉保护以及脱丙酮叉保护的反应速度均不同的特性,对anti/syn-二醇异构体进行反应动力学拆分. 即以天然手性源(S)-3-羟基-丁酸甲酯为原料合成出含anti/syn-二醇异构体的 (2S,4R/S)-6-庚烯-2,4-二醇,再以樟脑磺酸作为催化剂使用2,2-二甲氧基丙烷(DMOP)-丙酮体系对anti/syn-1,3-二醇进行丙酮叉保护,通过控制反应进程可直接高立体选择性动力学拆分得到未反应的anti-1,3-二醇 (2S,4S)-6-庚烯-2,4-二醇((2S,4S)-5),同时其合成的1,3-二醇丙酮叉保护的产物再进行盐酸催化的酸性动力学水解反应,优选水解anti-1,3-二醇丙酮叉保护产物,可高立体选择性动力学拆分得到syn-二醇丙酮叉保护产物,最后经酸性完全水解即可得到目标物syn-二醇(2S,4R) -6-庚烯-2,4-二醇((2S,4R)-5),其总合成路线如图 1所示:

图1 标题化合物的总合成路线(a) imidazole/TBSCl/DCM/0 ℃ to RT, 93%;(b) DIBAL-H/ DCM/-78 ℃/92%;(c) Zn/Allylbromide/NH4Cl(aq.)/THF/0 ℃ to RT, crude;(d) TBAF/THF/0 ℃ to RT, 91%;(e) camphorsulfonic acid(0.1 eq.)/DMOP(0.5 eq.) /acetone/RT/32.4% for anti-diol/syn-diol=29∶1;(f) HCl(0.05 eq,2 mol/L)/DCM/RT/30%);(g) HCl (0.05 eq, 2 mol/L) /DCM/RT//96% for
1 实验部分
1.1 试剂和仪器DIBAL-H试剂为Aldrich试剂,(S)-3-羟基丁酸甲酯、叔丁基二甲基氯硅烷、烯丙基溴、樟脑磺酸、2,2-二甲氧基丙烷(DMOP)均为国产试剂,活性锌为新鲜制备,其处理方法为普通锌粉依次用稀盐酸洗涤、水洗涤、乙醇洗涤、四氢呋喃洗;.核磁共振友 Aglient 500(500 MHz for proton)测定,化学位移(δ)的单位为10-6.

1.3 化合物3的合成向500 mL干燥的蛋形瓶中加入化合物2(21.0 g,90 mmol),抽换氮气后氮气保护,向瓶中加入干燥的溶剂DCM(250 mL),使原料充分溶解后置于-78 ℃冷却浴下搅拌反应,5 min后温度稳定后逐滴加入DIBAL-H溶液(1.0 mol/L,in hexanes,110 mL,110 mmol),加完后-78 ℃下反应3 h, TLC显示原料完全消失. 撤去冷却浴后加入甲醇(20 mL)淬灭反应,将反应混合物倒入饱和的酒石酸钾钠水溶液中(400 mL)并用乙醚(200 mL)稀释. 将该混合物剧烈搅拌2 h直至两相澄清,分离各相,水相用乙醚(200 mL,两次)萃取,合并有机相,饱和食盐水洗,无水硫酸钠干燥,过滤,真空浓缩除去溶剂,柱层析(PE∶EA=40∶1),得到产物化合物3(16.9g,83.5 mmol,92.2%).1H NMR (500 MHz, CDCl3)δ=9.80 (dd,J=2.8, 2.1 Hz, 1H), 4.39-4.32 (m, 1H), 2.55 (ddd,J=15.7, 7.0, 2.8 Hz, 1H), 2.47 (ddd,J=15.7, 4.9, 2.1 Hz, 1H), 1.24 (d,J=6.2 Hz, 3H), 0.88 (s, 9H), 0.08 (s, 3H), 0.07 (s, 3H).13C NMR (126 MHz, CDCl3):δ202.16, 77.24, 76.98, 76.73, 64.54, 52.97, 25.71, 24.16, 17.94, -4.39,-4.96.
1.4 化合物4的合成向500 mL干燥的蛋形瓶中加入化合物3(16.9 g,83.5 mmol),加入溶剂THF(300 mL),使其充分溶解后置于0 ℃冰浴下. 缓慢加入活化后的锌粉(13.6 g,209 mmol),逐滴加入烯丙基溴(10.6 mL,125 mmol),10 min后加入饱和氯化铵水溶液(50 mL),加完10 min后升至室温反应,4 h 后TLC原料消失. 加入150 mL乙酸乙酯稀释,过滤掉固体,分离各相,水相用乙酸乙酯(50 mL,两次)萃取,合并有机相,饱和食盐水洗,无水硫酸钠干燥,过滤,真空浓缩除去溶剂,得到粗产物化合物4. 不经柱层析,直接投入下一步.
1.5 化合物2S,4R/S-5的合成向500 mL干燥的蛋形瓶中加入化合物4粗产物及溶剂THF(200 mL),使其充分溶解后置于0 ℃冰浴下,逐滴加入TBAF(1.0 mol/L, in THF, 120 mL, 120 mmol),加完10 min 后升至室温,反应3 h后TLC原料消失. 加100 mL 水淬灭,用乙酸乙酯(100 mL,三次)萃取,合并有机相,饱和食盐水洗,无水硫酸钠干燥,过滤,真空浓缩除去溶剂,快速柱层析后得到二醇混合物2S,4R/S-5(9.9 g, 75 mmol, 91%).
1.6 化合物2S,4S-5的合成100 mL茄形瓶中,加入二醇混合物2S,4R/S-5 (1.86 g,14.3 mmol),向蛋形瓶中加入40 mL丙酮(AR,未用分子筛干燥)作溶剂,再向反应液中加入DMOP(882 μL,7.15 mmol,0.5 eq.),加入D-樟脑-10-磺酸(332 mg, 1.43 mmol, 0.1 eq.)催化,室温下反应1 h后加入Et3N淬灭,搅拌半小时后真空水泵浓缩,旋干溶剂,快速柱层析分离. 先用PE∶EA=10∶1分离出丙酮叉混合物(1.2 g),再改用PE∶EA=1∶5分离出反式二醇2S,4R-5 (614mg, 4.7 mmol, 32.4%, anti∶syn=29∶1).1H NMR (500 MHz, CDCl3)δ=5.81 (m, 1H), 5.12(m, 2H), 4.14 (m, 1H), 3.97 (m, 1H), 2.91(d,J=3.0Hz, 2H), 2.25 (m, 2H), 1.60 (m, 2H), 1.22 (d,J=6.3 Hz, 3H);13C NMR (126 MHz, CDCl3)δ134.60,118.29,77.25,77.00, 76.64, 68.14, 65.41, 43.56, 41.97, 23.54.
1.7 化合物2S,4R-6的合成500 mL茄形瓶中,加入丙酮叉混合物2S,4R/S-6(4.76 g,27.9 mmol),加入200 mL DCM溶解,加入盐酸(697 μL,13.9 mmol, 0.05 eq. 2.0 M),室温下反应6 h后加入饱和NaHCO3溶液淬灭,依次用水洗,饱和食盐水洗,无水硫酸钠干燥30 min后过滤、真空水泵浓缩,旋干溶剂,快速柱层析分离. 先用PE∶EA=10 ∶1分离出丙酮叉化合物2S,4R-6 (1.47 g, 8.65 mmol, 31%),1H NMR (500 MHz, CDCl3)δ=5.81 (m, 1H), 5.08(m, 2H), 3.97 (dqd,J=12.2, 6.1, 2.5 Hz, 1H), 3.88 (m, 1H), 2.91(d,J=3.0Hz, 2H), 2.31 (m, 1H), 2.15 (m, 1H), 2.31 (m, 1H), 1.52 (dt,J=13.0, 2.5 Hz, 1H), 1.45 (s, 3H), 1.41(s, 3H),1.18 (d,J=6.3 Hz, 3H);13C NMR (126 MHz, CDCl3)δ134.22, 117.01, 98.45, 77.25, 77.00, 76.74, 68.58, 65.07, 40.82, 38.19, 30.28, 22.23, 19.82,再改用PE∶EA=1∶5可回收分离出二醇混合物2S,4R/S-5(2.4g).
1.8 化合物2S,4R-5的合成25 mL茄形瓶中,加入上述的丙酮叉化合物2S,4R-6(300 mg,1.76 mmol),加入10 mL DCM溶解,加入盐酸(44 μL,0.088 mmol, 0.05 eq. 2.0 mol/L),室温下过夜反应完全后加入饱和NaHCO3溶液淬灭,依次用水洗,饱和食盐水洗,无水硫酸钠干燥半小时后过滤、真空水泵浓缩,旋干溶剂,柱层析(PE∶EA=10∶1)得到顺式二醇化合物2S,4R-6(218 mg, 1.67 mmol, 96%, syn∶anti=54∶1).1H NMR (500 MHz, CDCl3)δ=5.83 (m, 1H), 5.16(m, 2H), 4.18 (m, 1H), 4.01 (m, 1H), 2.29 (m, 4H), 1.63 (m, 2H), 1.18 (d,J=6.3 Hz, 3H);13C NMR (126 MHz, CDCl3)δ134.60,118.29, 77.25, 77.00, 76.64, 68.14, 65.41, 43.56, 41.97, 23.54.
2 结果与讨论

2.2 反式二醇2S,4S-5的动力学拆分曾有文献[8]报道利用顺反丙酮叉化合物在水解脱去丙酮叉保护基时的速率差异来对顺反丙酮叉混合化合物进行拆分的方法. 从该方法的经验中我们不禁反思1,3二醇混合物上丙酮叉时的速率也可能有差异,从理论上来说,反式1,3二醇丙酮叉化合物分子内相对张力更大,更不稳定、难生成,而顺式丙酮叉化合物稳定得多,所以我们可找到合适的条件,将绝大多数顺式1,3二醇反应掉,从而留下我们需要的反式二醇. 为此我们以混合物二醇2-5为底物,尝试了一些反应条件:
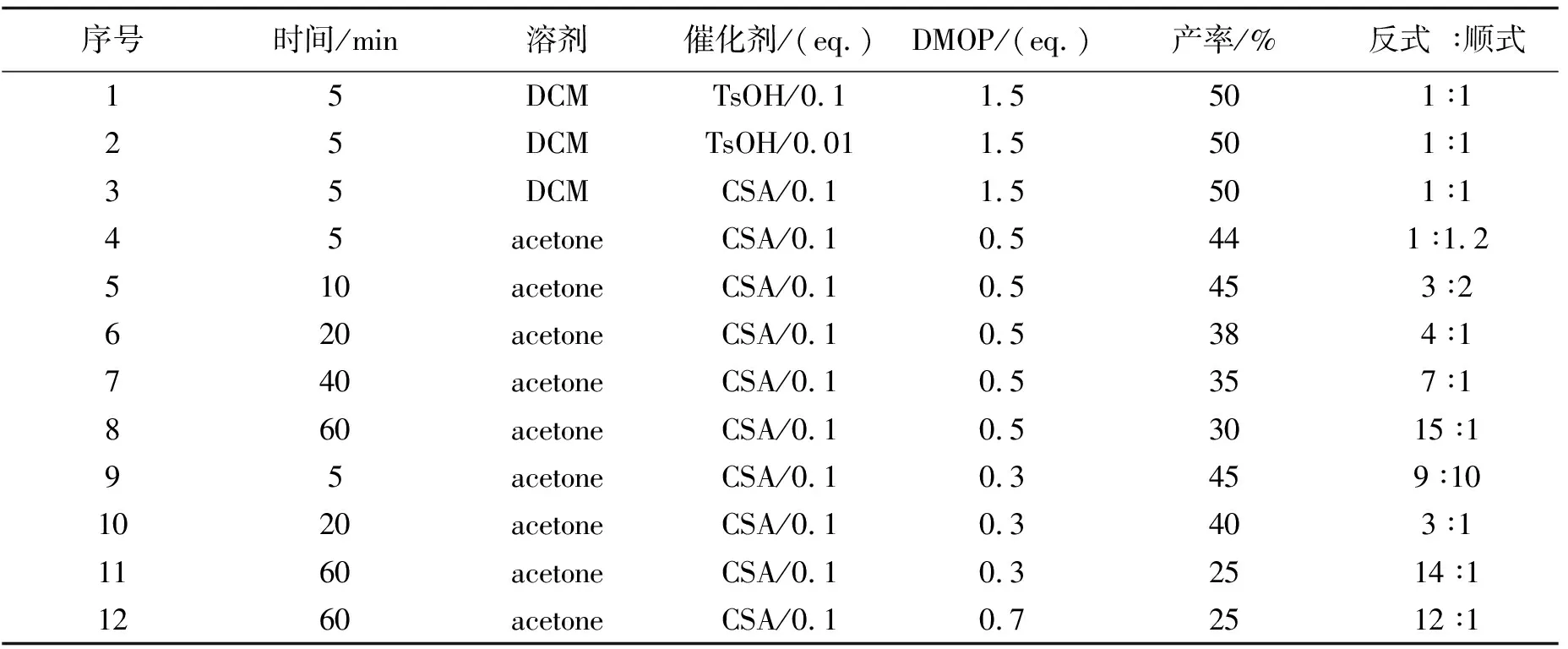
表1 1,3-二醇的动力学拆分条件

表2 1,3-丙醇的动力学拆分条件
首先我们参照文献,用二氯甲烷作溶剂,在用对甲苯磺酸或樟脑磺酸做催化剂时,均在很短时间内就反应完全,且没有选择性(序号1-3). 后来改用丙酮作溶剂,反应开始出现选择性(序号3-4).在反应开始后不同时间点,我们用三乙胺淬灭反应,处理分离后做谱观察,发现随着反应时间延长,反应产率有所下降,但是选择性有所提高(序号4-8). 另外DMOP的用量对反应选择性也有很大影响(序号8-12),1,3-二醇与DMOP摩尔比为1∶0.5时效果较好,当增加或者减少DMOP的用量时反应选择性和产率均会有所下降. 随后我们进行了克级规模的放大实验,放大实验的结果比小规模探索时的结果更好,能以32.4%的收率得到anti ∶syn=29 ∶1的反式二醇2S,4S-5.
2.3 顺式二醇2S,4R-5的动力学拆分上一步动力学拆分后的二醇丙酮叉保护产2S,4R/S-6为混合物,其初始比例约为syn∶anti=3∶1,顺反丙酮叉保护化合物在水解脱去丙酮叉保护基时的速率是不同的,以二氯甲烷为溶剂微量盐酸为催化剂的酸性条件下,反式丙酮叉化合物脱丙酮叉保护基的速度较顺式丙酮叉化合物更快,在控制反应温度为室温的情况下,可找到合适的“反应时间点”,使得反式二醇丙酮叉几乎全部水解的情况下顺式二醇丙酮叉大部分保留,从而得到纯度非常高的顺式二醇丙酮叉化合物. 其实验条件筛选见表2所示.
从表2实验数据可知室温反应时延长反应时间,动力学拆分的立体选择性增加,但分离产率会下降,优选室温下反应时间为6 h时效果较好,其可以以30%的收率得到syn∶anti=30∶1的顺式二醇丙酮叉保护产物2S,4R-6,该产物经酸性水解后可几乎定量制备出目标产物2S,4R-5.在克级别的放大规模试验中,实验结果显示收率与小规模条件探索时差不多,但立体选择性有较明显提升,能够以两步31%收率得到syn∶anti=54∶1的顺式二醇2S,4R-5.
3 结论
本研究以手性(S)-3-羟基-丁酸甲酯为原料,经TBSCl保护羟基、DIBAL-H还原及烯丙基锌试剂加成反应后合成出syn/anti-1,3-二醇异构体(2S,4R/S)-6-庚烯-2,4-二醇中间体,利用anti/syn-1,3-二醇在进行丙酮叉保护以及脱保护时反应动力学性能上的差异,高立体选择性的动力学拆分出目标产物(2S,4S)和(2S,4R)-6-庚烯-2,4-二醇.该合成路线的优点是反应动力学拆分立体选择性高、纯化方法简单易行、适合大规模合成.
