小麦春化基因新等位变异 Vrn-B3d的鉴定
2020-01-05郭阳阳范其茹郝喜英田淑媛张晓科杨松杰
郭阳阳,张 博,范其茹,郝喜英,田淑媛,张晓科,杨松杰
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.安康学院现代农业与生物科技学院,陕西安康 725000)
小麦(TriticumaestivumL.)在全球广泛种植,是我国重要的粮食作物[1]。春化特性决定了小麦的冬春习性和抽穗期,与其适应不同气候条件密切相关。春化基因主要与小麦抽穗和开花有关,可促进其营养生长向生殖生长的过渡,影响小麦的稳产和高产[2]。因此,春化基因新等位变异的挖掘和分子标记的开发,对小麦育种具有十分重要的意义。
迄今为止,在小麦中已发现了4个主要的春化基因VRN1、VRN2、VRN3和VRN4,相应的分子结构特征也已明确[3-6]。VRN1基因是小麦开花发育过程中不可缺少的促花因子,与拟南芥(Arabidopsisthaliana)分生组织基因AP1(APETALA1)同源,编码MADS-box转录因子[3]。VRN2基因是一种开花抑制因子,编码一个含锌指结构(zinc finger)和CCT结构域的转录因子,故又称其为ZCCT基因[4]。在二倍体小麦(Triticummonococcum)和大麦(HordeumvulgareL.)中,CCT结构域内的突变或完整VRN2基因的缺失,都会使其消除对春化作用的需求,但这种变异在普通小麦中并不常见[7-8]。小麦VRN3基因与拟南芥中调控开花的FT基因同源,其变异主要发生在7B染色体上,可使小麦表现为春性,研究表明,冬性小麦和春性小麦的VRN3基因编码区序列一致,突变主要发生启动子区[5]。VRN1、VRN2、VRN3基因之间相互作用,形成一个调节性正反馈回路,冬小麦在未经过春化作用和短日照条件下,VRN2基因表达量上调,进而抑制VRN1和VRN3基因的表达;在春化作用下,冬小麦茎端缓慢发育并诱导VRN1基因的表达[5],随着VRN1基因表达量和日照长度的增加,VRN2基因的表达受到抑制,从而解除了VRN2基因对VRN3基因的抑制,VRN3编码的蛋白与FDL2转录因子互作,进一步正向调控VRN1基因的表达,从而加速小麦抽穗和开花[9-10]。VRN4基因是由5A染色体上290 kb的大片段插入到5D染色体上形成的,所以又称为VRN-D4,插入片段携带VRN-A1基因,在编码区有一个独特的SNP变异A/C,使小麦表现为春性[6]。VRN4基因与其他控制春化的基因 (VRN-A1、VRN-B1、VRN-D1和VRN-B3)相互作用,共同参与小麦春化的表达调控[11]。
春化基因启动子区或第一内含子区发生的插入或缺失突变,可以使小麦具有春性生长习性。目前,在VRN1基因中已发现多种等位变异类型。显性等位变异Vrn-A1a、Vrn-A1b和Vrn-D1c的突变均发生在启动子区,能够促进小麦提前抽穗和开花[12-13],显性等位变异Vrn-A1c、Vrn-B1a、Vrn-B1b、Vrn-B1c、Vrn-B1d和Vrn-D1a均是由第一内含子大片段的缺失导致小麦生长习性的改变,使小麦抽穗和开花时间提前[14-17]。目前,已在VRN-B3位点发现4种等位变异,包括隐性等位变异vrn-B3和显性等位变异Vrn-B3a、Vrn-B3b、Vrn-B3c。与隐性等位变异vrn-B3相比,显性等位变异Vrn-B3a在起始密码子上游-591 bp处有一个5 295 bp反转座子的插入,携带插入片段的转基因小麦比携带隐性vrn-B3的小麦开花时间显著提前[5];显性等位变异Vrn-B3b在5’UTR区有一个890 bp的插入序列,使小麦抽穗时间延迟[18];显性等位变异Vrn-B3c在Vrn-B3a插入片段的基础上,有20 bp和4 bp两个片段的缺失,但二者的转录水平并没有明显差异[18]。与VRN1基因的等位变异相比,VRN-B3位点发现的显性等位变异数量相对较少,因此,需要进一步挖掘春化基因的新等位变异。这些等位变异不仅可以提高小麦的遗传多样性和广泛适应性,也为下一步深入研究春化基因启动子区域的突变在小麦花期调控中的作用提供了材料。VRN-B3位点的分子标记虽然已经被开发,但仍需多次PCR检测才能区分出该位点不同等位变异类型,工作量大且过程繁琐,因此,构建高效多重PCR分子标记体系就显得尤为重要。
本课题组前期研究发现,普通小麦地方品种和尚头在VRN-B3位点扩增出的条带与目标条带大小不一致,可能为一种新的等位变异。为了明确新等位变异的分子组成特点,本研究克隆得到该变异材料VRN-B3基因全长序列,并构建多重PCR体系;同时检测微核心种质资源,以明确VRN-B3位点不同等位变异的地理分布规律;通过分析温室种植的和尚头与冬性品种京冬8号杂交后代群体的基因型和表型,揭示新等位变异对小麦抽穗期的影响,以期丰富我国小麦春化基因的遗传多样性,加快广适小麦的育种步伐。
1 材料与方法
1.1 材 料
普通小麦品种和尚头(含Vrn-A1a、Vrn-B1a、vrn-D1、Vrn-B3d)由宁夏农林科学院农作物研究所陈东升研究员提供,262份中国微核心种质资源和对照品种辽春10号(含Vrn-B3a)、短红芒麦(含Vrn-B3b)由甘肃农业科学院杨芳萍研究员提供,京411(含vrn-B3)由本实验室保存。中国春及其第7同源群缺体-四体系由中国农业科学院作物科学研究所夏先春研究员赠予,用于引物染色体定位。和尚头、京冬8号(含vrn-A1、vrn-B1、vrn-D1、vrn-B3)及其组合F2代收获于西北农林科技大学试验田,F3代用于新等位变异效应分析。
1.2 方 法
1.2.1Vrn-B3d等位变异的克隆
采用CTAB法[19]提取小麦幼嫩叶片基因组DNA。利用NCBI数据库(https://www.ncbi.nlm.nih.gov/)查找中国春VRN-B3序列(GenBank No. DQ890162),并设计扩增该基因全长的特异性引物(表1)。利用引物Vrn-B3d-2F/R、VRN4-B-NOINS-F/R和Vrn-B3d-1 600 bp-F/R,以和尚头和京冬8号的基因组DNA为模板进行PCR扩增,PCR反应体系为50 μL,其中ddH2O 18 μL,2×Phanta Max Buffer 25 μL,10 mmol·L-1dNTP Mix 1 μL,上、下游引物各 2 μL,P505高保真酶(Vazyme,南京) 1 μL,模板DNA 1 μL。PCR反应程序为:95 ℃ 3 min;95 ℃ 15 s,退火15 s(具体退火温度见表1),72 ℃延伸90 s,35个循环;72 ℃ 5 min。使用1.2%琼脂糖凝胶电泳分辨扩增产物。将PCR产物纯化回收,连接至载体pEASY-Blunt Zero Cloning Vector(全式金,北京),转化到大肠杆菌DH5α感受态细胞,挑选阳性克隆送奥科鼎盛生物科技有限公司(杨凌)进行测序。
1.2.2 基因结构分析、分子标记开发、多重PCR体系的构建及其利用
通过DNAMAN 8进行序列比对,找出新变异Vrn-B3d与VRN-B3位点已知等位变异vrn-B3(GenBank No. DQ890162)、Vrn-B3a(GenBank No. DQ890165)、Vrn-B3b(GenBank No. JN627519)和Vrn-B3c(GenBank No. JQ082311)的序列差异部分。通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测插入片段的顺式作用元件。利用Oligo 7设计特异性引物VRN-B3d-F和 VRN-B3d-R(表1),用于区分vrn-B3和Vrn-B3d序列。PCR反应体系为20 μL,其中ddH2O 8 μL,2 × ES Taq Master Mix 10 μL(康为世纪,北京),上游引物和下游引物各0.5 μL,模板DNA 1 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸5 min。使用1.5%琼脂糖凝胶电泳分辨扩增产物。
利用文献[5]和本研究开发的分子标记构建多重PCR体系,即用两条上游引物VRN4-B-INS-F、VRN-B3d-F和一条共用下游引物 VRN-B3d-R(表1),构建可同时检测出VRN-B3位点五种等位变异类型的多重PCR体系。使用此多重PCR检测262份中国微核心种质资源,可获得VRN-B3位点的基因组成类型。多重PCR的体系、程序和电泳条件与引物对VRN-B3d-F和 VRN-B3d-R相同。

表1 VRN-B3位点的克隆和多重PCR分子标记体系的引物信息
1.3 温室种植、基因型和抽穗期鉴定
2017年11月将小麦品种和尚头和京冬8号及其F2群体(组合)种植在高温长日照温室(温度为20~24 ℃,日照时长为16 h),种植材料均未经过春化处理。F2群体春化基因VRN-A1、VRN-B1和VRN-B3位点的检测参考Yan等[5,12]和Fu等[14]的引物。通过PCR检测,从F2群体中筛选出基因型组成为vrn-A1+vrn-A1+vrn-B1+vrn-B1+Vrn-B3d+vrn-B3的单株(即仅VRN-B3位点为杂合基因型而其他位点为隐性基因型)。收获其种子后,于2018年11月继续种植在温室,获得F3代单株,共计97份。小麦生长开始抽穗时,记载各个单株的抽穗期。单株主茎穗抽出叶鞘1/2时记为抽穗日期,从播种到抽穗的天数作为单株的抽穗期。
1.4 数据处理
使用SPSS 19.0对抽穗期进行显著性分析,用Excel处理和分析数据。
2 结果与分析
2.1 Vrn-B3d等位变异的序列组成
利用引物对Vrn-B3d-2F和 Vrn-B3d-2R扩增不同品种中VRN-B3基因的编码区基因组序列,在京冬8号、和尚头、中国春以及缺四体N7AT7D和N7DT7B均扩增出预测的1 397 bp条带,而N7BT7D无扩增条带,说明设计的引物位于7B染色体上(图1A)。Yan等[5]报道,VRN-B3基因也被定位在7B染色体上[5],且本研究扩增片段大小也与预期结果一致,验证了新设计引物的有效性和特异性。将获得的PCR产物进行测序,获得的序列与已知等位变异vrn-B3、Vrn-B3a、Vrn-B3b和Vrn-B3c进行序列比对,发现和尚头和京冬8号与4种已知等位变异的编码区基因组序列完全相同。
利用引物对VRN4-B-NOINS-F和VRN4-B-NOINS-R克隆不同品种中VRN-B3基因启动子区序列,该引物对位于隐性等位变异vrn-B3基因起始密码子下游17 bp至起始密码子上游 -1 125 bp序列位置。在和尚头中该引物对扩增出 1 302 bp的条带,明显比对照京冬8号和中国春扩增的条带大(图1B)。为了进一步分析启动子远上游序列,设计引物对Vrn-B3d-1 600 bp-F和 Vrn-B3d-1 600 bp-R,该对引物位于隐性等位变异vrn-B3基因起始密码子上游-941 bp至 -2 280 bp序列位置。在京冬8号、和尚头、中国春以及缺四体N7AT7D和N7DT7B均扩增出预测的 1 339 bp条带,而N7BT7D无扩增条带,表明新设计的引物定位在7B染色体上,条带大小也与预期结果一致,验证了新设计引物的有效性和特异性(图1C)。测序结果表明,使用引物对Vrn-B3d-1 600 bp-F和Vrn-B3d-1 600 bp-R在和尚头和京冬8号中扩增出的序列组成完全相同。

A:引物Vrn-B3d-2F和 Vrn-B3d-2R扩增 VRN-B3基因编码区;B:引物VRN4-B-NOINS-F和VRN4-B-NOINS-R扩增 VRN-B3基因启动子区;C:引物Vrn-B3d-1 600 bp-F和 Vrn-B3d-1 600 bp-R扩增 VRN-B3基因启动子区;M:DL2000;1:京冬8号;2:和尚头;3:中国春;4:N7AT7D;5:N7BT7D;6:N7DT7B。
从图2可以看出,在普通小麦品种和尚头VRN-B3位点发现一个新的等位变异,与隐性等位变异vrn-B3相比,新等位变异在起始密码子上游-875 bp处有一个160 bp的插入,且与已知等位变异Vrn-B3a、Vrn-B3b和Vrn-B3c都不同,将新等位变异命名为Vrn-B3d(图2)。
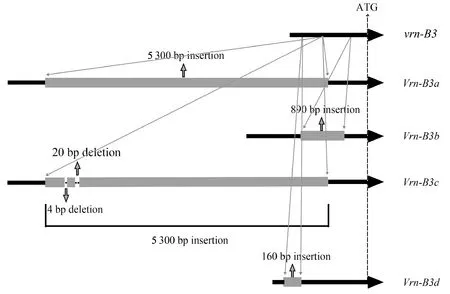
灰色图形代表插入序列,黑色线条代表启动子区序列。
为了明确Vrn-B3d启动子区160 bp插入片段中所含有的顺式作用元件,使用PlantCare在线网站进行预测,结果表明,160 bp插入片段包括3种顺式作用元件,分别为CAAT-box(提高启动子启动效率)、G-box(光响应元件)和TATA-box(基因转录的核心启动子元件)。
2.2 分子标记的开发、多重PCR的构建和应用
基于Vrn-B3d变异序列,开发设计一对引物Vrn-B3d-F和Vrn-B3d-R,用于区分vrn-B3和Vrn-B3d(表1)。利用中国春第7同源群缺体-四体系对引物特异性进行验证,发现在京冬8号(vrn-B3)以及缺四体N7AT7D和N7DT7B中均扩增出1168 bp的条带,在和尚头中扩增出 1 328 bp的条带,而N7BT7D无扩增条带,这与预期结果相同,表明设计的引物有效可行(图3)。

M:DL2000;1:京冬8号;2:和尚头;3:N7AT7D; 4:N7BT7D;5:N7DT7B。
为了提高检测效率,利用两条上游引物VRN4-B-INS-F、VRN-B3d-F和一条共用下游引物 VRN-B3d-R,构建多重PCR分子标记检测体系,即通过一次PCR可同时检测出VRN-B3位点的五种等位变异Vrn-B3a、Vrn-B3c、Vrn-B3b、Vrn-B3d和vrn-B3。从图4可以看出,4份对照品种辽春10号(Vrn-B3a)、短红芒麦(Vrn-B3b)、和尚头(Vrn-B3d)和京411(vrn-B3)扩增的条带分别为1 695、2 058、1 328和1 168 bp,条带大小与单一PCR扩增结果完全一致,说明构建的多重 PCR体系稳定可靠。

M:DL2000;1:辽春10号;2:短红芒麦;3:和尚头;4:京411。
利用此多重PCR分子标记体系,检测262份中国微核心种质资源春化基因VRN-B3位点,发现甘麦8号等245份材料扩增出1 168 bp的特异性条带,说明这些材料携带隐性等位变异vrn-B3,占93.5%;葛尔红麦等15份材料扩增出2 058 bp的特异性条带,说明这些材料携带显性等位变异Vrn-B3b,占5.7%;春麦和红冬麦2份材料扩增出1 328 bp的特异性条带,说明这2份材料携带新等位变异Vrn-B3d,占0.8%;微核心种质中未检测到携带Vrn-B3a和Vrn-B3c两种显性等位变异的材料。
2.3 新等位变异 Vrn-B3d对小麦抽穗期的影响

3 讨 论
VRN3基因在小麦开花过程中起重要作用,VRN3蛋白可以从叶片转移到茎尖分生组织,使茎尖处的VRN1基因表达量上调,促进小麦由营养生长向生殖生长的转变[5]。本研究在和尚头VRN-B3位点发现一个新的等位变异Vrn-B3d,测序结果表明,新变异在启动子区有160 bp的插入片段。前人研究表明,VRN-B3位点的结构变异主要发生在启动子区,影响小麦抽穗和开花的时间[5,18]。Zhang等[13]认为启动子区顺式作用元件种类和数量的增加是基因表达量上调的主要原因,从而促进小麦提前开花。Yan等[5]研究表明,Vrn-B3a在启动子区插入一个大片段的反转座子后,能使小麦抽穗和开花时间显著提前。Chen等[18]研究表明,显性等位变异Vrn-B3b在启动子区插入890 bp的片段后,小麦抽穗和开花时间显著延迟。本研究中新等位变异Vrn-B3d在启动子区有160 bp的插入片段,可以使小麦延迟2 d抽穗,与Vrn-B3b延迟效应的趋势一致,但可能因为Vrn-B3d中插入的160 bp片段较短,仅增加了三种普通的顺式作用元件CAAT-box、G-box和TATA-box,对基因的调控作用没有达到阈值[20],因此对小麦抽穗期延迟作用不显著。另外,拟南芥中调控开花的FT基因在其他发育过程如植株坐果、营养生长、气孔开放都有一定的作用[21],而VRN-B3作为FT的同源基因,相应方面的功能有待进一步研究。
分子标记具有稳定、效率高及成本低等优点,现已成为育种工作者优先选择的遗传标记。近些年来,分子标记发展迅速,为发掘小麦材料中春化基因的变异位点提供了可能性。本试验根据Vrn-B3d基因的序列特点,开发了检测新等位变异Vrn-B3d的分子标记。同时,根据VRN-B3位点目前已知的等位变异序列组成,构建多重PCR分子标记检测体系,共用下游引物 VRN-B3d-R位于起始密码子上游53 bp处,上游引物VRN4-B-INS-F位于Vrn-B3a和Vrn-B3c插入片段中,另一条上游引物 Vrn-B3d-F位于vrn-B3、Vrn-B3b和Vrn-B3d共有序列区域内,此多重体系可同时检测出VRN-B3位点的五种等位变异,能够进一步提高检测效率及发现新等位变异的几率。分子标记辅助育种技术现已被广泛应用,多重PCR体系能够快速、高效地筛选出目的基因,加快小麦选育进程。
环境差异地区的小麦品种具有不同的春化基因组成类型,以适应当地的气候环境和耕作条件[22-23]。利用本研究开发的多重PCR体系检测262份核心种质资源,初步明确了VRN-B3基因在全国小麦资源的分布规律。检测结果表明,在全国范围内VRN-B3基因主要以隐性等位变异vrn-B3(93.5%)为主,与Zhang等[24]的研究结果一致;未在核心种质材料中发现携带Vrn-B3a和Vrn-B3c的品种,说明含这两种基因型的品种在我国小麦种质资源中占比极少。携带Vrn-B3b的15份核心种质分布在河北、河南和陕西等地,这与Chen等[18]的研究结果相同,同时本研究在宁夏和西藏的品种中也发现Vrn-B3b的存在,可为这些地区的引种和育种提供理论依据。在两个新疆品种中发现了新等位变异Vrn-B3d。新疆地区春季气温偏低,且温度波动幅度较大,小麦容易因冻害而减产。本研究发现的新变异能在一定程度上延迟小麦抽穗,说明Vrn-B3d对低温环境不敏感,携带新变异Vrn-B3d的品种需要较长时间的低温处理才能抽穗,能够避免冻害,从而更好适应新疆地区的气候,对提高小麦产量有积极作用。
