贝莱斯芽孢杆菌MT310生防机制初探
2020-01-03余水丁海霞罗玉英程欢欢姚伟伟彭丽娟
余水 丁海霞 罗玉英 程欢欢 姚伟伟 彭丽娟


摘 要:为探究贝莱斯芽孢杆菌(Bacillus velezensis)MT310的生防机制,为该菌田间防病试验提供依据,本文采用平板对峙、二分格平板和指示培养基等3种方法对其抑菌谱、挥发性物质及促生机制进行了检测。结果表明,MT310对烟草赤星病菌(Alternaria alternata)、黄连根腐病菌(Fusarium sp.)、石榴干腐病菌(Phomopsis sp.)、高粱叶斑病菌(Phyllosticta sorghina)和高粱炭疽病菌(Colletotrichum graminicola)5种植物病原真菌有明显抑制效果,对烟草赤星病菌抑制效果最佳,抑制率为68.76 %;其产生的挥发性物质(Volatile organic compounds, VOCs)对上述5种植物病原真菌也有抑制效果,对烟草赤星病菌抑制效果最好,抑制率为49.96 %。VOCs对烤烟幼苗的叶长、叶宽、株高和根长有明显的抑制作用,对烟苗根生长抑制效果最明显,相对抑制率为94.44 %。此外,MT310可产生嗜铁素、磷酸酯酶,具有较强的运动能力,可产生复杂的生物膜结构。该结果对菌株MT310合理、安全地运用到大田生产具有一定指导意义。
关键词:贝莱斯芽孢杆菌;抑菌效果;挥发性物质
Abstract:In order to explore the biocontrol mechanism of Bacillus velezensis MT310 and provide the basis for its field disease control test, the antibacterial spectrum, volatile substances and growth-promoting mechanism of B. velezensis MT310 were detected by three methods such as plate confrontation, dichotomy plate and indicator medium. The results showed that MT310 had obvious inhibitory effect on five kinds of plant pathogenic fungi, including, Alternaria alternata, Fusarium sp., Phomopsis sp., Phyllosticta sorghina and Colletotrichum graminicola. MT310 had the best inhibitory effect on A. alternata, with an inhibition rate of 68.76%. The volatile organic compounds (VOCs) produced by MT310 also had inhibitory effect on the above five plant pathogenic fungi, and also had the best inhibitory effect on A. alternata, with the inhibition rate of 49.96%. VOCs could significantly inhibit the leaf length, leaf width, plant height and root length of tobacco seedlings, and the most obvious inhibitory effect on tobacco seedling was found on root growth, with the relative inhibition rate of 94.44%. In addition, MT310 could generate siderophore and phosphatase, which had strong movement ability and could produce complex biomembrane structure. The results have certain guiding significance for the reasonable and safe application of strain MT310 to field production.
Keywords:Bacillus velezensis;antimicrobial activity;volatile organic compounds
貝莱斯芽孢杆菌(Bacillus velezensis)MT310是从贵州省遵义市植烟区烤烟根围土壤中分离的有益生防菌株,在2018年田间试验作为生防菌剂施用对烟草黑胫病田间防效高达70.1%[1],是一株极具应用效果的生防芽孢杆菌。芽孢杆菌生防机制多样,其首要的作用条件是定殖于植物根部或根部环境中,从而发挥生防效用[2-3]。拮抗效果是其抗菌防病的重要机制之一[4-5],芽孢杆菌能产生的拮抗物质主要包括抗生素、细胞壁降解酶类以及挥发性物质(Volatile organic compounds,VOCs)等,能够直接或间接地作用于病原菌[4]。例如,马冠华[6]研究发现,烟草内生细菌Itb57对烟草黑胫病菌(Phytophthora nicotianae)等多种植物病原真菌均具有良好的拮抗效果,且还具有促进种子萌发的功效;陈海英等[7]发现多粘类芽孢杆菌(Paenibacillus polymyxa)CP7对多种植物病原细菌具有抑菌活性;郑香香等[8]发现芽孢杆菌的挥发性物质能够显著抑制链格孢菌(Alternaria alternata)菌落生长。因为生防产品作用机理是其应用效果稳定的主要原因[9]。因此,本研究通过MT310抑菌谱检测,挥发性物质作用和生防相关酶类检测等进一步明确其生防机制,为提高MT310田间生防效果以及生防制剂的研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
烟草赤星病菌(A.alternata)、黄连根腐病菌(Fusarium sp.)、石榴干腐病菌(Phomopsis sp.)、高粱叶斑病菌(Phyllosticta sorghina)和高粱炭疽病菌(Colletotrichum graminicola)和贝莱斯芽孢杆菌(B.velezensis)MT310均由贵州大学农学院植物病理教研室提供。
1.1.2 供试烤烟
选用贵州烤烟繁育中心生产的K326包衣种。包衣种用无菌水清洗去除外种子外部包衣,75%乙醇溶液灭菌1min,40%NaClO浸泡20min,再用无菌水清洗离心3次,于超净工作台上吹干种子备用。
1.1.3 培养基
LB固体培养基用于芽孢杆菌培养,LB液体培养基用于生物膜测定;PDA培养基用于植物病原真菌培养及对峙试验;LB半固体培养基(0.8%琼脂)用于芽孢杆菌运动性检测;MS培养基用于烤烟种子培养;磷酸脂酶检测培养基、嗜铁素检测培养基、葡聚糖酶检测培养基[10]用于检测芽孢杆菌是否产生嗜铁素、磷酸酯酶、葡聚糖酶。
1.2 方法
1.2.1 抑菌谱测定
参考周霄等[11]的对峙试验稍作改动,测定贝莱斯芽孢杆菌(B.velezensis)MT310对烟草赤星病菌(A. alternata)、黄连根腐病菌(Fusarium sp.)、石榴干腐病菌(Phomopsis sp.)、高粱叶斑病菌(P. sorghina)和高粱炭疽病菌(C. graminicola)等5種植物病原真菌的拮抗效果。采用十字交叉法[10]测量菌落直径,使用DPS数据处理系统Duncan新复极差法对其抑制率数据进行分析。
抑菌率(%)=(对照组菌落直径-处理组菌落直径)/(对照菌落直径-菌饼直径)×100
1.2.2 挥发性物质抑菌谱检测
采用二分格平板法[10],使用90mm的二分隔培养皿测定MT310挥发性物质对5种病原菌的抑制效果。在第二分隔培养皿一侧加入10mLPDA培养基,用于培养植物病原真菌;另一侧加入10mLLB培养基,用于培养MT310,以一侧不培养MT310,另一侧培养值物病原真菌为对照[8-9]。培养皿外用Parafilm 封口膜封住,隔断皿内外空气的流通。每处理5个重复,密封后于28℃,黑暗条件下倒置培养,7d后观察病原真菌的生长状况。数据收集和处理方法同1.2.1。
1.2.3 生防相关酶类及运动性测定
接种MT310于LB液体培养基中,于37℃、200r/min黑暗条件下匀速震荡12h,再10000r/min离心4min弃上消度,收集菌体,加入100μL无菌水制备成菌体悬浮液备用;滴加2 μL菌液于磷酸酯酶检测培养基、嗜铁素检测培养基和葡聚糖酶检测培养基中央处,封口膜密封于37℃黑暗条件下培养7d,观察培养基上是否出现消解圈;滴加2μL菌液于LB培养基(0.8%琼脂)中央处,封口膜密封,于黑暗条件下培养12h,观察MT310的运动状况。挑取单菌落接入3mLLB液体培养基于 30℃、180r/min恒温振荡培养12h,菌液离心,弃上清液,菌体按原始体积的1/100 接种到盛有2mLLB液体培养基的12孔板中,平缓移至水平桌面上静置, 室温培养, 每处理3个重复,每12h观察一次生物膜的形成情况。
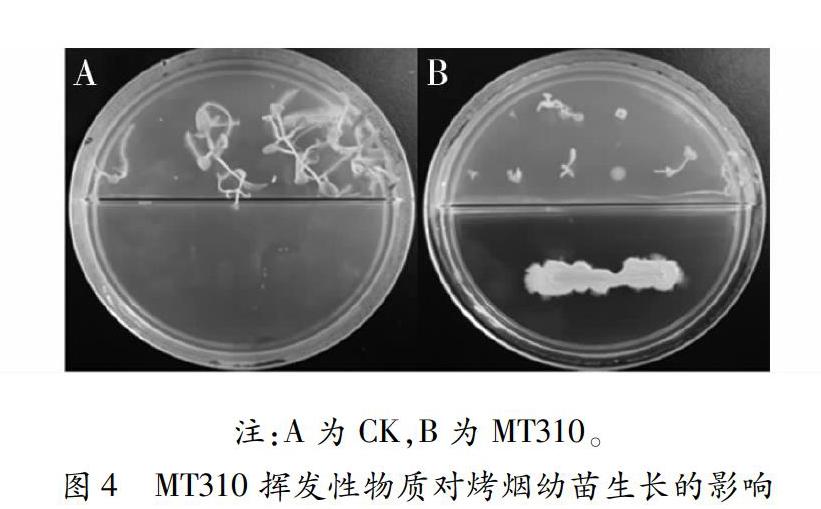
1.2.4 挥发性物质对烤烟幼苗生长的影响
试验设2个处理,每处理5个重复;使用90mm直径的二分格培养皿测定芽孢杆菌MT310对烤烟幼苗生长的影响。在二分格两侧均加入MS固态培养基10mL,培养皿一侧培养芽孢杆菌(芽孢杆菌划线长度40mm),另一侧培养10粒烤烟种子,参照文献[12]对烤烟种子进行培养;以一侧只培养烤烟种子,另一侧不培养芽孢杆菌的处理为对照(CK)。培养皿用Parafilm封口膜密封,于25℃光照12h,20℃条件下暗处理培养15d,测量烟苗的农艺性状,参考 YC/T142-2010《烟草农艺性状调查测量方法》稍作改动后13d侧量。
2 结果与分析
2.1 菌株MT310抑菌谱测定
MT310对烟草赤星病菌(A.alternata)、黄连根腐病菌(Fusarium sp.)、石榴干腐病菌(Phomopsissp.)、高粱叶斑病菌(P. sorghina)和高粱炭疽病菌(C. graminicola)等5种植物病原真菌均具有明显的抑制效果(图1),抑菌率分别为68.76%、57.57%、44.64%、35.56%和42.25%(表1)。其中,对烟草赤星病菌(A. alternata)的抑制率最高。
2.2 挥发性物质抑菌谱检测
MT310产生的挥发性物质(VOCs)对烟草赤星病菌(A. alternata)、黄连根腐病菌(Fusarium sp.)、石榴干腐病菌(Phomopsis sp.)、高粱叶斑病菌(P. sorghina)和高粱炭疽病菌(C. graminicola)等5种植物病原真菌均有一定抑制作用(图2),抑菌率分别为49.96 %、18.79 %、10.32 %、35.93 %和32.94 %(表2)。其中,对烟草赤星病菌(A. alternata)的抑制率最高。
2.3 生防机制及运动性
菌株MT310在LB培养基(0.8% 琼脂)上培养12h即可长至全皿,还可在72h内形成复杂的生物膜,表明该菌株具有较好的运动与定殖能力。平板检测发现,在嗜铁素和磷酸酯酶检测平板上产生透明圈,表明MT310可产生嗜铁素和磷酸酯酶等生防相关酶;但MT310不能使葡聚糖酶检测培养基出现消解圈,说明其不产生葡聚糖酶(图3)。
2.4 挥发性物质对烤烟幼苗生长的影响
从图4可知,MT310挥发性物质对烤烟种子及幼苗生长有一定的影响。其平均叶长、叶宽、株高和根长分别为0.17cm、0.23cm、0.53cm和0.10cm与CK(0.53cm、0.50cm、0.73cm和1.7cm)相比较,相对抑制率为67.92%、54.00%、27.40%和94.12%。由上可知,MT310对烤烟幼苗生长有一定抑制作用,其中对根生长抑制作用最明显,相对抑制率为94.12%。
3 结论及讨论
本研究表明MT310及其挥发性物质(VOCs)对烟草赤星病菌(A.alternata)、黄连根腐病菌(Fusarium sp.)、石榴干腐病菌(Phomopsis sp.)、高粱叶斑病菌(P.sorghina)和高粱炭疽病菌(C.graminicola)等5种植物病原真菌具明显抑制作用,其中菌株MT310与其挥发性物质,对烟草赤星病菌(A.alternata)的抑菌效果最佳,抑制率分别为68.76%和49.96 %。说明该菌株有多种方式对植物病原真菌产生抑制作用。试验结果表明,MT310对烤烟幼苗生长有一定抑制作用,且对根生长抑制作用最显著。此外,MT310能够产生嗜铁素和磷酸酯酶等生防相关酶类物质,并具备良好的运动和形成复杂生物膜结构的能力,说明贝莱斯芽孢杆菌(B.velezenss)是一株田间表现良好具有生防潜力的菌株。
生防菌株能够有效发挥拮抗作用,定殖能力是主要条件,为保证生防菌能在植物根围或叶围等环境中生长繁殖,生防菌的定殖能力与运动性和生物膜形成密切相关[13-15]。在生防菌定殖成功后,菌株可以通過空间竞争、拮抗作用、诱导植物产生抗性和促生等机制,达到防治病害的目的[16-19]。结合前期研究[1]和实验表明,MT310具有定殖烤烟根部的潜力,是其发挥生防作用的主要条件之一。
据报道,枯草芽孢杆菌(Bacillus subtilis)RSS-55对油菜菌核病菌(Sclerotinia sclerotiorum)有极强的抑制效果,抑制率高达93.33% [20]。研究发现,解淀粉芽孢杆菌NCPSJ7对9株植物病原真菌均具有良好的拮抗效果[21]。此外,芽孢杆菌的挥发性物质对病原菌同样具有抑制作用;解淀粉芽胞杆菌(B.amyloliquefaciens) XJ5的挥发性物质对苹果褐腐病菌(Monilinia fructigena)等多种植物病原真菌具有很好的抑制效果[22];冯福山等[23]通过固相微萃取(HS-SPME)收集枯草芽胞杆菌(B.subtilis)Y13的挥发性气体,与10种植物病原真菌进行对峙,发现均具有很好的抑制效果,其中对果生炭疽菌(Colletotrichum fructicola)抑制效果最佳,值为83.90%。MT310及其挥发性物质同样能抑制多种植物病原真菌的生长,且对烟草赤星病菌(A. alternata)的抑制效果最明显,说明MT310具有生防潜力,是一株值得开发的生防芽孢杆菌。
芽孢杆菌可以分泌出磷酸脂酶和嗜铁素等物质从而分解土壤中的难溶性磷和固态铁,使难溶性元素,降解成可供植物直接吸收利用的离子,促进植物生长,同时还可改变土壤中病原菌生长环境,从而达到抑制病原菌生长的作用;并且有些芽孢杆菌的挥发性物质还可促进植物生长发育[24-26]。MT310可以产生嗜铁素及磷酸酯酶等生防相关类酶类,这表明MT310能够对土壤中的真菌病害的营养环境产生影响,从而抑制病原真菌的生长。室内试验表明,MT310挥发性物质抑制烤烟K326幼苗生长,而同样从烤烟根围分离的另一株芽孢杆菌MT323却能促进K326幼苗生长[27]。两株芽孢杆菌所产生的挥发性物质有何异同,值得进一步深入研究。MT310作为生防制剂在大田防治病害时,应进一步观察其对烟株生长的影响,达到既不影响烟株生长,又可防治病害的目的。
参 考 文 献:
[1] 罗玉英,彭丽娟,丁继林,等.烟草黑胫病生防芽孢杆菌的筛选及其田间防效[J].贵州农业科学, 2019, 47(1): 59-64.
[2] 郭庆港,王培培,董丽红,等. PhoR/PhoP双组分系统对枯草芽胞杆菌NCD-2菌落形态和芽胞形成的影响[J].植物病理学报,2019,49(4): 552-559.
[3] LIU Y,ZHANG N,QIU M,et al. Enhanced rhizosphere colonization of beneficial Bacillus amyloliquefaciens SQR9 by pathogen infection[J].FEMS microbiology letters,2014,353(1): 49-56.
[4] 陈中义,张杰,黄大昉.植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J].植物病理学报,2003,33(2): 97-103.
[5] CHOWDHURY S P, HARTMANN A, GAO X, et al. Biocontrol mechanism by root-associated Bacillus amyloliquefaciens FZB42 – a review[J].Frontiers in microbiology,2015,6:780.
[6] 马冠华. 烟草内生细菌Itb57生物学性状及其对黑胫病的控制研究[D].重庆:西南大学,2011.
[7] 陈海英, 林健荣, 宋家清, 等. CP7菌株的抗菌活性及菌种鉴定[J].中国生物防治, 2007, 23:16-21.
[8] 郑香香,张娜,阎瑞香,等. 不同芽孢杆菌对极早熟桃采后链格孢菌的防治效果及其发酵液挥发性物质成分分析[J].食品工业科技,2019,40(14):144-150,156.
[9] 邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护,2010, 36(4): 15-18.
[10] 方中达. 植病研究方法[M].3版.北京:中国农业出版社, 2007.
[11] 周霄,申小叶,侯成林.一株毛竹根部内生细菌SHEN20121的鉴定及其对植物病原真菌的抑制作用[J].安徽农业大学学报,2013,40(5):828-832.
[12] 龚一富.植物组织培养实验指导[M].北京:科学出版社, 2011.
[13] RYU C M, FARAG M A, HU C H,et al. Bacterial volatiles promote growth in Arabidopsis[J].Proceedings of the nationdl acadamy of sciences of the united states of America,2003, 100(15): 4927-4932.
[14] WENG J, WANG Y, LI J, et al. Enhanced root colonization and biocontrol activity of Bacillus amyloliquefaciens SQR9 by abrB gene disruption[J].Applied microbiology and biotechnology, 2013, 97(19): 8823-8830.
[15] 陈欣怡.苹果轮纹病生防解淀粉芽胞杆菌(Bacillus amyloliquefaciens)PG12主要生防机制研究[D].北京:中国农业大学, 2016.
[16] 朱伟光,李德葆,葛起新,等.植物病原细菌拮抗菌及其物质测定—Bacillus cereus G35的产素特性与质粒关系[J].浙江农业大学学报, 1990, 16 (4) :345-350.
[17] 曹君,高智谋,潘月敏,等.枯草芽孢杆菌BS菌株和哈茨木霉TH-1菌株对面糊枯黄萎病的拮抗作用[J].植物病理学报, 2005, 36 (6) :170-172.
[18] 刘永红,游春平.溴甲烷土壤熏蒸处理、植物促生菌对大田黄瓜病害的生物防治作用[J].江西植保, 2001, 24 (3) :94-97.
[19] HAN T, YOU C, ZHANG L, et al. Biocontrol potential of antagonist Bacillus subtilis Tpb55 against tobacco black shank[J].Biocontrol, 2016, 61 (2) :195-205.
[20] 郭洁心,张育铭,朱洪磊,等. 解淀粉芽胞杆菌XJ5挥发性物質抑菌活性及对苹果褐腐病防效测定[J].中国生物防治学报,2010,36(4):575-580.
[21] 彭研,陈蕾蕾,裘纪莹,等. 产广谱抗菌物质芽孢杆菌的筛选与鉴定[J].中国农学通报,2013,29(36):372-377.
[22] 代玉立. 枯草芽孢杆菌菌株RSS-1对油菜菌核病菌的生防作用及其机制研究[D].合肥:安徽农业大学,2015.
[23] 冯福山,刘君昂,胡廉成,等. 枯草芽胞杆菌Y13挥发性物质的分析及抑菌活性[J].中国生物防治学报,2019,35(4):597-604.
[24] ROBERT RC, MIRELLE CW. Iron transport and storage[J].European journal of biochemistry, 1987, 164:485-506.
[25] CROWLEY D E, WANG Y C, REID C P P, et al. Mechanism of iron acquisition from siderophores by microorganisms and plants[J].Plant and soil, 1991, 130:179-198.
[26] 高振峰. 内生细菌ZSY-1对番茄灰霉病和早疫病的防治及促生效果研究[D].晋中:山西农业大学,2018.
[27] 余水,丁海霞,罗玉英,等.解淀粉芽孢杆菌MT323生防机制初探[J].贵州农业科学,2020,48(1):59-62.
