百脉根Hsp70
2020-01-03杨芳杨仕梅罗雪吴佳海宋莉
杨芳 杨仕梅 罗雪 吴佳海 宋莉

摘 要:热激蛋白(HSPs)是细胞受逆境诱导产生的一类具有稳定蛋白质结构、修复变性蛋白和维护生物膜稳定等功能的分子伴侣,同时,在缓解植物高温伤害和提高热耐受性等方面有重要的调控作用。根据百脉根基因组数据,利用生物信息学方法对百脉根Hsp70基因(LjHsp70s)家族的基因结构、染色体分布、选择压力、顺式作用元件、表达特性和系统进化等进行分析。结果表明,LjHsp70s家族有18个成员,分为4类,它们的内含子和外显子数量为1~8,含有多个保守基序,分布在6条染色体上,编码602~703个氨基酸,均编码酸性亲水蛋白;含有激素、光照及胁迫等响应顺式作用元件,LjHsp70s在百脉根的根、茎、叶等部位均有表达,但其表达量不同;该家族基因在进化过程中主要受负选择作用,进化上较为保守,家族成员与拟南芥和烟草的Hsp70基因可分为6组,但是百脉根LjHsp70s基因仅存在于4个亚族中,表明其与拟南芥、烟草的Hsp70s基因家族成员之间进化关系密切,同时也存在一定差异。LjHsp70s基因在百脉根的各个部位均有表达,对百脉根生长发育过程起着重要的作用,研究结果为解析百脉根LjHsp70s基因功能提供了依据。
关键词:百脉根;LiHsp70s基因结构;热激蛋白;生物信息学;功能预测
HSPs has important regulatory effects on relieving high temperature damage to plants and improving heat tolerance. Based on the genomic data of the Lotus japonicus,the bioinformatics method were employed to analyze the gene structure,chromosome distribution,selection pressure,cis-acting elements,expression characteristics and phylogenetic evolution of the Hsp70 gene (LjHsp70s) family. The results showed that the LjHsp70s family had 18 members,which were divided into 4 categories. Their introns and exons ranged from 1 to 8. They contained multiple conserved motifs,distributed on 6 chromosomes,encoded 602~703 amino acids,and all encoded acidic hydrophilic proteins. They contained cis-acting elements such as hormones,light and stress,and LjHsp70s were expressed in roots,stems,leaves,and other parts of the roots,but their expression levels were different. This family of genes were mainly negatively selected during evolution process and were conservative in evolution. The Hsp70 genes of the family members and Arabidopsis and tobacco can be divided into 6 groups,but the LjHsp70s gene was only present in 4 subfamilies,it indicated that it had close evolution relationship with the members of the Hsp70s gene family of Arabidopsis thaliana and tobacco,but there were also some differences. The LjHsp70s gene was expressed in all parts of L. japonicus and played an important role in the growth and development of L. japonicus. The results provide a basis for the analysis of the function of LjHsp70s gene.
Keywords:Lotus japonicus; LjHsp70s gene structure; heat shock protein; bioinformatics; function prediction
热激蛋白(Heat shock proteins,HSPs)广泛存在于动物、植物和微生物细胞中,在分子进化上高度保守,不但参与生物体的正常生理代谢过程,还为高温等逆境诱导细胞产生分子伴侣,对蛋白质结构稳定、变性蛋白修复和生物膜稳定等起到重要调节作用[1]。按分子量大小可将HSPs分为HSP100、HSP90、HSP70、HSP60和小热激蛋白五大家族类型。其中,HSP70家族是保守性最高、分布最广的一类热激蛋白[2]。
HSPs与逆境胁迫响应相关,细胞受环境胁迫诱导时会大量产生HSPs,其在减轻逆境因子伤害的同时完成对植物体的修复[3-4]。研究发现,高温、干旱、高盐、高寒、化学物质和激素等多种环境因子均能诱导植物Hsp70表达而增强抗逆性[5];如腊梅CpHsp70-1基因表达受高温和低温诱导,从而增强植株响应敏感性[6]。高温胁迫初期,花楸樹通过SpHsp70-1基因过表达实现对功能蛋白、结构蛋白及膜蛋白的保护作用,避免高温胁迫伤害[7]。
百脉根(Lotus japonicus)又名五叶草、牛角花,是世界上广泛栽培的多年生豆科牧草之一,具有营养丰富、抗旱耐寒、适口性好、采食率高等优点,是一种优质牧草及水土保持植物。随着地球“温室效应”的加剧,高温胁迫对植物生长发育的影响日益受到重视,Hsp70家族作为抗高温等逆境胁迫的主要分子伴侣之一,在植物的生长发育及抵抗逆境胁迫过程中起着重要的作用,所以对Hsp70基因功能的研究也越来越受人们的关注[8]。目前已从芝麻、向日葵、玉米、烟草等植物中鉴定出Hsp70s基因,然而关于百脉根中LjHsp70基因的信息还未见报道。本文通过百脉根全基因组序列分析对LjHsp70s基因家族进行鉴定,旨在为进一步分析其功能提供理论依据。
1 材料与方法
1.1 材料来源
1.2 LjHsp70s基因家族成员筛选
利用来自Pfam数据库的隐马尔科夫模型对百脉根全基因组数据库进行比对,使用Hmmsearch软件筛选符合模型的所有百脉根蛋白序列。使用 Pfam(http://pfam.xfam.org/)在線工具(参数默认)除去无LjHsp70典型结构域的序列,筛选百脉根LjHsp70s基因家族蛋白序列。
1.3 系统进化分析
将检索得到的百脉根、拟南芥和烟草的Hsp70蛋白序列通过软件 Clustal X[9]进行Hsp70蛋白序列比对,然后利用MEGA 7.0 [10]软件构建NJ(Neighbor-joining)系统发育树,Bootstrap值设置为1000,其他参数为系统默认值;使用FigTree(http://tree.bio.ed.ac.uk/software/figtree/)软件展示系统发育树。
1.4 结构特征和染色体定位分析
利用在线工具GSDS(http://gsds.cbi.pku.edu.cn/)对LjHsp70s家族成员进行基因结构分析,从百脉根数据库获取LjHsp70s基因在染色体上的位置信息,并用在线工具MG2C制作染色体定位图。
1.5 Hsp70蛋白的理化性质及结构分析
利用 ExPASy中的ProtParam [11]软件对LjHsp70s蛋白的理化性质进行分析,主要包括蛋白质大小、相对分子质量、理论等电点、不稳定系数、信号肽和亚细胞定位等指标。利用软件SOPMA [12]对LjHsp70s蛋白的二级结构进行分析。
1.6 基因选择压力分析
利用Blast建库比对和 KaKs_Calculator[13] 工具,对百脉根LjHsp70s基因核苷酸的同义替换率(Ks)和非同义替换率(Ka)进行计算,获得基因Ka/Ks比率,进行选择压力分析。
1.7 基因顺式作用元件分析
利用工具 bedtools[14]获得LjHsp70s基因上游2000 bp序列,利用在线网站 PlantCARE[15]对获得的序列进行预测,并对主要的顺式作用元件进行探究。
1.8 基因表达特性分析
为探究LjHsp70s基因在百脉根中的表达情况,从百脉根芯片数据库下载百脉根在不同组织中基因表达数据,选取花、根、茎等5个组织的基因表达数据,利用TBtools (https://www.biorxiv.org/content/early)进行作图分析。
2 结果与分析
2.1 百脉根LjHsp70s基因家族成员与进化
利用来自Pfam数据库的隐马尔科夫模型(登录号:PF00012)同百脉根基因组数据库比对,得到112条序列。根据Hsp70s家族蛋白分子量范围为66~78 kDa[16],去掉不满足条件的序列,最终筛选得到18条
LjHsp70s家族成员蛋白序列。为进一步了解LjHsp70s家族基因的进化特性,将百脉根(18条)与模式植物拟南芥(18条)和烟草(60条)的96条Hsp70s蛋白序列构建NJ系统发育树(图1)。结果表明,96条Hsp70s基因共分为6个亚族,百脉根LjHsp70s仅存在于Ⅰ、Ⅱ、Ⅲ和Ⅴ四个亚族中,其中,Ⅰ类最多,包含了14个家族成员,其亚细胞均定位于细胞质上;Ⅱ类有2个成员,亚细胞定位于细胞质和线粒体;Ⅲ、Ⅳ类最少,仅各包含了1个成员,亚细胞分别定位于细胞核、内质网,这种分布位置的差异性表明LjHsp70s不同成员之间存在着多样性。然而,百脉根LjHsp70s家族成员在Ⅳ和Ⅵ类群中的缺失,表明其与拟南芥和烟草Hsp70s基因家族成员在分布和进化上存在一定差异,这可能和百脉根属于豆科植物有关。研究发现,系统发育树进化枝尖端较短的枝节表明,聚类的植物Hsp70s家族成员的氨基酸保守性较强,各家族成员间进化关系较密切。在I组进化群体中,8条LjHsp70s聚成一个独立的亚群,推测在豆科植物中,可能会在I类中形成一个亚类。
2.2 基因结构和保守结构域分析
运用在线网站GSDS对18条LjHsp70s基因进行结构分析,结果表明,百脉根LjHsp70s基因各成员之间外显子和内含子数量不同,均分布于1~8之间。在18条LjHsp70s基因家族成员中,LjHsp70-15的内含子和外显子数目最多,均为8个;数目最少的是LjHsp70-17,仅有1个内含子和外显子。此外,LjHsp70-2、LjHsp70-3、LjHsp70-5、LjHsp70-8、LjHsp70-9、LjHsp70-10和LjHsp70-11等7条基因具有1个内含子和2个外显子,其中,LjHsp70-1注释到3和5非翻译区(UTR)。
利用MEME在线工具对LjHsp70s基因家族的蛋白序列进行分析(图3),根据其保守性的强弱,依次命名为motif1~motif10。除去LjHsp70-11和LjHsp70-18缺失motif9,LjHsp70-16缺失motif5和motif7以外,其他家族成员均分布着10条motif结构,说明它们可能具有相似的功能。
2.3 基因的染色体定位
为充分了解百脉根LjHsp70s基因家族的组成和分布形式,根据其在染色体上的定位信息,制作染色体分布图(图4),以 Chr0 代表对所有不能定位到染色体的基因所虚构的一条染色体[17]。百脉根LjHsp70s基因家族18个成员分布于6条染色体内,在染色体中分布的位置有所不同,大多数分布于染色体的两端;其中每条染色体中的LjHsp70s基因个数有所差异,1号染体上分布最多,含有7个家族成员,并且LjHsp70-5、LjHsp70-6、LjHsp70-7、LjHsp70-8四个基因以串联重复出现;6号染色体上含有3个家族成员,4号染色体上含有2个家族成员,2号和3号染色体上分布最少,仅有1个基因家族成员,将4个不能确定位置的成员归纳于Chr0染色体上。
2.4 蛋白的理化特性分析
对百脉根LjHsp70基因家族蛋白特征进行分析(表1),结果表明LjHsp70编码蛋白的理化性质存在较大差异;在组成蛋白长度的氨基酸数量上,最大为703aa(LjHsp70-11),最小为602aa(LjHsp70-17);蛋白分子质量也存在一定的差异,从67.66(LjHsp70-17)~75.93(LjHsp70-7)不等。除了LjHsp70-5、LjHsp70-6.1和LjHsp70-9以外,LjHsp70編码蛋白的等电点位均小于8,表明大多数LjHsp70基因家族可能编码弱酸性蛋白,在酸性亚细胞环境中发挥作用。在18条LjHsp70蛋白中,总平均亲水性(GRAVY)均为负值,表明LjHsp70基因家族编码蛋白均为亲水性蛋白,其中以LjHsp70-15最大,为-0.457;LjHsp70-2最小,为-0.193。不稳定指数介于28.22(LjHsp70-15)~40.82(LjHsp70-16)之间,为不稳定蛋白。亚细胞定位表明,百脉根Hsp70 蛋白主要定位于细胞质中,其家族成员数量为15 个;另外3 个成员分别定位于内质网、细胞核、线粒体。
对LjHsp70s基因编码蛋白的二级结构预测结果表明(表2),在18条LjHsp70基因家族成员中,主要包括α-螺旋、无规则卷曲和延伸链三种。其中LjHsp70蛋白的α-螺旋和无规则卷曲比例最高,分别为37.23%~41.96%、37.97%~44.58%;其次是延伸链,为15.06%~21.1%。
2.5 选择压力分析
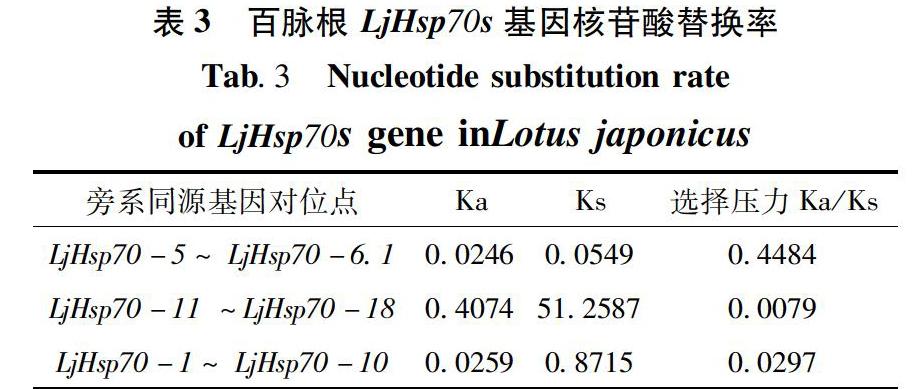
利用非同义替换(Ka)和同义替换(Ks)的比值反映选择压力是否作用于氨基酸的各位点上。对来源于LjHsp70s基因家族间亲缘关系最近的6个基因成员进行 Ka/Ks 分析(表3),结果显示该基因对之间的 Ka/Ks 比值均小于1,表明百脉根Hsp70s基因家族在进化时主要受负选择作用[18]。
2.6 顺式作用元件分析
为预测百脉根LjHsp70s基因顺式作用元件,通过提取基因上游2000 bp序列进行分析。结果显示,百脉根LjHsp70s基因家族除了最基本的CAAT-box外,还包括大量其他顺式作用元件,主要包括参与赤霉素反应性顺式作用元件TATC-box和P-box、低温响应顺式作用元件LTR、昼夜节律调控顺式作用调控元件circadian、细胞周期调控顺式作用元件MSA-like、防御和压力反应顺式作用元件TC-rich repeats、分生组织表达顺式作用调控元件CAT-box、胚乳表达顺式调控元件GCN4_motif、脱落酸反应顺式作用元件ABRE、生长素响应顺式作用元件TGA-element以及光响应顺式作用元件G-box、AE-box和TCCC-motif等(图5)。分析表明,百脉根LjHsp70s基因启动子包括大量与激素响应、光响应、胁迫响应、生长发育相关的顺式作用元件,并且这些顺式作用元件广泛参与百脉根的生长发育过程,对植物的生长起着促进和保护作用。
2.7 表达特性分析
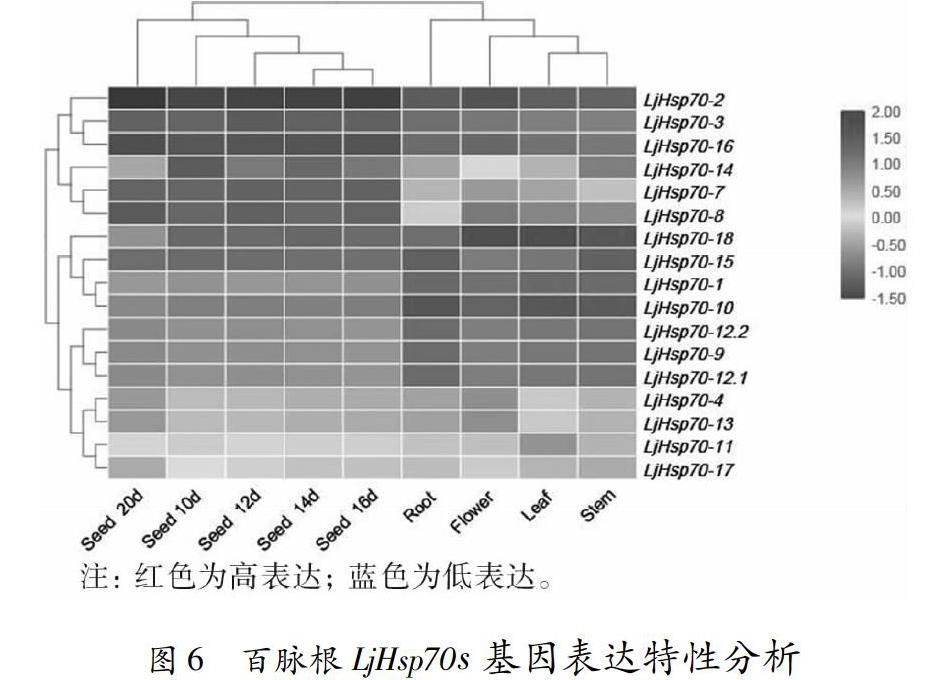
通过比对百脉根LjHsp70s基因在不同组织中表达数据,所得结果表明,百脉根LjHsp70s其因家族成员在根、茎、叶、花、种子五个组织中具有不同的表达模式(图6)。其中,LjHsp70-1、LjHsp70-10、LjHsp70-15和LjHsp70-18在所有被检测组织中均有表达,表明它们在百脉根生长和发育多个过程中都起着作用。并且不同基因具有不同的组织表达特异性,LjHsp70-18在百脉根的花、叶、茎中表达量较高,而LjHsp70-10在叶、茎、根中表达量较高,它们在百脉根的花、叶、茎以及根的发育过程中可能起着重要作用。
3 结论与讨论
Hsp70作为逆境胁迫下产生的一类功能型蛋白,在调控植物生长发育、抗逆性以及作为分子伴侣方面起着重要的作用。目前,Hsp70s基因家族在许多植物中均已获得报道,如在谷子中发现有25个GmHsp70基因[19];野生花生中发现A. duranensis和A.ipansis分别有 34 、35个Hsp70基因[20];在玉米中发现有35个ZmHsp70基因[21];芝麻中有21个SiHsp70基因[22]。对Hsp豆科牧草中70的了解极为有限,导致其对豆科牧草高温耐受品种高效应用及育种工作的限制,所以,在前人研究的基础上,本研究应用生物信息学方法从百脉根数据库中鉴定得出18条LjHsp70s基因完整的编码序列,并且这18条LjHsp70s基因的功能域为PF00012.20。构建系统发育树有助于分析Hsp70s基因在不同物种间的进化关系,本研究以百脉根、拟南芥和烟草共96个Hsp70s基因构建了系统发育树,96个Hsp70s基因家族被分为6个亚族,但是百脉根LjHsp70s基因仅存在于4个亚族中,表明其与拟南芥和烟草Hsp70s基因家族成员之间进化关系密切,也存在一定差异。
通过对百脉根LjHsp70s基因家族进行染色体定位分析,18个成员不均匀的分布在6条染色体上,并且部分基因存在串联重复现象。赵鹏松等[23]认为串联重复在一定程度上可以减轻由染色体突变或是遗传引起的功能丧失,并且在基因功能的多样性和特异性中起着作用。Motif结构分析表明,LjHsp70蛋白只有极少数的成员存在Motif丢失,证明其蛋白高度保守的这一特点。但是Hsp70s基因家族成员存在可变C-末端结构域、底物结合结构域(SBD)和N-末端核苷酸结合结构域(NBD)。研究发现,N-末端核苷酸结合结构域可执行调节功能[24]。C-末端结构域的结构复杂,承担了在附着和释放底物期间发生结构变化,而底物结合结构域则与在非天然基板中表达的疏水区域密切相关[25]。根据HSP70蛋白存在的可变结构域推测百脉根LjHsp70s基因功能可延伸,虽然只分为4个亚族,但是其通过不同的编辑和结合方式,同样可以承担更多的功能。对百脉根LjHsp70蛋白特性进行分析,其主要为酸性的亲水性蛋白,在酸性亚细胞环境中发挥作用。研究发现,Hsp70属于亲水性蛋白质,有利于提高植物抵抗非生物胁迫的能力[26]。亚细胞定位结果分析,大多数LjHsp70s基因家族成员分布于细胞质中,其原因可能与它们承担的功能相关,即位于细胞质中的LjHsp70s成员在协同参与信息传递到细胞核中起着一定的作用,从而调控基因在细胞核内的表达[27]。在I组进化群体中,8条LjHsp70s聚成的独立亚群,其亚细胞均定位于细胞质,推测这8条基因在百脉根生长发育过程中承担了协助蛋白折叠、阻止蛋白聚集、维持细胞器前体蛋白结构的功能[28]。
对LjHsp70s基因上游的TC-rich repeats、circadian、ABRE、TATC-box和P-box等多个顺式作用元件进行分析。结果显示,百脉根中LjHsp70s基因的表达可能受到光响应、胁迫响应、赤霉素及脱落酸等作用元件的调控,并且通过这些顺式作用元件参与了植物的生长发育,对植物的生长起着保护和促进作用。例如,脱落酸(ABA)是参与非生物胁迫反应的必需植物激素,参与干旱胁迫的代谢调控[29];研究表明,ABA可通过控制气孔关闭和基因表达调控通路[31],通过对百脉根LjHsp70s家族基因不同时期组织器官的表达特性分析结果表明,有16条LjHsp70s基因在植物体内各个部位以及不同时期均可以表达,其表达具有广谱性,在一定程度上反映了LjHsp70s基因在百脉根生长发育过程中的重要性。
本文通过对百脉根LjHsp70s基因家族成员进行鉴定和生物信息学分析,较为系统地揭示了百脉根LjHsp70s基因的理化性质、顺式作用元件及进化特性,为该基因功能研究及分子调控提供了理论依据。
参 考 文 献:
[1] 牟国鹏, 陈斌, 何正波. 黑腹果蝇热激蛋白基因家族的生物信息学分析[J].重庆师范大学学报(自然科学版), 2011, 28(3): 10-17, 93.
[2] KIANG J. Heat shock protein 70 kDa molecular biology, biochemistry, and physiology[J].Pharmacology and therapeutics, 1998, 80(2): 183-201.
[3] Al-WHAIBI M H. Plant heat-shock proteins: a mini review[J].Journal of King Saud University-Science, 2011, 23(2): 139-150.
[4] 张振南. 复苏植物牛耳草HSP基因家族分析及BhHsp70-1基因功能研究[D]. 黑龙江八一农垦大学, 2013.
[5] 王明强, 张道远. 植物热激蛋白70基因家族及其生物学功能研究进展[J].基因组学与应用生物学, 2015,34(2): 421-428.
[6] 阮文进, 门维婷, 马婧, 等. 蜡梅热激蛋白基因CpHsp70-1的克隆、亚细胞定位与表达分析[J].西南大学学报(自然科学版), 2016, 38(1): 43-52.
[7] 刘聪聪, 张泽, 关雪莲, 等. 花楸树热激蛋白70基因的克隆及表达分析[J].分子植物育种,2019,17(19):6276-6286.
[8] 栗振义 ,龙瑞才 ,张铁军, 等. 植物热激蛋白研究进展[J].生物技术通报, 2016, 32(2): 7-13.
[9] CHENNA R, SUGAWAR H, KOIKE T, et al. Multiple sequence alignment with the clustal series of programs[J].Nucleic acids research, 2003, 31 ( 13 ) :3497-3500.
[10] KUMAR S, STECHER G, TAMURA K. Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular biology and evolution, 2016, 33(7): 1870.
[11] ARTIMO P, JONNALAGEDDA M, ARNOLD K, et al.Sib bioinformatics resource portal[J].Nucleic acids research, 2012, 40:W597-603.
[12] 呂晶晶, 张天缘, 杨仕梅, 等. 大肠杆菌茶氨酸合成酶基因γ-GGT的生物信息学分析[J].山地农业生物学报,2019,38(1):74-78.
[13] WANG D, ZHANG Y, ZHANG Z, et al. Kaks_calculator 2.0: a Toolkit Incorporating Gamma-series Methods and Sliding Window Strategies[J]. Genomics proteomics and bioinformatics, 2010, 8(1): 77-80.
[14] QUINLAN A R, HALL I M. Bedtools: a flexible suite of utilities for comparing genomic features[J]. Bioinformatics, 2010, 26(6):841-842.
[15] MAGALI L, PATRICE D, GERT T, et al. Plantcare, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic acids research, 2002, 30(1): 325-327.
[16] 王荣青, 万红建, 李志邈, 等. 番茄Hsp70基因鉴定及系统发育关系分析[J]. 核农学报, 2014, 28(3): 378-385.
[17] 丘日光, 张天缘, 杨仕梅, 等. 百脉根TALE转录因子家族的鉴定与生物信息学分析[J]. 植物遗传资源学报, 2019, 20(2): 466-475.
[18] 程瑞, 张虎平, 程寅胜, 等. 蔷薇科果树TMT基因家族生物信息学分析[J]. 南京农业大学学报, 2017, 40(4): 601-610.
[19] 张古文, 刘莉莉, 王显瑞, 等. 谷子Hsp70基因家族的全基因组鉴定及生物信息学分析[J]. 浙江农业学报, 2015, 27(7): 1127-1133.
[20] 陈湘瑜, 徐日荣, 熊发前, 等. 野生花生Hsp70基因家族的全基因组鉴定及生物信息学分析[J]. 中国油料作物学报, 2016, 38(5): 572-581.
[21] 宋晋辉, 马海莲, 瓮巧云, 等. 玉米Hsp70基因家族的全基因组鉴定与分析[J]. 核农学报, 2017, 31(7): 1245-1254.
[22] 徐剑文, 赵君, 刘剑光, 等. 芝麻全基因组Hsp70基因的鉴定与生物信息学分析[J]. 江苏农业学报, 2017, 33(3): 493-502.
[23] SONG Z , PAN F , LOU X , et al. Genome-wide identification and characterization of Hsp70 gene family in Nicotiana tabacum[J].Molecular biology reports, 2019, 46: 1941-1954.
[24] ZDRAVKO D, BROADLEY S A, YASUHITO S, et al. Molecular chaperones of the Hsp110 Family act as nucleotide exchange factors of Hsp70s[J]. Embo Journal, 2014, 25(11): 2519-2528.
[25] SUNG D, KAPLAN F, GUY C L. Plant Hsp70 molecular chaperones: Protein structure,gene family,expression and Function[J].Physiologia plantarum, 2010, 113(4): 443-451.
[26] 周輝, 宋莉, 赵德刚. 大肠杆菌HspQ基因的生物信息学分析[J]. 山地农业生物学报,2018,37(05):57-61.
[27] KOSE S, IMAMOTO N. Nucleocytoplasmic Transport Under Stress Conditions and Its Role in Hsp70 Chaperone Systems[J].Biochimica et biophysica acta, 2014, 1840(9): 2953-2960.
[28] RIBONI M, ROBUSTELLI T A, GALBIATI M, et al. Aba-dependent control of gigantea signalling enables drought escape via up-regulation of flowering locus t in arabidopsis Thaliana[J]. Journal of experimental botany, 2016, 67(22): 6309-6322.
[29] LEE S C, LUAN S. Aba signal transduction at the crossroad of biotic and abiotic stress Responses[J]. Plant cell & environment, 2011, 35(1): 53-60.
[30] ALEKSANDRA W, FLORINA V, CAROLINE S, et al. An update on abscisic acid signaling in plants and more[J]. Molecular plant, 2008, 1(2): 198-217.
