血根碱对人肺腺癌细胞迁移、侵袭和Wnt/β-catenin信号通路的影响
2020-01-02杨佳陈旻李明花钦敬茹王中奇
杨佳,陈旻,李明花,钦敬茹,王中奇
0 引言
肺癌是世界上最常见的恶性肿瘤,其中肺腺癌的比例占40%以上[1],尽管不断有新的治疗方法出现,但五年总生存率仍在20%以下,这主要与其容易复发转移、耐药的特性有关[2]。相较于化疗药的不良反应,从天然中草药中挖掘有效抗肿瘤成分已成为研发的热点之一,具有很大的临床价值[3]。
血根碱(sanguinarine,相对分子质量367.8)是从中药白屈菜、博落回、紫堇、血水草等植物中提取的苯菲啶喹啉类生物碱,具有抗菌消炎、杀虫和麻醉等药理作用。近年来研究发现,血根碱对宫颈癌[4]、胰腺癌[5]、肝癌[6]、胃癌[7]等多种肿瘤具有抑制增殖及诱导凋亡作用,但血根碱在肺癌侵袭转移方面的报道尚少。我们前期已发现,血根碱可以抑制肺癌“干细胞”样细胞[8],而其对肺腺癌细胞侵袭转移的作用及分子调控均不明确。Wnt/β-catenin信号通路的异常活化与肺癌的发生发展以及侵袭转移关系密切[3,9]。
本研究旨在通过观察血根碱对两种不同人肺腺癌细胞迁移及侵袭能力的影响,进一步探讨其与Wnt/β-catenin信号通路之间的初步关系。
1 材料与方法
1.1 材料
人肺腺癌细胞株A549、H1975(上海中科院细胞库);血根碱(Sigma公司,CAS号:S5890,HPLC≥98%,美国);RPMI1640培养基、胎牛血清(FBS)、0.25%胰酶-EDTA(Gibco公司,美国),青霉素/链霉素(碧云天生物技术有限公司,中国);四甲基偶氮唑盐(MTT)、DMSO(Sigma公司,美国);Transwell小室、Matrigel胶(BD公司,美国);cDNA试剂盒及Real-time PCR试剂盒(TaKaRa公司,日本);BCA蛋白浓度测定试剂盒、RIPA裂解液(碧云天生物技术有限公司,中国);PVDF膜(Millipore公司,美国);GSK3β、p-GSK3β(Ser9)、DVL2兔单克隆抗体、GAPDH鼠单克隆抗体、二抗(兔和鼠)(Cell Signaling Technology(CST)公司,美国);β-catenin兔单克隆抗体(Santa Cruz公司,美国)。
1.2 方法
1.2.1 细胞培养 A549和H1975细胞用含10%FBS、100 μg/ml青-链霉素的RPMI1640培养基(完全培养基)于37℃、5%CO2培养箱中培养;实验均采用对数生长期的细胞。
1.2.2 药物配制 血根碱用DMSO配成100 mmol/L的母液,分装后-2 0 ℃存储;使用前,用含10%FBS的RPMI1640培养基稀释成不同浓度的工作液,DMSO终浓度<0.1%。
1.2.3 MTT增殖实验 将细胞悬液以每孔2×104/ml的密度加到96孔板中,待细胞过夜贴壁后,用药组分别加入10、5、2.5、1 μmol/L的血根碱,对照组加入同体积的培养基,在37℃、5%CO2条件下培养24、48、72 h后,用MTT法在490 nm波长处测吸光度值(OD),计算增殖抑制率。
1.2.4 划痕迁移实验 将细胞悬液以5×105/ml接种到6孔板中,待细胞过夜贴壁长至80%后弃培养液,用200 μl枪头在6孔板正中划一条直线,PBS清洗3次后,换入含1 μmol/L血根碱浓度的完全培养基作用48 h;同时设空白对照组于显微镜下观察细胞迁移情况。
1.2.5 Transwell侵袭实验 将Matrigel胶和无FBS培养基按1:6混匀成70 μl,平铺于小室底部孵育4 h;用不含FBS的培养基将细胞按每孔1×106/ml密度接种于Transwell小室上层,分别加入含0、1 μmol/L浓度血根碱的完全培养基100 μl;下室每孔加入500 μl含20%FBS培养基,作用48 h后取出。用棉签擦去上层细胞,乙醇固定30 min,结晶紫染色20 min,清水漂洗3次,于显微镜下取中央区随机5个视野拍照,计算浸润细胞数。
1.2.6 RT-qPCR检测Wnt/β-catenin通路相关基因 将细胞悬液按1×106/ml密度接种至6孔板中,待细胞贴壁后,分别加入0、1、2.5 μmol/L血根碱作用6 h,用TRIzol法提总RNA并测定浓度,按TaKaRa反转录及Real-time PCR试剂盒说明书操作,以GAPDH作为内参基因,应用Thermal荧光定量PCR仪(美国Bio-Rad)检测mRNA表达水平。用2-ΔΔCt法对结果进行分析。实验独立重复3次,引物序列如下:β-catenin上游:5’-AGATGCAGCAACTAAACAGGA-3’,下游:5’-GTACTACATTTTAAGCCATCT-3’;GSK3β上游:5’-AACTGCCCGACTAACAACAC-3’,下游:5’-ATTGGTCTGTCCACGGTCTC-3’;LRP6上游:5’-TTGTTGCTTTATGCAAACAGACG-3’,下游:5’-CGTTTAATGGCTTCTTCGCTGAC-3’;DVL2上游:5’-GAGGAAGAGACTCCCTACCTG-3’,下游:5’-CGGGCGTTGTCATCTGAAAT-3’;TCF/LEF上游:5’-AGGAACATCCCCACACTGAC-3’,下游:5’-AGGTCTTTTTGGCTCCTGCT-3’;CyclinD1上游:5’-AATGACCCCGCACGATTTC-3’,下游:5’-TCAGGTTCAGGCCTTGCAC-3’;GAPDH上游:5’-GCACAGTCAAGGCTGAGAATG-3’,下游:5’-ATGGTGGTGAAGACGCCAGTA-3’。
1.2.7 Western blot检测Wnt/β-catenin通路核心蛋白 收集经血根碱0、1、2.5、5 μmol/L作用6 h后的细胞,RIPA裂解后提取总蛋白,用BCA法定量;每个样品取25 μg蛋白上样,12%SDAPAGE电泳后转膜,用1%BSA封闭1 h,加入一抗(β-catenin、GSK3β、p-GSK3β(Ser9)、DVL2)4℃过夜孵育(1:1 000),二抗(1:1 000)孵育1 h,TBST漂洗3次后,化学发光剂ECL曝光显影。
1.3 统计学方法
采用GraphPad Prism 7.0软件进行数据分析。两组样本比较采用t检验,数据均以均数±标准差表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 血根碱抑制A549和H1975细胞增殖
随着血根碱浓度的增加,对A549和H1975细胞的抑制作用逐渐增强(均P<0.05);在同一浓度下,随着作用时间的延长细胞活力也逐渐下降(均P<0.05),呈一定的浓度-时间依赖性,见表1。24 h时血根碱对A549和H1975细胞的IC50分别为4.41和2.37 μmo/L。
表1 血根碱对A549及H1975细胞增殖的抑制作用 (,n=3)Table 1 Inhibitory effect of sanguinarine on proliferation of A549 and H1975 cells (,n=3)

表1 血根碱对A549及H1975细胞增殖的抑制作用 (,n=3)Table 1 Inhibitory effect of sanguinarine on proliferation of A549 and H1975 cells (,n=3)
Notes:*:P<0.05,**:P<0.01,***:P<0.001,compared with 0μmol/L group (Blank group);SAN:sanguinarine.
2.2 血根碱抑制A549和H1975细胞迁移
划痕实验检测发现,相较于空白对照组,血根碱在低浓度1 μmol/L作用48 h后,A549和H1975细胞迁移能力明显受到抑制,见图1。
2.3 血根碱抑制A549和H1975细胞侵袭
与空白对照组比,血根碱在低浓度1 μmol/L作用48 h后,可显著减少A549和H1975细胞穿过小室的细胞数,差异有统计学意义(P=0.002,P=0.001),见图2。
2.4 血根碱抑制A549和H1975细胞Wnt/β-catenin信号通路相关基因表达
RT-qPCR检测发现,与空白对照组相比,血根碱在1、2.5 μmol/L浓度下作用6 h后,Wnt/β-catenin通路中主要基因β-catenin、LRP6、DVL2及其下游靶基因TCF/LEF、CyclinD1的mRNA水平均有不同程度的下降(P<0.05,0.01,0.001),呈一定的剂量依赖性;GSK3β在基因水平未见明显改变(P>0.05),见图3。
2.5 血根碱下调A549和H1975细胞Wnt/β-catenin信号通路核心蛋白表达
与空白对照组比较,血根碱在1、2.5、5 μmol/L浓度下作用6 h后,可以显著下调A549和H1975细胞Wnt/β-catenin通路中核心蛋白β-catenin、磷酸化GSK3β、DVL2表达,呈一定浓度依赖性;总GSK3β蛋白水平无明显变化,见图4。
3 讨论

图1 血根碱对A549和H1975细胞迁移作用的影响 (×100)Figure 1 Effect of sanguinarine on migration ability of A549 and H1975 cells (×100)

图2 血根碱对A549和H1975细胞侵袭作用影响 (×200)Figure 2 Effect of sanguinarine on invasion ability of A549 and H1975 cells (×200)
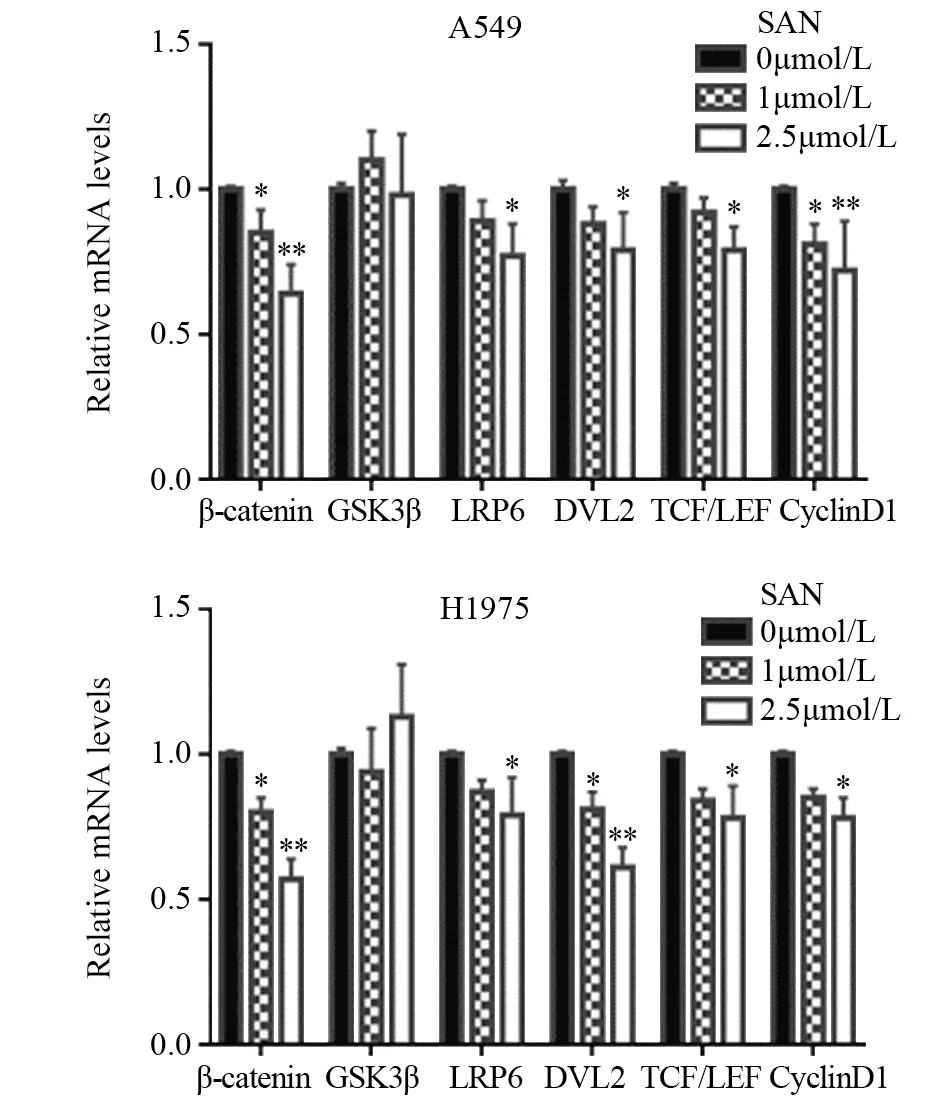
图3 血根碱对A549和H1975细胞Wnt/β-catenin信号通路相关基因表达的影响Figure 3 Effect of sanguinarine on mRNA expression of Wnt/ β-catenin signaling pathway in A549 and H1975 cells
血根碱主要存在于中药白屈菜、博落回的全草和紫堇的块根中,近年来,在多种肿瘤细胞中发现了其不同的抗癌作用。通过产生活性氧(ROS)激活线粒体凋亡途径,血根碱可以促进急性淋巴细胞白血病细胞[10]、乳腺癌MCF-7细胞[11]、头颈癌细胞[12]和肝癌HepG2细胞等的凋亡[6]。其中,也不乏关于对肺癌的报道,Xu等[13]发现血根碱可以抑制VEGF起到抗肺癌血管生成的作用;通过生成活性氧和内质网应激[14],或调控外源性肿瘤坏死因子相关凋亡配体(TRAIL)[15],或上调Fas相关因子的表达[16],可以起到诱导肺癌细胞凋亡、抑制增殖的作用。除了抵抗增殖、诱导凋亡外,近期研究发现血根碱在抵抗多种肿瘤细胞耐药、增强癌细胞对化疗药的敏感度上也有很强作用[17-18]。Ma等[19]还发现血根碱可以通过Hedgehog-Gli-Nanog通路,抑制胰腺癌干细胞增殖和自我更新。我们前期也发现血根碱可以抑制体内外肺癌“干细胞”样细胞增殖[8]。然而,血根碱对肺腺癌细胞在侵袭转移方面的研究尚少,且分子机制尚不明确。
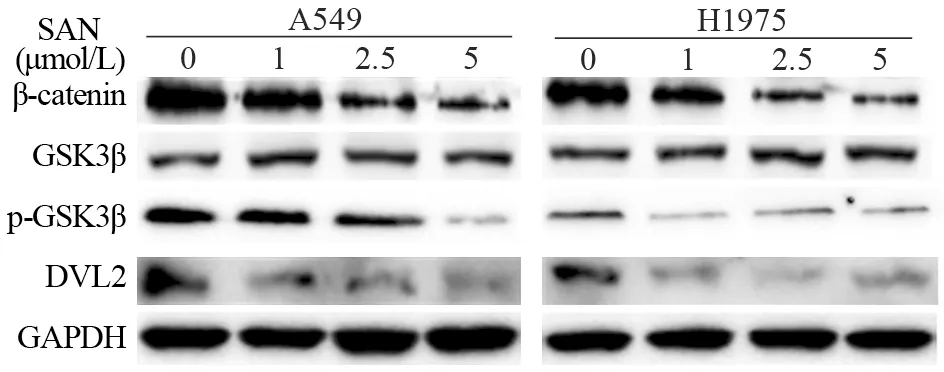
图4 血根碱对A549和H1975细胞Wnt/β-catenin信号通路核心蛋白表达影响Figure 4 Effect of sanguinarine on β-catenin,GSK3β,pGSK3β and DVL2 in A549 and H1975 cells
本研究首先通过增殖实验确认了血根碱对A549和H1975细胞均有明显的抑制作用,且呈浓度-时间依赖性。划痕和Transwell侵袭实验发现,血根碱在低剂量1 μmol/L浓度下,可以抑制肺腺癌细胞的迁移和侵袭,这一结果与徐加英等[4]在宫颈癌细胞中的发现一致。由β-catenin介导的经典Wnt通路在肺癌发生发展、侵袭转移中起到重要作用,当细胞外Wnt配体与膜上受体Frizzled结合后,激活相邻的LRP5/6蛋白,将信号传递到第二信使DVL;活化的DVL抑制由Axin、APC和GSK3β所组成的复合物活性,抑制β-catenin的磷酸化;磷酸化的β-catenin通过泛素化被胞质内的蛋白酶体降解而不入核;非磷酸化的β-catenin不被降解,从而导致在胞质内聚集,并向核内移动,从而与转录因子TCF/LEF结合,激活转录活性,调节下游靶基因c-myc、survivn、Cyclin-D1、MMP-7/9等表达[20-22]。
因此,β-catenin可视为检测Wnt通路是否激活的一个核心指标;LRP5/6、DVL、GSK3β作为调控β-catenin的关键上游因子;TCF/LEF、cyclin-D1作为β-catenin重要的下游靶基因,我们通过RT-qPCR和Western blot法对通路中这些关键分子的mRNA及蛋白水平进行分析发现,血根碱可以下调DVL2和GSK3β第9位丝氨酸磷酸化表达,尽管GSK3β表达无明显改变,而GSK3β第9位丝氨酸的磷酸化降低意味着GSK3β催化活性的增加,从而促进β-catenin降解,进而抑制下游TCF/LEF、cyclin-D1表达,由此起到抑制肺腺癌侵袭转移的作用。
综上所述,本研究发现血根碱可以有效抑制A549和H1975细胞增殖及迁移、侵袭,其机制可能与Wnt/β-catenin信号通路有关。本研究初步揭示了血根碱抗肺腺癌迁移侵袭的分子机制,为血根碱进一步临床的开发应用提供了实验支持。至于血根碱对Wnt信号的具体转录靶点以及血根碱是否会通过不同通路调控肺癌的其他表型作用尚待进一步研究。
