阿魏酸哌嗪片的溶出曲线考察*
2020-01-01陈礼峰周震宇刘华明顾炳仁
陈 沫,陈礼峰,周震宇,刘华明,顾炳仁
苏州市药品检验检测研究中心,苏州 215000
阿魏酸哌嗪是一类非肽类内皮素受体拮抗剂,是当归、川穹等中药的有效成分阿魏酸经与哌嗪成盐的化学合成药物。作为我国自主研发的药物,阿魏酸哌嗪片在临床上主要用于各类伴有镜下血尿和高凝状态的肾小球疾病,如肾炎、慢性肾炎、肾病综合症、早期尿毒症以及冠心病、脑梗塞及脉管炎等的辅助治疗[1,2]。阿魏酸哌嗪片为医保乙类药品,也是《中国药典》[3]收载品种,临床应用广泛,疗效明确。在目前发表的文献中,未见对阿魏酸哌嗪片溶出度研究的文章。在多种不同pH 溶出介质中溶出曲线测定不仅是口服固体制剂质量评价的重要方法,也为仿制药一致性评价提供了依据[4]。
本研究建立了高效液相色谱法对阿魏酸哌嗪片进行溶出曲线的测定,考察了4 家生产企业12批阿魏酸哌嗪片在4 种不同pH 溶出介质中的溶出曲线,并采用f2因子进行了体外溶出一致性评价,为该制剂内在质量的优劣及生物等效性试验提供参考。
1 仪器与药品、试剂
708-DS 全自动药物溶出仪 (美国安捷伦公司);Waters e2695 高效液相色谱仪(美国沃特世公司);ZKT-18F 真空脱气机 (天大天发科技有限公司);XPE105 分析天平(瑞士梅特勒托利多公司)。
阿魏酸哌嗪对照品 (中国食品药品检定研究院,批号:100834-201302);阿魏酸哌嗪片样品(批号:181004、171104、180503,A 企业,规格:50 mg,素片,50 片/瓶;批号:180802、180101、190301,B 企业,规格:50 mg,素片,50 片/瓶;批号:171105、190207,C 企业,规格:50 mg,素片,50 片/瓶;批号:180708,C企业,规格:50 mg,素片,180 片/瓶;批号:180901、181203,D 企业,规格:50 mg,素片,50 片/瓶;批号:180201,D 企业,规格:50 mg,素片,120 片/瓶)。
无水乙酸钠、氢氧化钠、磷酸二氢钾、盐酸、冰醋酸均为分析纯;水为纯化水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Sunfire C18(250mm×4.6mm,5μm);流动相:1%冰醋酸-甲醇(60∶40);流速:1.0 mL·min-1;柱温:40 ℃;检测波长:320 nm;进样体积:20 μL。
2.2 溶出条件
根据《中国药典》和《普通口服固体制剂溶出度试验技术指导原则》[5]中溶出度试验方法,分别以pH 1.2 盐酸溶液、pH 4.0 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液和水作为溶出介质。介质体积900 mL,溶出方法:篮法,转速:50 r·min-1;取样时间:5、10、15、30、45、60 min。采用桨法50 转时,各样品片掉落溶出杯中不同位置,样品片周围溶出介质流速可能不同,导致5 min 时RSD 偏大。
2.3 溶液的制备
2.3.1 对照品溶液 精密称取阿魏酸哌嗪对照品55 mg,置100 mL 量瓶中,用溶出介质溶解并稀释至刻度,作为对照品储备液。精密量取储备液5 mL,置50 mL 量瓶中,用溶出介质稀释至刻度,摇匀,即得。
2.3.2 供试品溶液 取每批样品12 片,分别在pH 1.2 盐酸溶液、pH 4.0 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液和水4 种介质条件下进行试验,在各时间点取溶液用0.45 μm 滤膜滤过,即得。
2.3.3 阴性对照溶液 选取A 企业样品进行研究,按企业处方比例配制空白辅料约1 片量,分别加4种溶出介质900 mL,超声溶解,滤过,即得。
2.4 溶出方法学验证
2.4.1 专属性试验 分别取阴性对照溶液、对照品溶液和供试品溶液,按“2.1”项下色谱条件进样测定,色谱图见图1。阴性对照溶液对测定无干扰。
2.4.2 线性关系考察 精密量取对照品储备液适量,加相应溶出介质稀释成浓度为0.2200、1.100、5.500、11.00、22.00、55.00、110.0、220.0 μg·mL-1的溶液,按“2.1”项下色谱条件进样测定,记录峰面积。以对照品浓度(X)为横坐标,峰面积(Y)为纵坐标进行线性回归,绘制标准曲线。回归方程及线性范围见表1。
2.4.3 进样精密度试验 取“2.4.2”项下各溶出介质制备的阿魏酸哌嗪对照品溶液(55 μg·mL-1)进行检测,连续进样6 次,结果RSD 分别为0.38%、0.28%、0.25%、0.08%,表明仪器的精密度良好。

表1 回归方程与线性范围
2.4.4 稳定性试验 取4 种溶出介质中60 min 时的供试品溶液(55 μg·mL-1)适量,分别于室温下放置0、2、4、8、12 h 进样,记录各峰面积,结果阿魏酸哌嗪峰面积RSD 均小于1.0%,表明供试品溶液在4种溶出介质中室温放置12 h 稳定性良好。
2.4.5 回收率试验 按处方比例,分别精密称取相当于样品标示量50%、75%、100%的阿魏酸哌嗪对照品,称取相应量的A 企业空白辅料,分别按“2.2”项下方法进行溶出试验,经60 min 时,取续滤液进样,并按“2.1”项下色谱条件进样测定,记录色谱图峰面积,计算回收率,结果见表2。结果显示RSD%小于2.0%,方法回收率良好。
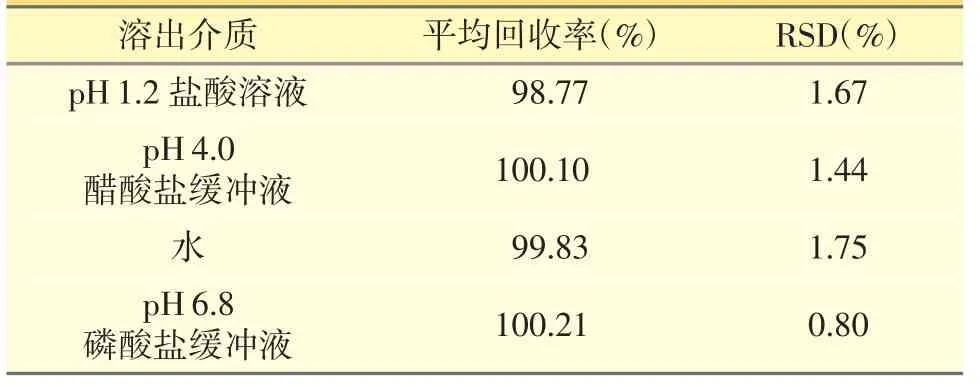
表2 回收率试验结果(n=9)
2.4.6 滤膜吸附性试验 取4 种溶出介质中60min 时的供试品溶液,分别经离心和滤膜过滤2、4、8 mL 后进行测定,结果离心后阿魏酸哌嗪峰面积与过滤后峰面积基本一致;滤膜对阿魏酸哌嗪基本无吸附。
2.4.7 管路吸附性 取4 种溶出介质中60 min 时的供试品溶液,经手动取样和仪器自动取样并进行测定,两种取样结果测得阿魏酸哌嗪峰面积基本一致,表明仪器管路对阿魏酸哌嗪基本无吸附。
2.5 阿魏酸哌嗪pH-溶解性曲线
按照《普通口服固体制剂溶出度试验技术指导原则》[5]配制pH 值分别为1.0、1.2、2.0、4.0、5.5、6.0、6.8、7.0、8.0 的溶出介质。取阿魏酸哌嗪对照品约50 mg,分别加入以上溶出介质各2 mL,超声处理30 min,置摇床中振荡1 h,经0.45 μm 滤膜过滤,取续滤液作为供试品溶液,用HPLC 法测定溶液中阿魏酸哌嗪的浓度,计算不同pH 下阿魏酸哌嗪的溶解度,并绘制阿魏酸哌嗪的pH-溶解性曲线,见图2。
2.6 溶出曲线制备
A、B、C、D 企业生产的4 批阿魏酸哌嗪片(181004、180802、171105、180901) 在4 种不同pH介质中的溶出行为(n=12)见图3。
同一企业生产的不同批号的阿魏酸哌嗪片在4种不同pH 介质中的溶出曲线(n=12)见图4。
2.7 相似性评价
参照《普通口服固体制剂溶出度试验技术指导原则》,应用相似因子f2的模型非依赖方法,来比较溶出曲线相似性。非模型依赖的f2计算公式为:
其中Rt、Tt分别为各时间点参比制剂和供试制剂的溶出度。由于阿魏酸哌嗪片为中国自主研发的药物,国外并无同类型产品,故本试验采用最早生产阿魏酸哌嗪片A 企业的一个批次作为参比制剂,即批号181004。如果50≤f2≤100,可认为溶出曲线相似,普通固体制剂若15 min 内的平均溶出量大于85%时,可认为溶出曲线相似,不再计算f2值,溶出曲线f2值测定结果汇总见表3。
2.7.1 pH 1.2 盐酸溶液 12 批次样品在60 min 时累计溶出量均低于15%,试验过程中样品均出现溶胀、未完全崩解现象,不进行f2因子计算。
2.7.2 pH 4.0 醋酸盐缓冲液 A 企业的3 批样品和B 企业的2 批样品在15 min 内溶出量均≥85%,其余7 批样品在15 min 内溶出量均<85%,且f2值均<50。由图4 可见,各样品在溶出介质pH 4.0 醋酸盐缓冲液中溶出行为差异较大。
2.7.3 水和pH 6.8 磷酸盐缓冲液 3 家企业的9 批样品在15 min 内溶出量均≥85%,可认为A、B、D企业的阿魏酸哌嗪片溶出行为相似。C 企业的3 批样品在15 min 内溶出量<85%,且C 的3 批次f2值分别为24.0、24.2、25.6,均<50,表明C 企业与A 企业样品溶出行为差异较大。
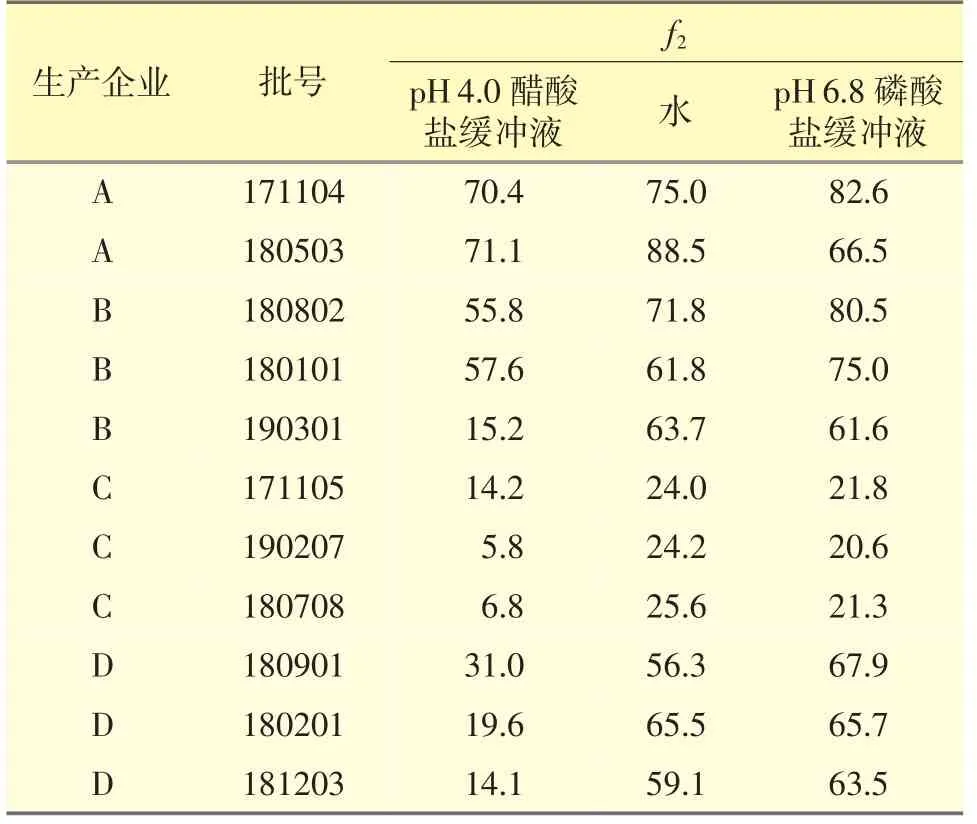
表3 f2 因子结果统计表
3 讨论
早期的药品研发过程不能满足现行一致性评价要求,作为原研制剂的关键技术属性尚不清楚,因此对于此类制剂,进行关键质量属性的考察,建立并验证有适度区分力的溶出曲线方法,考察产品批内、批间溶出曲线差异,对其一致性评价具有非常重要的科学意义和临床价值。
所建立的HPLC 法测定阿魏酸哌嗪片溶出度曲线,并对该方法进行了验证,与《中国药典》紫外-可见分光光度法相比,本方法灵敏度高,专属性好,准确度高,可用于阿魏酸哌嗪片的含量测定,有利于对制剂质量进行评价和控制。
国外药典并未收载阿魏酸哌嗪片同类型产品,本研究所选择的参比制剂不是真正意义上的参比制剂,使用f2因子法只是为了评价不同企业生产的不同批次的阿魏酸哌嗪片是否存在差异。从溶出曲线结果看出,在pH 1.2 盐酸的溶出介质中所有生产企业各批次样品溶出速率均较慢,在60 min 时累计溶出量均低于15%,样品均出现溶胀、未完全崩解的现象,参考阿魏酸哌嗪的pH-溶出曲线,在pH 1.2盐酸中溶解度为0.63 mg·mL-1,满足漏槽条件,且阿魏酸哌嗪片为素片,提示该片存在胃中崩解释放缓慢问题,可能影响药物吸收和药效发挥。在水和pH 6.8 磷酸盐缓冲液中各生产企业各批次产品都无较明显区分力。在pH 4.0 醋酸盐溶出介质中除了A 企业3 批样品溶出曲线相似,对其他3 家企业9 批样品均有较明显的区分力,提示不同企业生产处方工艺方面存在一定差异,企业应加强处方工艺的筛选优化,改进提高生产工艺。
