基于Plackett-Burman和响应面中心组合设计优选夏枯草多糖制备工艺及其活性研究
2019-12-30周亚敏熊苏慧赵灵佳张智敏夏伯候林丽美
周亚敏 熊苏慧 赵灵佳 张智敏 夏伯候 林丽美


摘要:目的 研究夏枯草多糖制備工艺,初步探讨其体外抗氧化、抗炎活性。方法 利用超声波辅助酶法提取技术,以夏枯草多糖得率为指标,采用Plackett-Burman试验、爬坡试验和响应面分析法筛选最优提取组合。通过ABTS+自由基、DPPH自由基清除能力及Fe2+还原能力研究夏枯草多糖抗氧化能力;检测夏枯草多糖对脂多糖诱导的巨噬细胞RAW264.7模型炎症因子的影响。结果 夏枯草多糖的最佳制备工艺为:纤维素酶浓度为5.0%,酶解时间为150 min,酶解温度为60 ℃,液料比为45∶1。验证试验最优值为5.48%,与预测值(5.36%)非常接近。夏枯草多糖具有显著的DPPH自由基、ABTS+自由基清除作用及Fe2+还原能力;对脂多糖诱导的巨噬细胞RAW246.7炎症因子分泌具有一定的抑制作用。结论 超声波辅助酶法提取夏枯草多糖得率较高,纯度较好;夏枯草多糖具有明显的抗氧化、抗炎活性。
关键词:夏枯草多糖;Plackett-Burman;制备工艺;抗氧化;抗炎
中图分类号:R284.2;R285.5 文献标识码:A 文章编号:1005-5304(2019)12-0067-08
DOI:10.3969/j.issn.1005-5304.2019.12.015 开放科学(资源服务)标识码(OSID):
Optimization of Extraction Process of Prunella vulgaris L. Polysaccharide by Plackett-Burman Design and Response Surface Central Composite Design and Study on Activity
ZHOU Yamin1,2,3,4, XIONG Suhui1,2,3, ZHAO Lingjia1,2,3, ZHANG Zhimin1,2,3, XIA Bohou1,2,3, LIN Limei1,2,3
1. Pharmacy School, Hunan University of Chinese Medicine, Changsha 410208, China; 2. Key Laboratory for Quality Evaluation of Bulk Herbs of Hunan Province, Changsha 410208, China; 3. Collaborative Innovation Center of Resource for Chinese Materia Medica of Hunan Province, Changsha 410208, China;4. Hunan Prima Pharmaceutical Research Center Co. Ltd, Changsha 410331, China
Abstract: Objective To optimize the extraction process of Prunella vulgaris L. polysaccharides (PVP); To preliminarily discuss its antioxidant and anti-inflammatory activity in vitro. Methods Ultrasonic assisted enzymatic extraction technology was used and the yield of polysaccharide was set as the comprehensive index. Plackett-Burman analysis method, steepest ascent design and central composite design were used to screen optimal extraction combination. The antioxidant capacity of PVP was determined by the method of ABTS+, DPPH free radical scavenging and Fe2+ reducing antioxidant power. LPS-induced macrophage RAW264.7 model was used to investigate the anti-inflammatory activity of PVP. Results The optimal extraction process was as follows: The cellulase concentration was 5.0%; the enzymatic hydrolysis time was 150 min; the enzymatic hydrolysis temperature was 60 ℃; the ratio of liquid to material was 45:1. The experimental yield 5.48% under optimal conditions was closely agreed with the predicted yield 5.36% of the model. PVP possessed strong hydroxyl radical scavenging activities and Fe2+ reducing activity, and had a certain inhibitory effect on the secretion of inflammatory factors induced by LPS in macrophage RAW246.7. Conclusion PVP extracted by ultrasonic assisted enzymatic extraction process has high yield and good purity; PVP has significant antioxidant and anti-inflammatory activity.
Keywords: Prunella vulgaris L. polysaccharides; Plackett-Burman; extraction process; antioxidant; anti-inflammatory
夏枯草Prunella vulgaris L.为唇形科夏枯草属多年生草本植物,以干燥果穗入药,《中华人民共和国药典》收录的以夏枯草单味药制备的药物有夏枯草膏、夏枯草口服液、夏枯草颗粒和胶囊,均以夏枯草为原料经水提取,浓缩,再加辅料制备而成[1]。夏枯草为药食两用,有增强人体免疫力、润泽皮肤、散结滋阴等功效[2],具有重要的临床应用价值和功能性食品开发利用价值。研究表明,夏枯草水提液生物活性非常广泛,具有抗病毒、抗炎、抗氧化、降压、降糖、降脂等作用[3-6],目前国内外对夏枯草成分的研究主要集中在水溶性较差的三萜、挥发油类,以及中等极性的黄酮、酚酸、皂苷等化合物[7-10]。迄今有关夏枯草水溶性成分尤其是多糖的研究还很不完善,主要表现为夏枯草多糖制备工艺落后、活性研究报道较少等。本研究采用超声波辅助酶法提取夏枯草多糖,筛选最佳提取工艺,并探讨夏枯草多糖的抗氧化、抗炎活性,为其后续研究开发奠定基础。
1 仪器与试药
TU-1900紫外-可见分光光度计,日本岛津公司;GT-2127QT超声波清洗仪,昆山市超声仪器有限公司;Multiskan MK3多功能酶标仪,Thermo公司;SHEL-LAB CO2培养箱,Sheldon Manufactring Inc。
夏枯草样品收集于安徽夏枯草GAP基地(2013年5月),经湖南中医药大学药学院龚力民鉴定为唇形科夏枯草属植物夏枯草Prunella vulgaris L.;葡萄糖对照品(批号30805,德国Dr. Ehrenstorfer GmbH公司);纤维素酶(批号507A0221,Solarbio公司);苯酚(批号53600155,北京鼎国昌盛有限责任公司),无水乙醇(批号20150604,国药集团化学试剂有限公司),浓硫酸(批号20150410,株洲市星空化玻试剂有限公司);DPPH(批号STBD4146V,Sigma公司);ABTS、FRAP试剂盒(批号20150428,碧云天生物技术研究所);小鼠肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、一氧化氮(NO)ELISA试剂盒(批号96T/201507,BD公司);小鼠巨噬细胞株RAW264.7,中国科学院上海细胞库。
2 方法与结果
2.1 提取工艺优化
2.1.1 药材前处理
将夏枯草的干燥果穗粉碎至60~80目,以固液比为10 mL/g,加入体积浓度为95%乙醇溶液,70 ℃回流提取4 h,残渣过滤,得到残渣于40 ℃干燥12 h,即得脱除脂类、色素和小分子糖的夏枯草粉末。
2.1.2 夏枯草多糖提取率测定
2.1.2.1 对照品溶液制备
精密称定无水葡萄糖对照品20.0 mg,加水定容至10 mL,配制成浓度为2.0 mg/mL的葡萄糖对照品溶液。
2.1.2.2 标准曲线制作
采用苯酚-硫酸法[11],以葡萄糖对照品溶液为对照,于490 nm波长处测定吸光度,制作标准曲线。
2.1.2.3 测定方法
分别精密称量经过前处理的夏枯草粉末0.1 g,按不同工艺条件进行提取,5000 r/min离心10 min,取上清液100 μL,加4倍体积无水乙醇(乙醇终浓度为80%)沉淀多糖,4 ℃冰箱冷藏过夜,5000 r/min离心15 min,取沉淀物,加1 mL水溶解。取100 μL多糖溶液,稀释至1 mL,采用苯酚-硫酸法测定多糖,计算夏枯草多糖提取率(Y)。Y=CV/m×100%,式中,C为夏枯草多糖的质量浓度(μg/mL),V为多糖溶液体积(mL),m为夏枯草粉末质量(0.1 g)。
2.1.3 Plackett-Burman试验
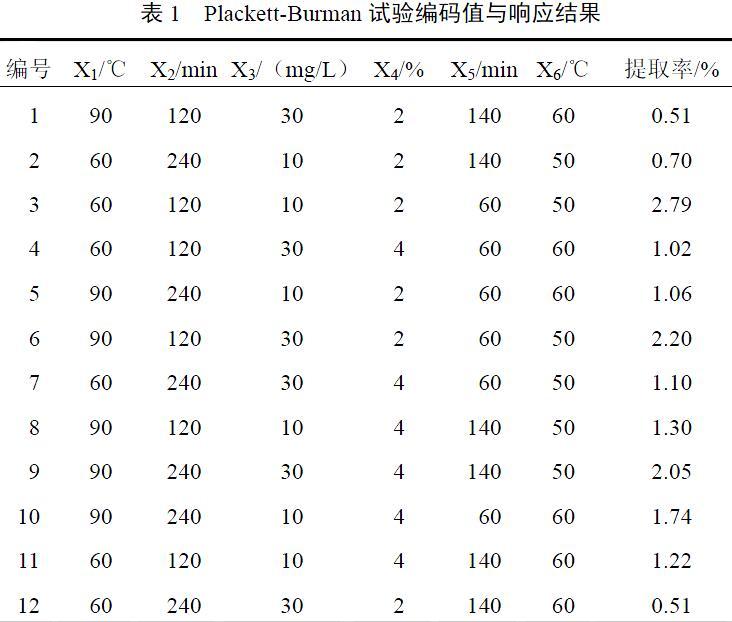
参考文献[12]方法,结合初级试验的结果,以夏枯草多糖提取率为响应值,采用Minitab17软件进行Plackett-Burman试验设计,对提取温度(X1)、提取时间(X2)、液料比(X3)、纤维素酶浓度(X4)、酶解时间(X5)和酶解温度(X6)6个因素进行全面考察,分析各因素对响应值多糖提取率的影响。Plackett- Burman试验设计编码值与响应结果见表1。
采用Design Expert 8.0软件对Plackett-Burman试验结果数据进行处理。各因素显著性分析结果显示,液料比(X3)、纤维素酶浓度(X4)、酶解温度(X6)对多糖提取率的影响为正效应,即随着影响因素数值的增大,多糖提取率为升高趋势;提取时间(X2)、提取温度(X1)、酶解时间(X5)对多糖提取率的影响为负效应,即随着影响因素数值的增大,多糖提取率为降低趋势。见表2。纤维素酶浓度(X4)、酶解时间(X5)、液料比(X3)、酶解溫度(X6)的P值均小于0.05,提取过程中,其影响大小依次为X4>X5>X3>X6,因此将这4个因素作为显著性影响因素,进一步用最陡爬坡试验设计进行优化,选出最优提取工艺参数区域。
2.1.4 最陡爬坡试验
根据Plackett-Burman试验选出的对多糖提取率有显著影响的提取条件因素,以各因素的效应大小确定改变的步长,以各因素的效应正负确定爬坡的方向,从而最快找到最大响应值。最陡爬坡试验其他非显著因素条件保持不变[13]。具体试验设置及其编码值见表3,试验结果见表4。
试验结果表明,3号试验的多糖提取率最高,确定最佳条件在此附近。因此,选择纤维素酶浓度5%、酶解温度60 ℃、酶解时间140 min和液料比40 mL/g分别为各因素中心点,进行中心组合设计响应面试验,确定最佳提取工艺条件。
2.1.5 响应面试验
依据Plackett-Burman试验和最陡爬坡试验的结果,明确主要影响因素为纤维素酶浓度(A)、酶解温度(B)、酶解时间(C)、液料比(D),并确定响应面分析法中心组合设计各因素水平的中心点和各水平步长[14]。利用Design Expert 8.0软件进行试验设计,测定并计算多糖提取率,结果见表5。
2.1.6 模型拟合与响应面分析
根据响应面中心组合设计试验结果,使用Design Expert 8.0软件进行多元回归拟合,得到多糖提取率与各因素的二次多项回归方程:Y=5.18+0.33D-0.17A-0.18B+0.38C+0.26AD+0.26CD+3.885×10-3BD+0.13AC-0.045AB+0.087BC-0.49D2-0.54A2-0.51C2-0.78B2,R2=0.990 4。
依据方程的一次项系数大小可以看出,影响纤维素酶辅助超声波提取的夏枯草多糖提取率的因素主次顺序为:酶解时间>料液比>酶解温度>纤维素酶浓度。为检验方程的有效性,对夏枯草多糖提取的数学模型进行方差分析,结果见表6。
此模型P<0.000 1,表明选用的模型有显著意义;失拟项P=0.600 2,表明模型的拟合程度较好。模型R2=0.990 4,说明该模型能反映99.04%响应值的变化,因而误差较小,可选用此方程对试验真实点进行分析和预测夏枯草多糖提取率。
各因素两两交互作用的响应面分析见图1~图6。依据各因素对其响应值所构成的三维立体曲面图分析得出,多糖提取率随纤维素酶浓度、酶解时间、酶解温度、液料比的增长而先升高后降低,在中心点处出现峰值。响应曲面坡度的陡峭程度说明响应值随影响因素的变化强弱,等高线形状可反映交互效应强弱[19]。由图4、图5可知,等高线图的椭圆曲率半径较小,酶解时间与液料比、酶解温度对夏枯草多糖提取率的交互作用相对不明显。由图1、图2可见,纤维素酶浓度与酶解温度、酶解时间交互作用显著。相比之下,图3、图6等高线图的椭圆曲率半径更大,响应曲面坡度更陡峭,因此,液料比与酶解时间、纤维素酶浓度之间交互作用更显著。综合比较可知,四因素的两两交互作用对多糖提取率影响的显著程度为AD、CD>AB、AC>BC、BD,方差分析结果也印证了响应面分析结果。
2.1.7 提取工艺优化结果
在选取的各因素范围内,根据回归模型分析得出,纤维素酶浓度、酶解时间、酶解温度、液料比为对多糖提取率均有显著影响,从节约时间、降低成本和能量消耗的生产实际出发,在保证提取充分的前提下,综合分析各影响因素,拟定最佳工艺条件为:纤维素酶浓度5.0%,酶解时间150 min,酶解温度60 ℃,液料比45∶1,其对应的预测值为5.36%。在上述条件下,进行3组验证试验结果最优值为5.48%,与预测值接近,误差在允许范围内,说明利用响应面法优化纤维素酶水解超声提取法提取夏枯草多糖是可行、有效的。
2.2 抗氧化能力测定
2.2.1 ABTS自由基清除试验
将夏枯草多糖干燥粉末用蒸馏水配制成浓度为0.5、1.0、2.0、3.5、5.0、6.0 mg/mL的供试品溶液,其他溶液由试剂盒提供或按试剂盒说明配制。在96孔板检测孔中加入ABTS工作液200 μL,样品检测孔加入10 μL各浓度样品,空白对照孔加入10 μL蒸馏水,轻轻混匀,室温孵育6 min后于734 nm波长处测定吸光度(A);以蒸馏水代替样品溶液作为空白对照,吸光度为A0。以Trolox作参比,每份平行3次,计算夏枯草多糖对ABTS+自由基的清除率[15]。ABTS自由基清除率(%)=(A0-A)÷A0×100%。
由图7可知,在试验的剂量范围内,夏枯草多糖对ABTS·+的清除作用随浓度升高逐渐增强,呈量效关系;在6.0 mg/mL时,清除率约为52.5%,有一定的抗氧化作用;夏枯草多糖的ABTS·+清除能力低于阳性对照物,只有相同浓度下Trolox的57.6%。
2.2.2 DPPH自由基清除试验
准确称量10 mg DPPH溶于无水乙醇中,配制浓度为0.1 mmol/L的溶液。将夏枯草多糖样品分别稀释至0.5、1.0、2.0、3.5、5.0、6.0 mg/mL。分别取20 μL多糖溶液于200 μL DPPH中,室温静置30 min后于515 nm波长处测定吸光度(A1);以无水乙醇作为试剂空白,吸光度为A2;以DPPH溶液作為对照,吸光度为A0。以Trolox作参比,每份平行3次,计算夏枯草多糖对DPPH自由基的清除率[16]。DPPH自由基清除率(%)=(A0-A1+A2)÷A0×100%。
由图8可知,夏枯草多糖清除DPPH自由基有一定的量效关系;在浓度为6.0 mg/mL时,对DPPH自由基有较好的清除作用,其清除率达61.6%;夏枯草多糖的DPPH自由基清除能力低于阳性对照物,只有相同浓度下Trolox的68.0%。
2.2.3 铁离子还原试验
取标准FeSO4溶液、TPTZ溶液和醋酸钠缓冲液,配制0.2、0.4、0.6、0.8、1.0、1.2 mmol/L标准溶液。乙醇为溶剂,分别取0.5、1.0、2.0、3.5、5.0、6.0 mg/mL夏枯草多糖待测溶液5 μL,加入180 μL TPTZ工作液中,37 ℃反应30 min,测定溶液在593 nm波长处的吸光度,每份平行测定3次。以FeSO4标准溶液代替样品,按上述方法测定并绘制标准曲线,结果FeSO4浓度(mmol/L)与吸光度在一定范围内呈线性关系,回归方程为Y=0.780 3X-0.026 5(R2=0.996 8)。以Trolox作参比,每份平行测定3次[17]。根据各样品吸光度求得FeSO4浓度,样品总抗氧化能力以FeSO4当量(mmol/g)表示。
由图9可知,夏枯草多糖浓度为6 mg/mL时抗氧化能力较好,约为1.6 mmol/g;但与Trolox比较还有一定差距,总抗氧化能力只有相同浓度Trolox的62.2%。
2.3 抗炎活性测定
2.3.1 细胞培养与分组
用10%胎牛血清、10 U/mL青霉素和100 μg/mL链霉素的高糖DMEM培养基(37 ℃、5%CO2)培养小鼠腹腔巨噬细胞RAW264.7[18]。将细胞分为空白组和不同浓度(0、3.75、7.5、15、30、60 μg/mL)夏枯草多糖组。
2.3.2 细胞毒性实验
为确保实验过程中夏枯草多糖溶液对脂多糖引起的炎症反应作用不是由于其对细胞的毒性作用所致,采用MTT检测不同浓度夏枯草多糖对细胞存活率的影响。取RAW264.7细胞接种于96孔培养板中,密度为1×104个/mL,每孔100 μL,37 ℃、5%CO2培养过夜,无血清DMEM培养基同步化24 h。实验组加入含有不同浓度(0、3.75、7.5、15、30、60 μg/mL)夏枯草多糖完全培养液80 μL,孵育2 h后加入脂多糖使终浓度为1 μg/mL;空白组加入等体积溶剂。每个浓度设置6个复孔。细胞培养48 h后,吸弃原培养基,每孔加5 mg/mL MTT 10 μL,继续培养4 h,弃培养液,加入DMSO 0.15 mL,震荡、混匀后于酶标仪490 nm波长处测吸光度,取平均值。结果显示,与空白组比较,夏枯草多糖各浓度组细胞活力差异无统计学意义(P>0.05),见图10。提示夏枯草多糖在0~60 μg/mL浓度范围内对RAW264.7细胞的活力无明显影响,基本无细胞毒性,可用于进一步抗炎活性的检测。
2.3.3 炎症因子检测
RAW264.7细胞用不同浓度夏枯草多糖处理1 h,设置6个复孔,孵育2 h后加入脂多糖,使终浓度为1 μg/mL。空白组加入等体积溶剂。孵育24 h,收集各孔上清液并标记,按ELISA试剂盒说明书进行操作,分别测定TNF-α、IL-1β、NO含量。结果显示,与空白组比较,1 μg/mL脂多糖可使细胞培养液中TNF-α、IL-1β和NO含量显著升高,而不同浓度夏枯草多糖组细胞培养液中TNF-α、IL-1β和NO含量显著降低(P<0.01),且呈剂量依赖性,见图11。可见,夏枯草多糖可明显抑制脂多糖诱导的TNF-α、IL-1β及NO释放。
3 讨论
夏枯草多糖是夏枯草主要的活性成分之一,为进一步开发利用夏枯草资源,需要对其进行深入系统的研究,改进夏枯草多糖提取方法,优化提取工艺势在必行。本试验采用酶解法提取水溶性夏枯草多糖,确定纤维素酶解辅助超声法最佳工艺条件为:纤维素酶浓度5.0%,酶解时间150 min,酶解温度60 ℃,液料比为45∶1,提取温度60 ℃,提取时间120 min。验证试验结果表明,所得二元多次回归方程可靠,可对夏枯草多糖提取进行预测。优化的提取工艺步骤少,条件要求低,且运用纤维素酶能够专一性降解纤维素,破坏植物细胞壁,使细胞内多糖溶出更完全;既可减少夏枯草中有效成分的损耗,又贴近药食一体化的要求,保证了药物的安全性。对所得夏枯草多糖进体外活性研究,抗氧化能力测定结果表明其具有良好的抗氧化能力。进一步通过脂多糖诱导巨噬细胞RAW264.7炎症反应检测夏枯草多糖对炎症因子释放的影响,结果表明夏枯草多糖可在一定程度上抑制RAW264.7细胞TNF-α、IL-1β和NO的表达,具有一定的抗炎作用。
综上所述,酶解辅助超声提取的夏枯草多糖得率较高,夏枯草多糖抗氧化、抗炎能力较强,可为提高夏枯草资源的利用率及夏枯草多糖的工业化生产提供依据。
参考文献:
[1] 國家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:1343-1344.
[2] 郭巧,陈宇航.夏枯草基原植物及其食疗历史考证[J].中国中药杂志, 2011,36(21):3057-3062.
[3] TIAN L, WANG Z, WU H, et al. Evaluation of the anti-neuraminidase activity of the traditional Chinese medicines and determination of the anti-influenza A virus effects of the neuraminidase inhibitory TCMs in vitro and in vivo[J]. J Ethnopharmacol,2011, 137(1):534-542.
[4] HWANG S M, LEE Y J, YOON J J, et al. Prunella vulgaris suppresses HG-induced vascular inflammation via Nrf2/HO-1/eNOS activation[J]. Int Journal Mol Sci,2012,13(1):1258-1268.
[5] 梁興伦,韩明向.四安胶囊对高脂血症模型的效应研究[J].成都中医药大学学报,1998,21(3):40-42.
[6] 夏伯候,刘菊妍,李春.夏枯草水提液及水提醇沉上清液降血压药效评价[J].中国实验方剂学杂志,2014,20(2):113-116.
[7] 柏玉冰,李春,周亚敏,等.夏枯草的化学成分及其三萜成分的抗肿瘤活性研究[J].中草药,2015,46(24):3623-3629.
[8] 杨洁,戚进,余伯阳.不同产地夏枯草中总三萜及总酚酸的含量测定[J].海峡药学,2015,27(8):29-31.
[9] ZHANG G, HE L, HU M. Optimized ultrasonic-assisted extraction of flavonoids from Prunella vulgaris L. and evaluation of antioxidant activities in vitro[J]. Innov Food Sci Emerg,2011, 12(1):18-25.
[10] 张兰珍,郭亚健,涂光忠,等.夏枯草中的一个新三萜皂苷[J].药学学报,2008,43(2):169-172.
[11] SAHA A K, BREWER C F. Determination of the concentrations of oligosaccharides, complex type carbohydrates, and glycoproteins using the phenol-sulfuric acid method[J]. Carbohyd Res,1994,254:157-167.
[12] PLACKETT R L, BURMAN J P. The design of optimum multifactorial experiments[J]. Biometrika,1946,33(4):305-325.
[13] CHEN H, NIU J, QIN T, et al. Optimization of the medium for Lactobacillus acidophilus by Plackett-Burman and steepest ascent experiment[J]. Acta Sci Pol Technol Aliment,2015,14(3):227-232.
[14] ZHANG X, CHEN J, MAO M, et al. Extraction optimization of the polysaccharide from Adenophorae Radix by central composite design[J]. Int J Biol Macromol,2014,67:318-322.
[15] CUI C, ZHANG S, YOU L, et al. Antioxidant capacity of anthocyanins from Rhodomyrtus tomentosa (Ait.) and identification of the major anthocyanins[J]. Food Chem,2013, 139(1):1-8.
[16] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:the FRAP assay[J]. Anal Biochem,1996,239(1):70-76.
[17] MOLYNEUX P. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity[J]. Songklanakarin J Sci Technol,2004,26(2):211-219.
[18] 宋亚玲,王红梅,倪付勇,等.金银花中酚酸类成分及其抗炎活性研究[J].中草药,2015,46(4):490-495.
[19] HWANG S M, LEE Y J, LEE Y P, et al. Anti-proliferative effect of an aqueous extract of Prunella vulgaris in vascular smooth muscle cells[J]. Evid-Based Compl Alt,2013,2013:936463.
(收稿日期:2018-12-01)
(修回日期:2018-12-23;编辑:陈静)
