免疫功能正常者马尔尼菲蓝状菌病的胸部CT及PET-CT表现
2019-12-24梁锐烘刘艳雯曾庆思
梁锐烘,刘艳雯,曾庆思
马尔尼菲蓝状菌病(Talaromycosis marneffeii,TSM)是由马尔尼菲蓝状菌(Talaromyces marneffei,TM)感染所致的全身多系统播散性真菌性疾病,可累及肝、脾、骨髓、皮肤、淋巴及头颈部等多个器官,其中肺脏是最常见的首发部位[1]。马尔尼菲蓝状菌以往又称为马尔尼菲青霉菌,由于其分子生物学特性不同,2011年Samson等[2]将其从青霉菌属中独立出来并予以正式更名。TSM主要见于免疫功能缺陷或低下的人群。近年来,随着获得性免疫缺陷综合征( acquired immune deficiency syndrome,AIDS)患者日益增多以及免疫抑制剂、肿瘤放化疗和糖皮质激素的应用[3-5],国内外有关HIV阳性或阴性的免疫力低下人群合并TSM的胸部影像表现的病例报道逐年增加[6-8],而对于免疫功能正常或健全宿主的TSM胸部影像报道多为临床个案或少数病例的分析[9-12]。本文回顾性分析本院18例免疫功能正常宿主的TSM患者的胸部CT、PET-CT和临床资料,旨在提高对本病的认识及影像诊断水平。
材料与方法
1.病例资料
2010年2月-2019年1月在本院确诊为TSM且免疫功能正常的患者共18例,其中男12例,女6例,年龄18~62岁,平均48岁。本组患者均无致免疫功能缺陷或低下的基础疾病。
TSM的确诊依据为病理活检或体液培养,其中经脓液培养6例,痰液培养4例,肺泡灌液洗3例,穿刺活检2例,脓、痰液同时培养1例,支气管镜活检和痰液培养1例,支气管镜活检和脓液培养1例。
2.检查方法
16例患者行胸部CT平扫及增强检查,2例仅行胸部CT平扫。使用Siemens Definition AS 128层螺旋CT机。增强扫描自肘静脉经双筒高压注射器注入对比剂碘海醇(300 mg I/mL),剂量1.1~1.2 mL/kg,注射流率3.0~3.5 mL/s。扫描参数:125 kV,自动mAs,螺距0.9,X线管旋转速度为0.33 s/r,视野320 mm×320 mm,采集矩阵512×512,数据采集层厚0.625 mm,图像重建层厚、层距均为2 mm,重建后数据传送到工作站进行后处理。
5例同时使用GE Healtheare Discovery ST Hpower 60行PET-CT扫描,显像剂为18F-FDG,注射剂量为4.44~5.55 MBq/kg(0.12~0.15 mCi/kg)。静脉注药40~60 min后进行显像,分别得到 PET、CT及两者的融合图像,最后选取放射性浓聚程度最高的层面测量ROI的最大标准化摄取值(standardized uptake value,SUVmax)。
3.影像分析
所有患者的CT图像由2位具有胸部影像诊断经验的放射科医师进行评价分析。分析内容包括病灶的部位、范围及表现形式(粟粒、结节、肿块、实变影、小叶间隔增厚、空洞和支气管扩张等)、肺门及纵隔淋巴结情况、骨质破坏及修复情况。由两位影像科医师在PET-CT融合图像上测量病灶的SUVmax。
结 果
1.临床表现及实验室检查
18例患者的主要临床表现:咳嗽16例(88.9%),发热伴盗汗6例(33.3%),胸闷伴胸痛9例(50.0%),消瘦7例(38.9%),全身皮肤包块、皮疹、红斑及溃疡5例(27.8%)。实验室检查:白细胞数升高12例(66.7%),中性粒细胞数升高14例(77.8%),血沉升高16例(88.9%),血红蛋白降低16例(88.9%);真菌(1-3)-β-D葡聚糖定量G试验阴性13例(72.2%)。
2.影像学表现
患者均为两肺为多发弥漫或散在病变,累及多个肺叶和/或肺段。表现为多发粟粒及小结节影(图1a)7例(38.9%),片状实变影(图2a)6例(33.3%),肿块及结节影(图3a、b)3例(16.7%),斑片及条索影2例(11.1%);伴两肺小叶间隔增厚(图1c)7例(38.9%);多发厚壁小空洞(图1b)6例(33.3%),其中位于左上肺2例(11.1%)、右上肺2例(11.1%)、两肺散在分布2例(11.1%);支气管扩张4例(22.2%);支气管血管束增粗2例(11.1%);右肺多发叶、段支气管狭窄1例(5.6%);左上肺毁损1例(5.6%);胸腔积液8例(44.4%),其中两侧胸腔积液4例(22.2%);心包积液4例(22.2%)。伴骨质溶骨性破坏(图2b)7例(38.9%),其中4例多发,3例单发;位于肋骨4例,锁骨3例,胸骨2例,胸椎2例,肩胛骨1例。5例(27.8%)在治疗过程中多次随访CT复查,可见原骨质破坏区出现骨质增生、修复改变(图2c),部分区域有骨痂形成,但椎体或其它部位新增骨质破坏区,包括肋骨3例、胸椎2例、锁骨2例、胸骨1例和肩胛骨1例。肺门、纵隔及锁骨上窝淋巴结肿大(图4b)14例(77.8%)。1例纵隔淋巴结多发增大并累及食管和气管,导致食管-纵隔瘘、气管-纵隔瘘及纵隔与前胸壁间窦道形成。
5例PET-CT示两肺多发结节、肿块或实变影,18FDG摄取均升高(图4a),SUVmax值为5.8~20.3,平均13.74±6.42。
讨 论
马尔尼菲蓝状菌(TM)是迄今所发现的惟一能使人类致病的双相菌[13],在25℃时呈青霉相(传播相),镜下见典型帚状枝和菌丝;在37℃时呈酵母相(致病相),镜下见光滑卵圆形孢子。TM通过呼吸道、消化道以及破损的皮肤侵入人体后,以具有致病力的酵母相感染宿主细胞。TSM好发于HIV阳性或阴性但免疫力低下的人群。近年来,TSM在免疫功能正常宿主中的发病率逐渐上升,但有关免疫功能正常TSM患者的影像表现的文献报道极少。
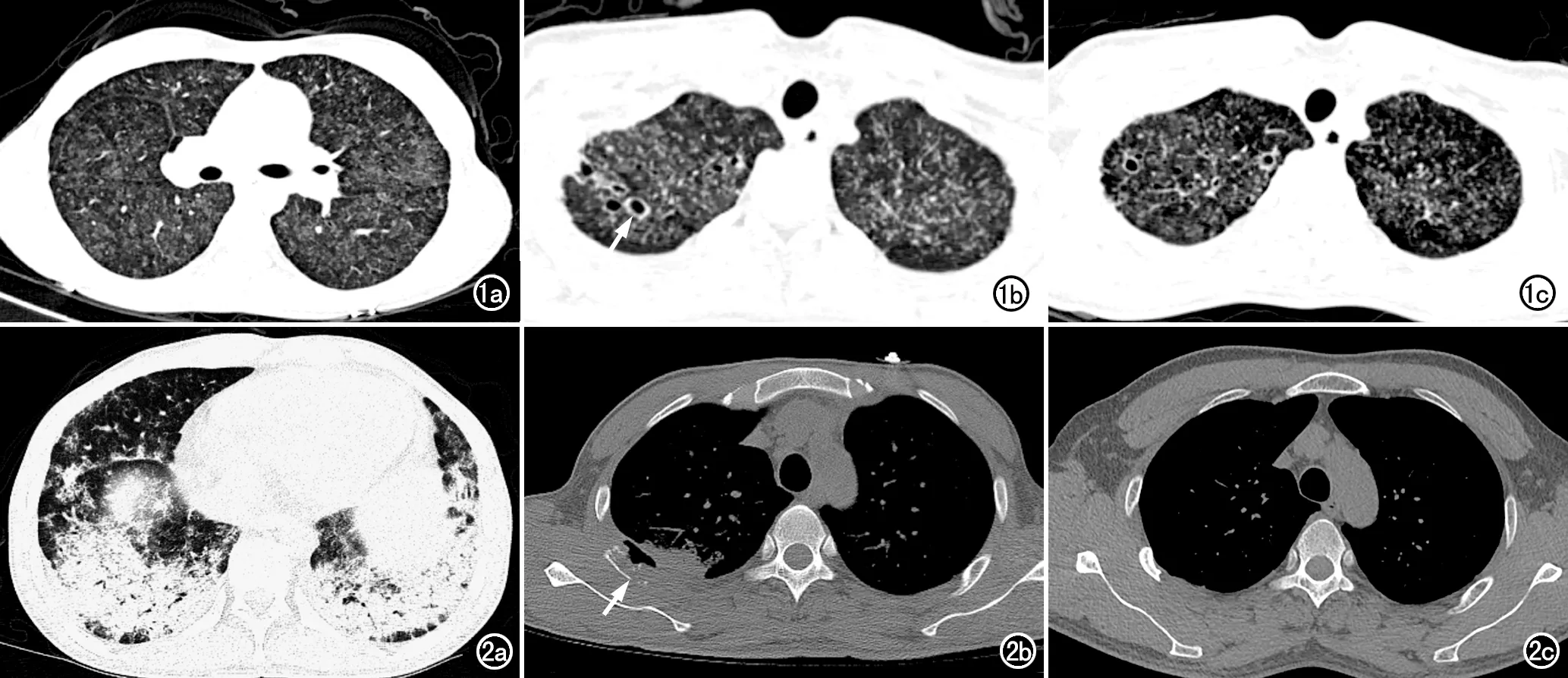
图1 女,24岁,咳嗽、胸痛伴消瘦4月余。a)CT显示两肺弥漫多发粟粒影,散在分布的磨玻璃密度影和实性小结节;b)CT显示右上肺厚壁小空洞(箭);c)CT显示两上肺局部小叶间隔增厚。 图2 男,45岁,咳嗽、发热伴胸痛20余天。a)CT显示两肺多发实变;b)CT骨窗图像显示右侧第4肋骨破坏(箭)并软组织内积气;c)治疗后CT骨窗图像显示右侧肋骨肋骨基本修复。
1.免疫功能正常者TSM临床表现及实验室指标
TSM主要发生在东南亚和我国南部[14],本组18例患者均为广东或广西人,与文献报道相符合。有文献报道HIV阳性TSM以青年男性为主,HIV阴性TSM以40岁左右中年人为主[5],而本组病例年龄18~62岁,平均48岁,其中男性12例(66.7%),推测免疫正常的TSM可能以中年男性多见,尚需大样本资料证实。文献报道机体免疫状态不同,TSM的临床表现、实验室检查结果也有所不同[15]。健康宿主感染TM后引起全身严重炎症反应;表现为反复高热、持续的白细胞及中性粒细胞显著增高,伴血沉显著增高,导致严重进行性消耗如体重下降、严重低蛋白血症等[16]。本组病例临床表现以咳嗽(占88.9%)、发热(33.3%)、消瘦(38.9%)为主;伴白细胞(66.7%)、中性粒细胞(77.8%)、血沉升高(88.9%)及血红蛋白减低(88.9%)。可见免疫功能正常的TSM是一种似恶病质的损耗严重的感染性疾病,机体反应强烈。皮肤损害是免疫功能正常TSM的临床特征之一,主要与宿主体内特异性体液免疫聚集中性粒细胞释放溶酶清除TM引起的化脓性反应有关[16-17],本组出现5例(27.8%),主要表现为全身大小不一皮肤包块、皮疹、红斑及溃疡;以胸腹、四肢、背部、颈部多见。(1,3)-β-D葡聚糖定量检测阳性有助于深部真菌感染的诊断,有学者报道一组大样本HIV阳性合并TSM行(1,3)-β-D葡聚糖定量检测,阴性率为21.95%[18]。而本组18例免疫功能正常TSM患者行(1,3)-β-D 葡聚糖定量检测,13例阴性,阴性率为72.2%,表明其阴性率可能高于HIV阳性TSM。
2.免疫功能正常宿主TSM的胸部影像特征

图3 女,27岁,全身多发性皮疹、溃疡1月余。a)CT显示左上肺肿块伴两肺散在结节影;b)增强扫描纵隔窗示左上肺肿块不均匀强化,其内见片状低密度影;c)病理图镜下示肺泡腔内大量组织细胞,胞浆大量菌样颗粒,体积小,呈空泡状或腊肠状,偶见横隔孢子样结构,间质纤维化伴大量炎细胞浸润(×400,HE)。图4 女,48岁,咳嗽、胸痛1月余。a) PET-CT显示右上肺实变影,SUVmax值约20.3; b) PET-CT显示隆突下可见肿大淋巴结。
本组所有病例均为两肺发病,具体特征如下:①多发散在或弥漫性病变,累及多个肺叶和肺段,病灶常为多形态并存。②以多发粟粒及小结节影(38.9%)、片状实变影(33.3%)多见,肿块伴结节影(16.7%)、斑片及条索影(11.1%)少见,这与黄双双等[12]认为病灶以斑片浸润或肿块影为主不同,可能与其研究样本量较少有关。此外文献[7]报道AIDS并TSM患者肺部病灶以单纯的粟粒影(48.1%)多见,片状实变影少见(13.5%),而本组研究中不仅实变影多见,而且粟粒影常夹杂、合并散在磨玻璃密度和/或实性的结节影,上肺多于下肺,部分沿支气管血管束分布,未见单纯粟粒影病例,此征象为免疫功能正常者与HIV阳性者的不同点之一。③肺间质性病变多见(50%),以小叶间隔增厚及支气管血管束增粗为主,以往文献中均未见支气管血管束增粗的报道,而本组有2例出现,笔者发现其中1例是因纵隔淋巴结病变累及食管、气管,导致食管-纵隔瘘、气管-纵隔瘘,致使纵隔内炎症累及广泛,累及两侧肺门旁的支气管血管束时表现为明显增粗。④空洞性病变多见(33.3%),以单肺多发厚壁小空洞为主,且分布部位多见于上肺尖、后段(66.7%)。与余成成等[17]报道的AIDS合并TSM的空洞表现相符,表明单侧上肺多发厚壁小空洞可能是TSM肺炎的特点;此外,本研究中病灶内小空洞常呈聚集性,笔者推测聚集性小空洞是免疫正常TSM的另一特点。⑤气管性病变少见(27.8%),其中支气管扩张少见。在以往的文献中,无论是HIV阳性[7,19]或是HIV阴性[1]但免疫低下者,支气管扩张的发生率均较低,本组仅4例出现。笔者从影像表现和病史上分析这4例是在支气管扩张的基础上合并了TM的感染,并非TM感染所造成支气管扩张;或者说因为支气管扩张的存在,使患者更容易出现TSM。气管狭窄更少见,本组仅见1例,表现为右中下肺气道壁增厚、阻塞,与国外文献报道相符[20]。推测患者吸入TM后因重力因素在气道内种植、播散。⑥两肺门、纵隔及锁骨上窝淋巴结肿大常见(77.8%),纵隔淋巴结分布以气管隆突下(7区)为主,与文献报道一致[19]。提示此处可能为TM大量繁殖的中转站;增强扫描显示12例患者(12/14)的肿大淋巴结密度均匀、无坏死;而2例(2/14)淋巴结呈中心坏死的厚壁环形强化,边缘模糊,部分融合,坏死区可相互交通。⑦肺毁损极罕见,本组仅1例,以往文献亦未见报道。笔者推测原因可能为未能在疾病早期明确诊断而延误治疗导致的疾病晚期表现,严重者可突破胸腔而表现为反复脓胸[11];或因为患者以往存在肺毁损病史,在其基础上并发TM感染。由于病例数较少,有待进一步研究。⑧浆膜腔积液多见,包括胸腔积液(44.4%)及心包积液(22.2%),而AIDS合并TSM出现胸腔积液少见[7,21],提示TSM侵犯浆膜更多见于免疫功能正常者。⑨骨质破坏(38.9%)多见,表现为溶骨性破坏伴周围软组织肿胀,为免疫功能正常者TSM全身化脓性反应之一。溶骨性病变只见于免疫功能正常患者,最常见的部位是椎骨和股骨、肋骨[22,23]。本组出现骨质破坏7例,4例多发,3例单发,以肋骨、锁骨及胸椎破坏多见,与文献报道基本相符。在治疗中行CT随访,笔者发现71.4%患者骨质破坏区出现骨质增生、修复,而同时其它部位可新增骨质破坏区,呈游走性、反复性骨质破坏-骨质修复的特点。笔者发现这种可逆性溶骨性破坏在以往文献中均未提及,其与恶性骨肿瘤不断进展、侵袭的不可逆性骨质破坏不同,可作为免疫功能正常TSM与其它恶性肿瘤所致溶骨性破坏的鉴别特征之一。⑩肺部病灶在PET-CT上表现为18FDG摄取明显升高,本组5例患者两肺病灶的SUVmax为5.8~20.3,平均为13.74±6.42;表明受到TM侵犯的宿主,细胞增殖、代谢旺盛,糖酵解活动增加,机体损耗较高。
3.鉴别诊断
本病絮语以下基本鉴别。①肺结核:继发性肺结核好发部位为两上肺尖、后段以及两下肺背段,典型病灶可见树芽征及烟花征[24],淋巴结钙化及环形强化;粟粒性结核呈三均匀分布[25],近肺尖区病灶较多。②肺癌:可见典型分叶、毛刺,支气管截断或扭曲、僵硬。③肺黏膜相关淋巴瘤:胸膜下肿块或实变,边清,内见支气管扩张及血管造影征[26]。④其它常见真菌感染:支扩及空洞更常见,典型病灶边缘见晕征,内见半月征及空洞分隔征[27]。
综上所述,免疫功能正常者TSM胸部病灶常以多形态并存,累及多个肺叶、肺段,CT表现主要为两肺多发粟粒、结节、肿块或片状实变影,常伴小叶间隔增厚、厚壁小空洞、淋巴结肿大及浆膜腔积液;多伴骨质破坏,且破坏区可有骨质增生、修复改变。虽然影像表现复杂多样,但也具有一定特征性,再结合SUVmax明显升高、临床及实验室指标的检查,应考虑到TSM的可能性,并及时进行真菌培养或活检以明确诊断。
