浒苔多糖对ETEC 感染小鼠肠道黏膜损伤的保护作用及机制研究
2019-12-21谢春艳王海华台文静
解 影, 马 勇, 谢春艳 , 王海华, 台文静, 方 俊
(1.湖南农业大学生物科学技术学院湖南省猪场废弃物无害化处理与资源化利用工程研究中心,湖南长沙410128; 2.青岛海大生物集团有限公司,山东青岛266111)
浒苔 (Entermopha) 是中国东海岸常见的藻类,富含蛋白质、粗纤维和维生素等营养物质,具有丰富的食用和药用价值(Cui 等,2018)。 但近年来, 海洋生态恶化导致浒苔频繁爆发 (Xu 等,2015),造成养殖业和旅游业的巨大损失。因此,开发、利用浒苔或其提取物,使之变废为宝,对海洋生态平衡具有重要意义。 浒苔多糖(EP)是从浒苔中提取出的一种可溶性硫酸化杂多糖,具有抗炎、抗肿瘤、抗氧化及提高免疫(Wei,2014)等多种生物功能。研究表明,添加浒苔多糖可以促进小鼠肠道中双歧杆菌和乳酸菌的生长, 维持肠道菌群平衡,促进肠道健康(Shang 等,2018)。
肠道既是动物消化和吸收营养物质的主要场所,也是最大的免疫器官,在机体生长发育过程中至关重要(Wijtten 等,2011)。 产肠毒素大肠杆菌(ETEC)感染会导致肠道屏障损伤,造成畜牧业严重的经济损失(Hiqashi 等,2000),ETEC K88 感染可导致机体肠道损伤, 引起腹泻等症状(Gemma等,2014)。本试验以ETEC K88 感染小鼠为模型,研究浒苔多糖对小鼠肠道形态结构、 肠道屏障及血清细胞因子水平的影响, 探讨浒苔多糖对肠道屏障的保护作用及机制, 为其作为饲料添加剂的应用提供理论依据。
1 材料与方法
1.1 试验材料 EP 购自青岛海大生物集团有限公司;ETEC K88 来自中国科学院亚热带生态研究所;Mouse IL-6 ELISA Kit(DKW12-2060-006)购自北京达科为生物技术有限公司;MouseTNF-α ELISA Kit (KE10002)购自美国Proteintech 公司;抗体β-actin (sc-47778) 购自Santa 公司;ZO-1(21773-1-AP) 购自Proteintech 公司;Claudin-1(ab129119)购自Abcam 公司;Occludin(66378-1-Ig)购自Proteintech 公司; NF-κB(6956)、Phospho-NF-κB(3033)购自Cell Signaling Technology公司;PIPA 蛋白裂解液、 磷酸酶抑制剂混合物C(50×)、PMSF (100 mM)、BCA 蛋白浓度测定试剂盒、5×Loading buffer 购自碧云天生物技术公司。
1.2 试验设计 选用30 只20 g 左右清洁级ICR雌性小鼠(购自湖南斯莱克景达实验动物有限公司)。饲养温度(24±1)℃,自然光照,自由采食和饮水。 小鼠随机分为5 组,每组6 只。 即:对照组、ETEC 模 型 组、300 mg/L EP+ETEC 组、600 mg/L EP+ETEC 组、1000 mg/L EP+ETEC 组。 对照组饲喂饮用水和普通日粮,EP 试验组在饮用水中添加相应剂量的浒苔多糖。小鼠每天自由饮食,空白对照组小鼠于试验第8 天连续灌胃无菌生理盐水3 d,其余四组灌胃等体积ETEC 菌悬液(浓度为5×109cfu/mL)。 每天观察小鼠的精神状态并记录小鼠体重和采食量,试验第14 天采样。
1.3 指标测定及方法
1.3.1 空肠形态学分析 将固定于福尔马林溶液中的空肠样品,常规脱水后石蜡包埋,切片后苏木精-伊红(HE)染色,显微镜下观察各组小鼠的空肠形态结构。 Shineso (杭州迅数) 显微图像分析系统进行拍照, 应用Motic 2.0 通用图像分析软件对图片进行分析处理,分别测量肠道绒毛高度、隐窝深度、并计算绒腺比(绒毛高度与隐窝深度的比值)。
1.3.2 血清中细胞因子的检测 ELISA 检测:按照ELISA 检测试剂盒说明书检测血清中IL-6 及TNF-α 的浓度。
1.3.3 空肠组织中的蛋白质制备与检测 空肠组织样研磨后加入适量PIPA 蛋白裂解液 (加入100 mM PMSF 和50×的磷酸酶抑制剂), 冰上充分裂解1 h,离心后BCA 法测定蛋白质浓度,加入Loading buffer 煮沸制样。 Western Blot 方法检测紧密连接蛋白ZO-1、Occludin、Claudin-1 及NFκB 和磷酸化NF-κB(p-NF-κB)的表达水平。
1.4 统计学分析 采用SPSS 20.0 进行试验数据的单因素方差分析(one-way ANOVA,LSD),Duncan 氏法多重比较检验,结果以“平均值±标准误”表示。 P <0.05 为差异显著。
2 结果与分析
2.1 浒苔多糖对小鼠平均日增重的影响 试验期间,ETEC 感染后小鼠精神萎靡、食欲下降且毛色暗淡。 感染ETEC 的小鼠在灌胃后的第三天状态均有所好转, 但ETEC 模型组中个别小鼠仍然有行动迟缓等症状, 第四天全部小鼠的精神及活动状态都恢复正常。 小鼠平均日增重如表1,灌胃前, 所有小鼠平均日增重无显著性差异 (P >0.05),灌胃后,模型组小鼠的平均日增重较对照组显著降低了65.85%(P <0.05)。

表1 浒苔多糖对小鼠平均日增重的影响 g
2.2 浒苔多糖对小鼠血清中细胞因子浓度的影响 由表2 可知,与空白对照组相比,ETEC 模型组IL-6 的浓度显著增高了73.68%(P <0.05);TNF-α 浓度无显著性差异 (P >0.05)。 与ETEC模型组相比, 添加600 mg/L 浒苔多糖组血清中IL-6 和TNF-α 的浓度显著降低(P <0.05),分别降低了56.69%和30.22%。

表2 浒苔多糖对小鼠血清中细胞因子浓度的影响pg/mL
2.3 浒苔多糖对小鼠空肠形态结构的影响 由表3 可知, 对小鼠空肠形态学进行观察和统计学分析,ETEC 模型组的空肠绒毛顶端上皮细胞脱落严重,隐窝变浅。 相比ETEC 模型组,添加600 mg/L 浒苔多糖组绒毛高度、隐窝深度和绒腺比分别提高13.78%、46.55%和55.5%(P <0.05)。 与空白对照组相比, 添加600 mg/L 浒苔多糖对肠道绒毛高度和隐窝深度影响不显著 (P >0.05),但绒腺比显著提高了45.68% (P <0.05)。而添加1000 mg/L 浒苔多糖对肠道黏膜形态无显著作用。 说明添加600 mg/L 浒苔多糖不仅可以缓解ETEC 感染导致的肠道损伤, 且有助于促进肠道形态的发育。
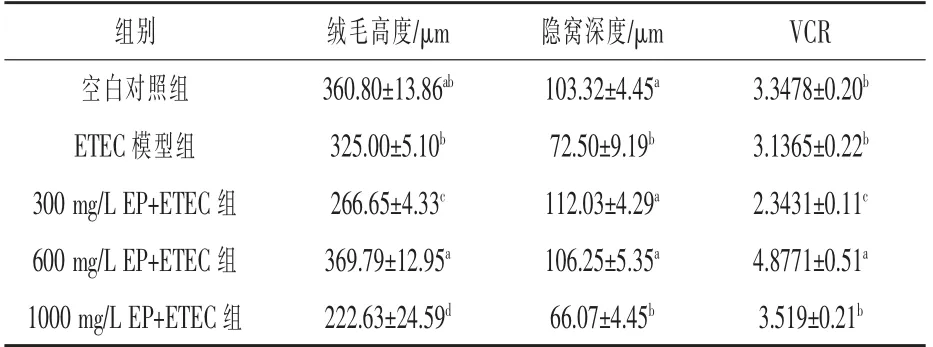
表3 浒苔多糖对小鼠空肠形态结构的影响
2.4 浒苔多糖对空肠NF-κB 及紧密连接蛋白表达的影响 由表4 可知, 与空白对照组和ETEC模型组相比, 添加300 mg/L 浒苔多糖组NF-κB表达分别显著上调了88.89%和82.14%,p-NFκB 表达均上调73.33%(P <0.05),添加600 mg/L浒苔多糖组NF-κB 表达分别显著上调了140.74%和132.14%,p-NF-κB 表达均上调80%(P <0.05), 添加1000 mg/L 浒苔多糖使NF-κB表达显著上升(P <0.05),但对磷酸化NF-κB 无显著影响(P >0.05)。小鼠空肠中的紧密连接蛋白Occludin、ZO-1 及Claudin-1 的表达结果表明,相比ETEC 模型组,添加300 mg/L 浒苔多糖组小鼠空肠中的Occludin 表达显著上调28.09%(P <0.05),添加600 mg/L 浒苔多糖组Claudin-1 表达显著上调80%(P <0.05),而添加1000 mg/L 浒苔多糖组小鼠空肠组织中的ZO-1 表达显著上升28.85%(P <0.05)。

表4 浒苔多糖对空肠NF-κB及紧密连接蛋白表达的影响
3 讨论
肠道绒毛高度和隐窝深度的变化是引起屏障功能和吸收机能改变的主要原因之一(江昌盛等,2017)。 本研究中,ETEC K88 感染降低了小鼠空肠肠道绒毛高度和隐窝深度。 有研究表明,在饲粮中添加昆布多糖, 可提高K88 感染后仔猪小肠绒毛高度和绒腺比(吴涛,2017)。这与本研究中,添加浒苔多糖使小鼠空肠的绒毛高度、隐窝深度和绒腺比均得到相应提高的结果相同。说明浒苔多糖具有改善空肠绒毛形态,促进小肠消化吸收的功能。
紧密连接蛋白的表达与肠道屏障功能密切相关,其中ZOs、Occludin 和Claudins 被认为是通过结合肌动蛋白细胞骨架参与紧密连接结构完整性的主要整合膜蛋白(Turner,2009)。本研究中,K88攻毒后小鼠空肠Claudin-1 蛋白表达降低, 表明K88 导致肠黏膜损伤。 此结果与ETEC K88 在感染IPEC-1 单层细胞过程中, 下调紧密连接蛋白表达的结果一致(Wang,2017)。 综合以上研究结果, 说明浒苔多糖可调控肠道紧密连接蛋白的表达,改善肠道屏障的完整性。
IL-6 和TNF-α 是间接评价肠黏膜损伤和通透性受损的常见指标(Al-Sadi 等,2013)。 浒苔多糖粗提物可促进巨噬细胞RAW264.7 的增殖及TNF-α 和IL-6 的分泌,增强免疫调节功能(陈洁等,2015)。此外,海藻多糖中的硫酸多糖具有抑制TNF-α 表达、 缓解TNBS 诱导的大鼠肠道损伤的作用(Brito 等,2016)。 本研究中,添加浒苔多糖可显著降低血清中的TNF-α 和IL-6 水平, 说明其具有提高小鼠机体免疫功能的作用。
核转录因子(NF-κB)是细胞中维持机体正常生理功能的重要转录调节因子, 在病原及外界刺激下活化,进而调控多种基因的表达,产生细胞因子并参与炎症反应(Zhang 等,2018)。 已有研究表明, 激活NF-κB 信号通路可促使巨噬细胞产生IL-6,如ETEC 刺激上调IL-6 基因表达,并通过TLR4 触发NF-κB 通路产生炎症反应(Shimazu等,2012)。 也有研究表明,抑制NF-κB 的活化可降低小鼠血清中IL-6 的含量,激活NF-κB 可促进TNF-α 基因的转录(贾丽超等,2014)。 此外,植物多糖可通过调节NF-κB 信号通路, 缓解ETEC K88 感染导致的肠道炎症和黏膜损伤,从而达到改善肠道屏障功能的作用(Han 等,2016)。本研究中, 添加浒苔多糖使感染ETEC 的小鼠细胞因子分泌降低,但未使NF-κB 表达下调。 原因可能是:(1)ETEC 感染使TNF-α 在机体内激增,触动负反馈调节, 导致NF-κB 信号通路被阻断,抑制NF-κB 表达(王晓晨等,2014);(2)植物多糖可以促进巨噬细胞大量分泌细胞因子, 从而加快机体的免疫调节进程(高侃,2015);(3)添加浒苔多糖使机体更早进入炎症消退期初期, 血清中细胞因子含量降低,但肠道中NF-κB 表达趋势尚未改变。综合本研究结果表明,浒苔多糖可调节肠道紧密连接蛋白的表达及炎性因子的分泌, 达到保护肠道屏障的作用, 且作用机制与浒苔多糖对NF-κB 信号通路的影响相关,但其具体作用机制还有待进一步研究。
4 结论
饮水中添加浒苔多糖可以改善ETEC K88 感染后小鼠空肠绒毛形态,上调紧密连接蛋白表达,改善肠道黏膜屏障的完整性, 从而保护动物肠道健康,且在饮用水中添加600 mg/L 剂量的条件下保护效果较为显著。
