饲用粪肠球菌EXW27 培养条件的响应面优化
2019-12-21郭建军熊大维魏国汶杜建华
郭建军, 熊大维, 曾 静, 魏国汶, 杜建华, 袁 林*
(1.江西省科学院微生物研究所,江西南昌330096;2. 南昌工学院,江西南昌330108)
粪肠球菌(Enterococcus faecalis)又叫粪链球菌,是属于肠球菌属的一种兼性厌氧型乳酸菌,细胞呈圆形或椭圆形,成双或短链状排列,对环境适应力和抵抗力强(张艳萍等,2016), 可耐受四环素、卡那霉素、庆大霉素等多种抗生素,农业部将粪肠球菌列入《饲料添加剂品种目录(2013)》,适用于养殖动物(张娟等,2019)。粪肠球菌繁殖速度快、能产生多种抗菌物质,如细菌素、有机酸、抗菌肽等对肠道中的沙门氏菌、 大肠杆菌等致病菌具有良好的抑制作用(宝冠媛等,2015),激活肠道的免疫功能或刺激机体的免疫系统 (Al Atya 等,2015);粪肠球菌在动物消化道内生长增殖过程中会产生活性物质,如维生素和消化酶,能提高机体的消化功能,促进动物对饲料的利用,有效调节肠道微生态平衡,促进动物生长,提高动物的生产性能(张群等,2016)。
影响菌株生产能力的因素不仅包括菌种本身的生理性能,还有外界合适的环境条件,所以通过优化菌株的培养条件可改进发酵过程。 白文妹等(2017) 对金丝猴源益生粪肠球菌dlt7a 的发酵工艺进行优化,活菌数可达5.883×109cfu/mL;焦月华等(2016)研究有氧呼吸条件下粪肠球菌LD33高密度增殖中发现, 在进行有氧呼吸代谢时能够显著提高粪肠球菌生物量和存活率; 但每种菌株的生长特性不同, 菌株在发酵培养基中的繁殖力各异, 生产中需要针对每种菌株进行培养条件的优化,以提高菌株发酵的活菌数。本课题组从健康仔猪肠道黏膜上分离到一株具有良好益生特性和安全性粪肠球菌EXW27, 通过Plackett-Burman试验和响应面试验对该菌株摇瓶发酵培养条件进行优化,提高其在发酵培养过程中的活菌数,确定高密度培养工艺, 以期为后期大规模工业化生产优质的微生态制剂奠定工艺基础。
1 材料与方法
1.1 试验材料 供试菌株: 粪肠球菌EXW27 由本课题组从健康仔猪肠道黏膜上筛选得到, 具有优良的益生潜力。
发酵培养基:蔗糖50 g、蛋白胨30 g、酵母粉9.0 g、 柠檬酸氢二铵3.5 g、K2HPO4·7H2O 3.75 g、NaAc·3H2O 6.25 g、MgSO4·7H2O 1.0 g、MnSO4·H2O 0.45 g、组氨酸1.4 g、碳酸钙10 g、去离子水定容至1000 mL,115 ℃灭菌20 min。
1.2 试验方法
1.2.1 菌体培养 菌种活化: 将保存的粪肠球菌EXW27 接种至MRS 斜面培养基上活化,37 ℃恒温培养24 h, 连续转接活化两次; 再用接种环刮取两环接种至液体MRS 培养基中, 于37 ℃、120 r/min 培养10 h 作为种子菌液。
摇瓶发酵培养: 在三角瓶中装入发酵培养基后灭菌,无菌条件下向三角瓶内接入种子菌液;初始发酵培养条件为:250 mL 三角瓶装100 mL 培养基,接种量5%,初始pH 6.8,37 ℃,150 r/min,摇瓶培养20 h。
活菌含量测定:计数方法采用固体MRS 倾注法,取100 μL 发酵液液加入900 μL 灭菌生理盐水中,依次做10 倍稀释,选取3 个适宜的连续稀释倍数进行平板计数,每个稀释度做3 个平行。
1.2.2 单因素试验选取因素水平 本试验对粪肠球菌发酵过程中培养基的初始pH、接种量、培养温度、装液量、转速5 个因素进行了单因素试验,分别设置了不同梯度, 通过测定发酵培养液的菌株EXW27 活菌含量选取最适的单因素水平。
1.2.3 Plackett-Burman 试验 在单因素试验的基础上, 选取可能影响粪肠球菌发酵培养活菌含量的6 个因素:装液量、初始pH、温度、摇床转速、接种量、培养时间,采用Design-Expert 8.0.6 软件的Plackett-Burman 试验设计对上述因素进行研究, 筛选出其中对粪肠球菌发酵液活菌含量具有显著性影响作用的因素。
1.2.4 最陡爬坡试验 根据Plackett-Burman 设计的各因素水平及效应评价, 分析出影响肠球菌发酵液活菌含量关键因素, 并确定关键因子的爬坡方向和变化步长,进行最陡爬坡试验,使关键因素浓度最大限度靠近响应值极大区, 找出发酵液活菌含量的发酵条件,即为响应面分析的中心点。
1.2.5 响应面试验 由最陡爬坡试验确定接近响应面区域显著因素的具体浓度, 利用Box-Bohnken( BBD)与响应面分析相结合,以粪肠球菌发酵液活菌含量作为响应值, 以Plackett-Burman 试验确定的3 个显著因素为自变量, 以最陡爬坡试验确定的因素最佳水平作为中心点进行3因素3 水平试验,用DesignExpert 8.0.6 软件通过试验数据拟合得到二阶响应面模型, 最终确定最优试验条件。
1.2.6 验证试验 用所得到的最佳培养条件进行3 次平行试验,取平均值,以验证模型是否可靠,进而得出最终优化结果。
2 结果分析
2.1 粪肠球菌菌体生长曲线 以培养时间为横坐标,OD600nm值、pH 及活菌含量为纵坐标, 绘制粪肠球菌的生长曲线,结果如图1 所示。

图1 粪肠球菌EXW27 生长曲线
由图1 可知, 粪肠球菌在接种后0 ~5 h 处于迟滞期,菌体缓慢生长,此时,随着菌体的生长,菌液的pH 开始下降,说明菌体发酵开始产酸;在6 ~14 h 处于对数生长时期,菌体生长迅速,同时pH 下降速率较慢, 说明在此时期菌体产酸较少;当培养14 ~18 h,pH 趋于平稳, 进入稳定期,菌体生长速率保持平稳。 18 h 之后,活菌含量出现下降,OD600nm值处于平稳状态, 但活菌含量开始缓慢减少,说明菌体生长进入到了衰亡期;在生长过程中pH 不断降低, 说明整个过程在不断的产酸,代谢物酸浓度累积到一定量时,开始抑制菌体生长,因此将优化试验的发酵时间设为18 h。
2.2 单因素试验结果 不同因素对粪肠球菌活菌浓度的影响见表1。培养基中pH 会影响细胞代谢酶活性和营养物质的离子化程度, 进而影响微生物生长代谢。 起始pH 不同的培养基培养后,粪肠球菌活菌数随着初始pH 的升高, 呈现先增加后减少的总体趋势,在初始pH 为7.0 时,活菌生物量最多; 不同接种量培养后活菌数存在较大的差异,当接种量为6%时,菌体活菌含量明显高于其他组;当在不同温度条件下培养18 h,发现在36 ℃培养时活菌含量达到最大值1.13×1010cfu/mL,这可能是由于温度过低,酶活性受抑制, 酶促反应迟缓, 导致菌体生长和代谢缓慢,但当温度过高时,抑制细菌的生长,甚至不利于菌株的存活。

表1 不同因素对粪肠球菌培养活菌浓度的影响
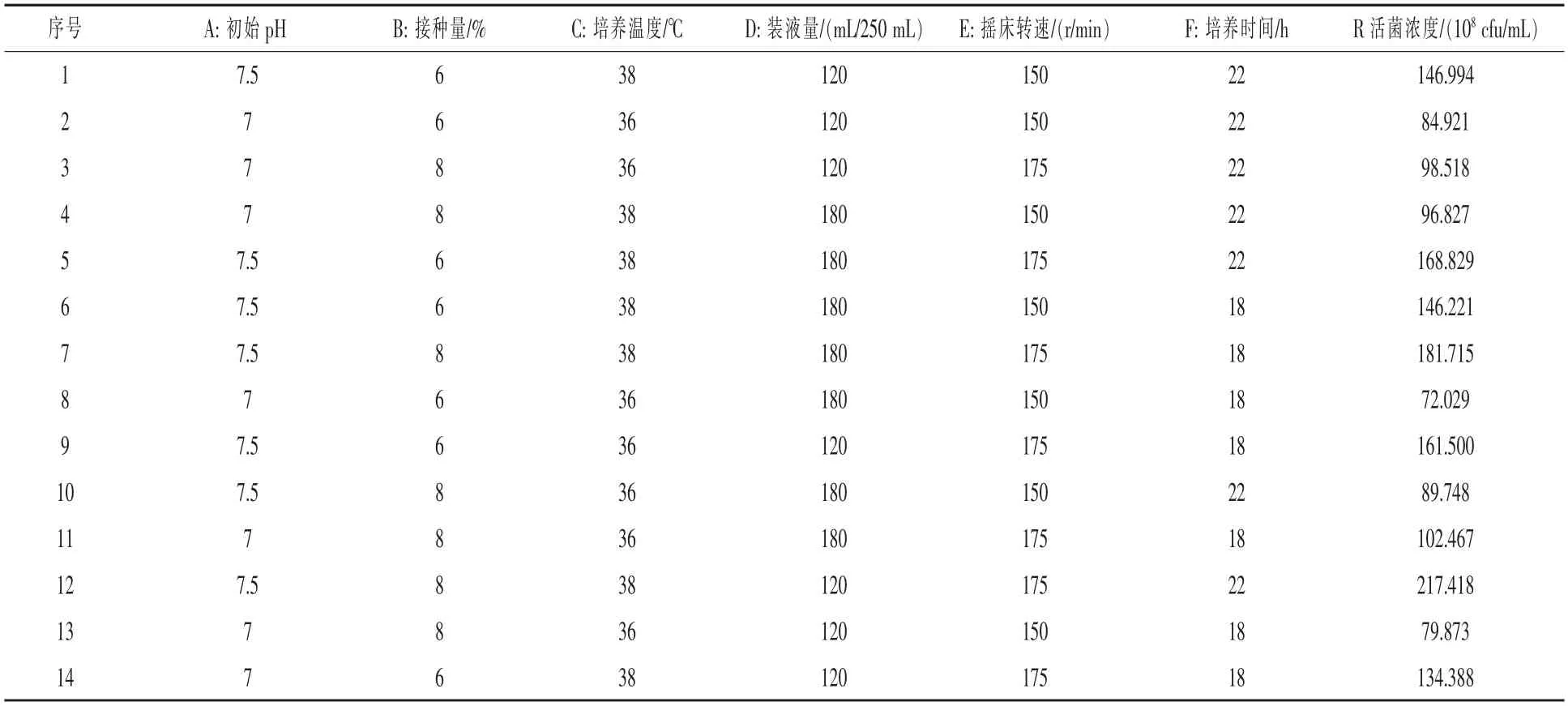
表2 Plackett-Burman 试验设计及结果
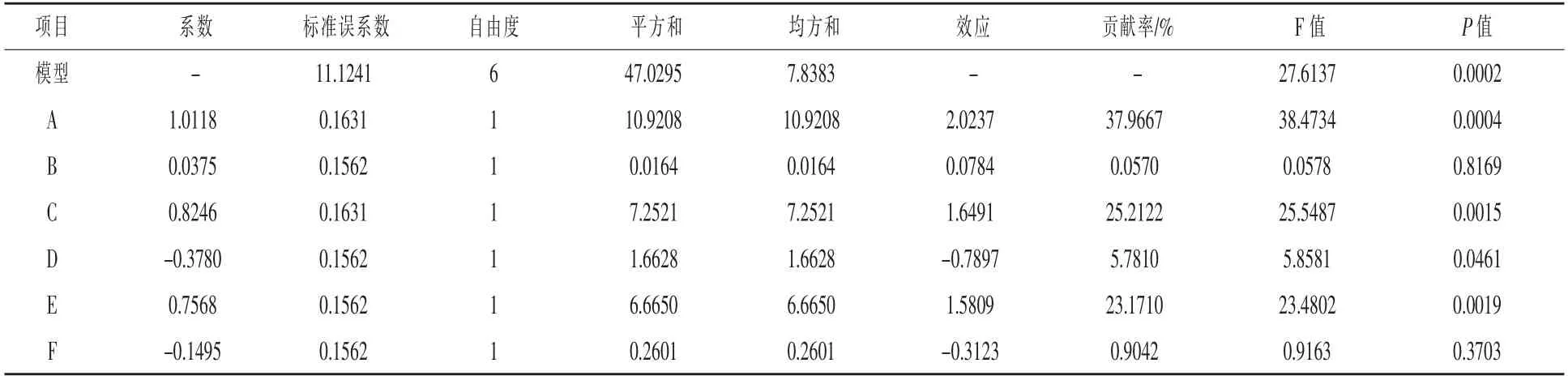
表3 Plackett-Burman 试验方差分析
粪肠球菌是一种兼性厌氧的乳酸菌, 低的装液量使得液体培养基中溶解氧升高,不适于菌体生长繁殖和代谢的要求。从表1 可以看出,在250 mL三角瓶中分别装入60、90、120、150、180 mL 发酵培养基的变化过程中,乳酸菌活菌含量有一个明显的先增加后减少的趋势,当装液量为120 mL 时,活菌浓度达到最大值; 当摇床转速由75 r/min 增加到200 r/min 时, 活菌含量先增加后下降, 当转速为150 r/min 时活菌含量达到最大值。
2.3 Plackett-Burman 试验筛选发酵的重要因素在上述单因素试验的基础上,将发酵培养条件(初始pH、接种量、培养温度、装液量、转速、培养时间)分别作为PB 试验设计中的6 个优化因素A、B、C、D、E、F,选用n=14 的PB 试验设计,每个因素分别取2 个水平,通过不同组合观察发酵液中的EXW27 菌株活菌含量,结果见表2。PB 设计的各因素水平及效应评价见表3,从表3 可以看出,在EXW27 菌株发酵培养过程中,初始pH、培养温度、 摇床转速对试验结果的影响,P 均小于0.01,达到极显著水平;试验中模型的决定系数R2为95.94%,其校正后的决定系数R2adj为92.47%,不能由此模式解释的基本不足10%, 结果可信。因此确定初始pH、培养温度、摇床转速作为下一步试验的关键因素。 其他因素的取值可以根据各因素效应的正负和大小,正效应的因素取较高值,负效应的因素取较低值。
2.4 最陡爬坡试验结果 根据Plackett-Burman试验结果及显著性分析结果, 设定3 个显著性影响因素的方向与步长, 具体试验设计及结果如表4。 由表4 可知, 第3 组发酵培养条件对应的EXW27 菌株活菌含量为最高值, 故以初始pH 7.5、培养温度38℃、摇床转速200 r/min(第3 组的条件)作为中心点,进行响应面分析。
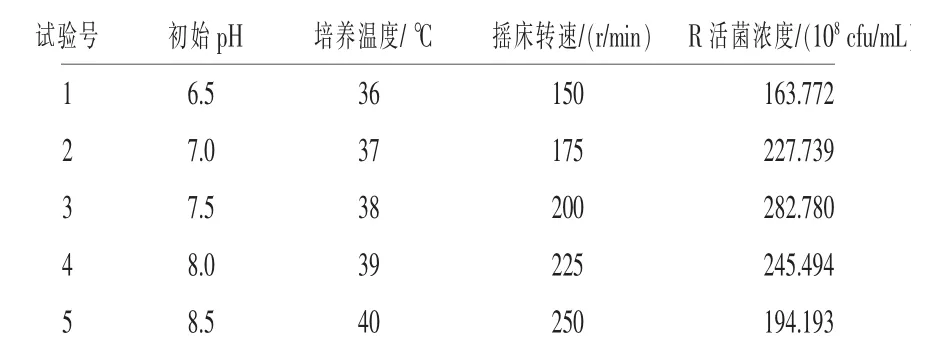
表4 最陡爬坡试验设计与结果
2.5 响应面试验优化发酵培养条件 以初始pH 7.5、培养温度38 ℃、摇床转速200 r/min 为影响因素,以菌株EXW27 活菌数(R)为响应值,通过Design-Expert.8.0.6 的Box-Behnken 中 心 组 合 设计对菌株EXW27 的培养条件设计了3 因素3 水平试验,试验设计与结果见表5。
采用Design-Expert 软件对试验数据进行ANOVA 分析, 各因素经过拟合得到的二次多项式回归模型方程为:
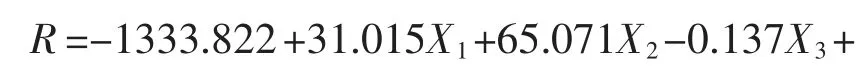

表5 响应面分析试验设计与结果
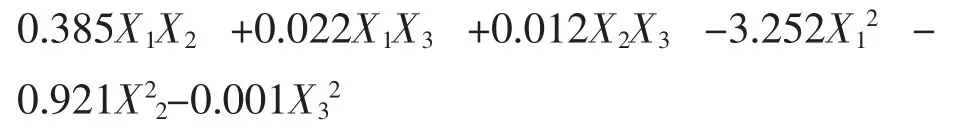
该二次多项模型及其各项的方差分析结果见表6。 由表6 可以看出, 模型F 值=208.932,P <0.0001,说明该回归方程是极显著的;失拟项不显著 (P=0.1759>0.05), 表明回归方程具有显著意义。回归模型的相关系数R2=99.52%,说明该模型与实际情况拟合程度较好, 试验设计可靠, 仅有0.48%的变异不能由此模型解释, 故可以用该模型对菌株EXW27 不同培养条件下的生长情况进行分析和预测。
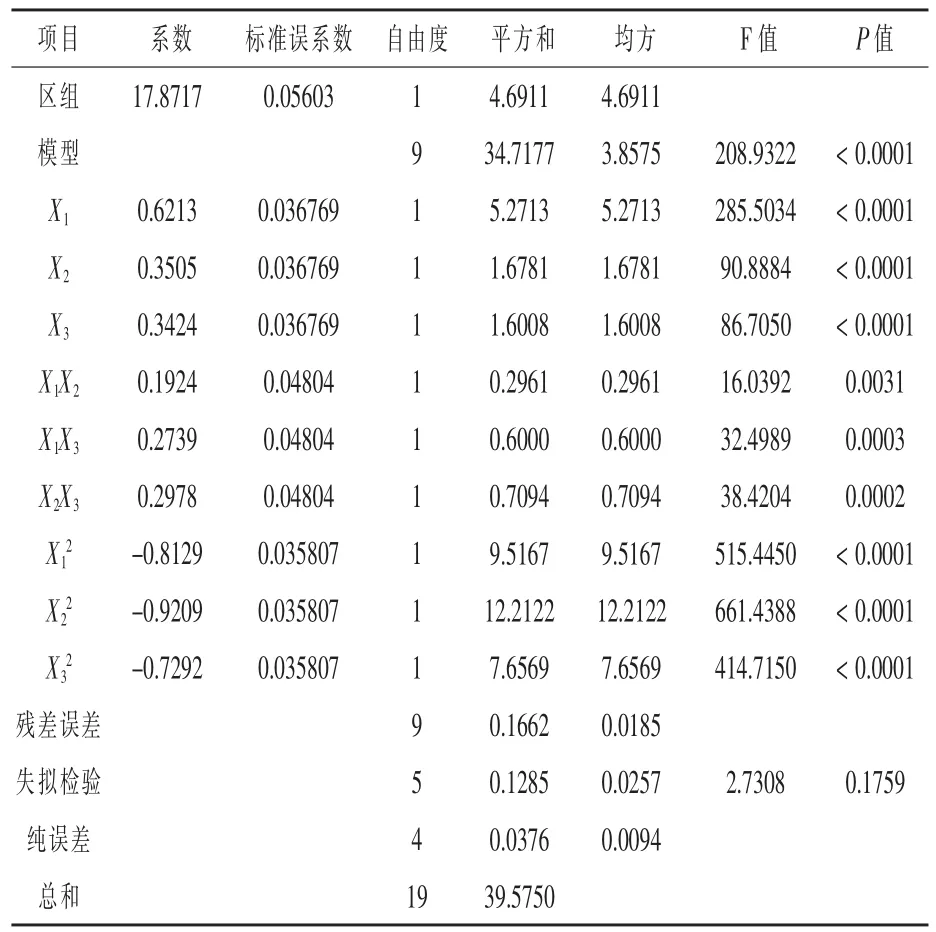
表6 回归模型方差分析
为综合考察交互项对菌株EXW27 活菌数的影响,对表2 数据进行回归拟合和响应面回归分析绘出响应面图形,结果见图2。 由图2 可知,摇床转速、初始pH、装液量对菌株EXW27 活菌数影响均呈抛物面型关系, 且响应面均存在一个极大值点,其中培养温度和摇床转速之间的交互作用最为显著,这一结果与回归方程的交互项显著性分析结果相符。 对回归方程进行分析,得到各个因素的最佳发酵培养条件为初始pH 7.74、培养温度38.32 ℃、摇床转速209.7 r/min, 在该条件下获得的菌株EXW27 活菌数理论值为3.29×1010cfu/mL。

图2 培养温度、初始pH 及转速对菌株EXW27 活菌数影响的等高线和响应面图
2.6 最佳摇瓶发酵工艺条件的验证 在预测出最佳工艺条件的基础上, 考虑到实际操作中的简便性等问题将该条件修正为:初始pH 7.7、培养温度38.3 ℃、 装液量120 mL/250 mL、 接种量6%、摇床转速210 r/min、培养时间18 h,在此工艺条件下进行3 次平行试验, 得到该乳酸菌菌株EXW27 活菌数为3.18×1010cfu/mL, 验证值和模拟值较为接近, 说明采用响应面法得到的该模型结果较为可靠, 拥有一定实用价值。 与初始发酵培养条件活菌数1.01×1010cfu/mL 相比,优化后结果提高了3.14 倍。
3 结论与讨论
因每种菌株的生长特性不同, 菌株在发酵培养基中的繁殖力各异,这就要求在实际的生产中,针对不同的菌株优化其培养条件。 响应面法适合优化影响因素较多且各因素间关系较复杂的工艺,与正交设计试验相比,响应面法优化菌株的发酵条件,可以缩短试验用时,并且可以筛选理论上的最佳发酵条件, 与正交法相比更精确。 周英等(2012) 采用正交法优化的粪肠球菌F71 的最适pH 为9.0,最佳培养温度为35 ℃,较初始提高了54.6%。 白文妹等(2017)确定金丝猴源益生粪肠球菌dlt7a 最佳培养条件为装液量20%(50 mL/250 mL),接种量2%,培养基初始pH 6.5,在此条件下培养dlt7a 菌株, 活菌数可达5.88×109cfu/mL,比优化前提高了46.53%。莫海燕等(2013)优化的粪肠球菌ef-2 在最适初始pH 8.0,温度34 ℃,装液量20 mL/250 mL, 种龄20 h 等发酵条件下粪肠球菌的活菌数从初始的5.8×108cfu/mL 提高到6.7×109cfu/mL。 杜志琳等 (2015) 对粪肠球菌HEW-A152 的发酵工艺进行优化, 在种龄14 h,接种量5%,转速120 r/min 等条件下发酵18 h 时HEW-A152 菌株活菌数达140×108cfu/mL。
本试验结果表明, 菌株EXW27 最佳发酵培养条件为:初始pH 7.7、培养温度38.3℃、装液量120 mL/250 mL、接种量6%、摇床转速210 r/min、培养时间18 h,在此条件下,菌株EXW27 的活菌数为3.18×1010cfu/mL, 比优化前提高了3 倍多。本试验研究了粪肠球菌EXW27 的最佳培养条件,明确其发酵代谢途径中的一些规律,可为其工业深层发酵提供理论基础。关于该菌的中试发酵,有待于进一步研究。
