基于非标记蛋白质组学技术筛选影响察哈尔羊肌肉品质的重要分子标记
2019-12-19谢遇春奈日乐杨峰马丽娜米璐车天宇郭俊涛苏馨赵存王志新李金泉刘志红
谢遇春 奈日乐 杨峰 马丽娜 米璐 车天宇 郭俊涛 苏馨 赵存 王志新 李金泉 刘志红
摘 要:为研究察哈尔羊不同部位肌肉蛋白质组成差异及差异蛋白功能,通过数据信息依赖性获取与非标记蛋白组学定量技术,对察哈尔羊背最长肌和臀肌进行蛋白质鉴定和定量分析,并对其进行生物信息学分析。结果表明:察哈尔羊背最长肌和臀肌肌肉中共检测到蛋白质1 073 个,筛选出差异蛋白140 个,其中背最长肌中高表达差异蛋白116 个,低表达差异蛋白24 个;背最长肌中高表达差异蛋白GO(gene ontology)功能富集分析结果表明,在细胞组分中,富集于细胞外外泌体中的蛋白质最多,其次富集于细胞膜内,在分子功能中,蛋白质主要参与分子内转移酶活性、RNA结合和L-乳酸脱氢酶活性过程,在生物学进程中,蛋白质主要参与碳水化合物代谢过程、肌节组织和肌肉收缩过程;通过差异蛋白的网络互作分析发现,肌纤维组成模块包括肌球蛋白-11(myosin-11,MYH11)、肌球蛋白-1(myosin-1,MYH1)、肌中线蛋白-1(myomesin-1,MYOM1)、肌球蛋白-2(myosin-2,MYH2)、肌球蛋白-8(myosin-8,MYH8)、肌球蛋白輕链激酶-2(myosin light chain kinase-2,MYLK2)、肌球蛋白轻链-2(myosin light chain 2,MYL2)、肌钙蛋白T-3(troponin T-3,TNNT3)、视松蛋白(telethonin,TCAP)和肌球蛋白结合蛋白C(myosin-binding protein C,MYBPC2)等蛋白质,肌球蛋白MYH1、MYH2、MYH8有望成为影响肉品质的重要分子标记。
关键词:背最长肌;臀肌;差异蛋白;高效液相色谱-质谱联用法;GO富集分析
Abstract: In order to study the difference in the protein compositions of different muscles in Chahar sheep and the functions of differential proteins, the identification and quantitative analysis of proteins in Longissimus dorsi and gluteal muscles of Chahar sheep were carried out using information dependent acquisition (IDA) and label-free proteomics based on sequential window acquisition of all theoretical mass spectra (SWATH). Then, bioinformatics analysis was performed. A total of 1 073 proteins were detected in the two muscles including 140 differential proteins. In total, 116 up-regulated and 24 down-regulated proteins were found in Longissimus dorsi. Gene ontology and pathway enrichment analysis showed that the up-regulated proteins were most abundant in the exosome followed by the cell membrane; they were mainly involved in the molecular functions of intramolecular transferase activity, RNA binding and L-lactate dehydrogenase as well as in the biological processes of carbohydrate metabolism, sarcomere and muscle contraction. The network interaction of these differential proteins showed that 11 protein modules were found, including myosin-11 (MYH11), myosin-1 (MYH1), myomesin-1 (MYOM1), myosin-2 (MYH2), myosin-8 (MYH8), myosin light chain kinase-2 (MYLK2), myosin light chain 2 (MYL2), troponin T-3 (TNNT3), telethonin (TCAP), myosin-binding protein C (MYBPC2). MYH1, MYH2 and MYH8 are expected to be important molecular markers affecting meat quality.
Keywords: Longissimus dorsi; Gluteus; differential protein; high performance liquid chromatography-mass spectrometry; GO analysis
DOI:10.7506/rlyj1001-8123-20190806-175
中图分类号:TS251.1 文献标志码:A 文章编号:
察哈尔羊生长于内蒙古锡林郭勒盟正镶白旗、镶黄旗和镶蓝旗地区,其母本为内蒙古地区的细毛羊,父本为德国进口的美利奴羊,是我国自上世纪90年代开始培育的肉毛兼用绵羊新品种[1-2]。察哈尔羊4~6 月龄生长较快,6~18 月龄日增体质量开始降低,其日增体质量最高可达166.17 g,产肉性能较高[3]。察哈尔羊羊肉肉嫩多汁,脂肪含量适中,必需脂肪酸亚油酸含量较高,具有较高的营养价值和保健作用[4]。蛋白质是肌肉的重要组成部分,其发生改变会引发肌肉质量的转变[5-6]。不同部位肌肉的理化特性及蛋白质组成不同[7]。肉色、系水力、肌内脂肪含量、pH值及嫩度等肉质评估标准会受到肌纤维类型及比例的影响[8-10]。已有研究表明,Ⅰ型及Ⅱa型肌纤维数量越高,肌肉质量越好[11],相反地,Ⅱb(Ⅱx)型肌纤维含量越高,肉质越差[12-14],即肌纤维类型和比例不同最终会影响肌肉品质。SWATH(sequential window acquisition of all theoretical)非标记蛋白组学定量技术是一种利用液相色谱-串联质谱建立的快速、独立的数据采集方法,允许完整和永久地记录生物样体中肽前体中所有可检测的碎片离子[15-16]。这项技术已经成功应用于比较猪肉背最长肌和腰大肌之间的蛋白质组差异[17]。
肌肉中的蛋白质变化会导致肉类质量的变化。羊肉中不同部位肌肉的理化性质和蛋白质组成存在差异,但相关研究较少。有关肌肉质量的研究多集中在感官、理化(嫩度、pH值、多汁性等)性质及营养成分等方面[18-19],对不同部位肌肉质量功能的直接体现者,即肌肉蛋白质组成报道极少。
本研究从蛋白质组学角度出发,运用高效液相色谱-质谱联用法研究察哈尔羊不同部位肌肉的蛋白质组成差异,并且以肌纤维类型对肉质的影响为基础,寻找不同部位肌肉中影响肉品质的肌纤维结构蛋白,对其功能进行分析,为寻找察哈尔羊肌肉品质相关的分子标记提供参考。
1 材料与方法
1.1 材料与试剂
实验样本由同一放牧条件下生长状况良好的3 只6 月龄察哈尔公羊作为生物重复,分别采集3 只羊的背最长肌和臀肌。
蛋白裂解液、尿素、胰蛋白酶、碘乙酰胺、二硫苏糖醇、碳酸氢铵 美国赛默飞世尔公司;BCA蛋白浓度测定试剂盒 北京碧云天生物科技有限公司。
1.2 仪器与设备
-80 ℃冰箱 海尔集团公司;98-111N超声粉碎仪 宁波新芝生物科技股份有限公司;Z323K低温离心机 德国Hermle公司;QT-901涡旋仪 海门市其林贝尔仪器制造有限公司;Eksigent nanol 400液相色谱仪、TOF-5600质谱仪 美国AB Sciex公司。
1.3 方法
1.3.1 总蛋白提取
將肌肉样本于液氮中研磨成粉末后,取0.8 g于离心管中,加入1 g/100 mL十二烷基硫酸钠裂解液,每隔1 min在涡旋仪上涡旋30 s,20 min后结束;将样品用超声仪破碎2 min后,4 ℃、12 000 r/min离心30 min,取上清;使用BCA蛋白浓度测定试剂盒进行总蛋白浓度测定。
1.3.2 总蛋白酶解
取蛋白含量100 ?g的样品,加入200 ?L 8 mol/L尿素、10 mmol/L二硫苏糖醇的混合溶液,37 ℃变性1 h,12 000 r/min离心40 min,加入200 ?L尿素,振荡、12 000 r/min离心30 min,重复2 次;加入200 ?L 50 mmol/L碘乙酰胺避光反应30 min,12 000 r/min离心30 min;加入100 ?L 100 mmol/L碳酸氢铵,12 000 r/min离心20 min,重复3 次;加入适量胰酶37 ℃孵育过夜,12 000 r/min离心30 min;加入50 ?L 100 mmol/L碳酸氢铵,12 000 r/min离心30 min,重复2 次;收集滤液,冻干,备用。
1.3.3 总蛋白鉴定
用50 ?L体积分数2%乙腈水溶液复溶酶解后的冻干粉,利用数据信息依赖性获取(information dependent acquisition,IDA)与SWATH方法上机鉴定总蛋白与差异蛋白。离子源:IDA扫描正离子模式,喷雾电压2.3 kV,离子源温度150 ℃。蛋白鉴定方式[20]:一级扫描方式:全扫描;一级扫描范围:m/z 150~1 200;质谱分辨率设为30 000;窗口0.4 Da;碎裂方式:诱导碰撞解离;碎裂能量:动态碎裂;二级扫描范畴:m/z 100~1 500;循环方式:动态排除扫描;动态排除时间18 s;SWATH定量方式:一级扫描方式:全扫描;一级扫描范围:m/z 150~1 200;质谱分辨率设为30 000;间隔窗口25 u(如m/z 400~425、424~449、448~473,…,1 175~1 200);碎裂方式:诱导碰撞解离;碎裂能量:动态碎裂;二级扫描范畴:m/z 100~1 500;循环方式:依次均匀扫描。
1.4 数据处理及分析
1.4.1 蛋白质鉴定
利用Protein Pilot 4.5软件(AB Sciex公司)对采集的背最长肌和臀肌IDA数据进行搜库,蛋白数据库来源于Uniprot/Swiss-Prot(https://www.uniprot.org/uniprot/?query=reviewed:yes)。
保留时间校准:利用PeakView 4.5软件(AB Sciex公司),对背最长肌和臀肌的SWATH数据与IDA数据进行比对,进行保留时间校准,做定量分析。
1.4.2 差异蛋白的筛选
通过LOG2(Fold Change)与-LOG10(P Value)值绘制火山图,且应用Marker View软件(AB Sciex公司),以P Value<0.05、Fold Change>2或<0.5作为阈值筛选背最长肌和臀肌的差异蛋白。
1.4.3 GO(gene ontology)富集分析
使用DAVID Bioinformatics Resources 6.8(https://david.ncifcrf.gov/)功能注释一栏对总蛋白和差异蛋白分别在细胞学组分、分子功能及生物学过程方面进行分类,使用默认设置进行注释。
1.4.4 差异蛋白互作网络构建
使用在线生物信息网站String(https://string-db.org/)进行蛋白质相互作用分析,String网站包含蛋白质网络相互作用的丰富信息。首先将蛋白质全称上传到String 10.5以获取蛋白质互作信息,所需的最低互动分数设置为中等置信度(0.7),最后导入到Cytoscape 3.4.0软件中制作视觉蛋白质互作网络图[21]。
2 结果与分析
2.1 背最长肌与臀肌总蛋白鉴定与功能分析
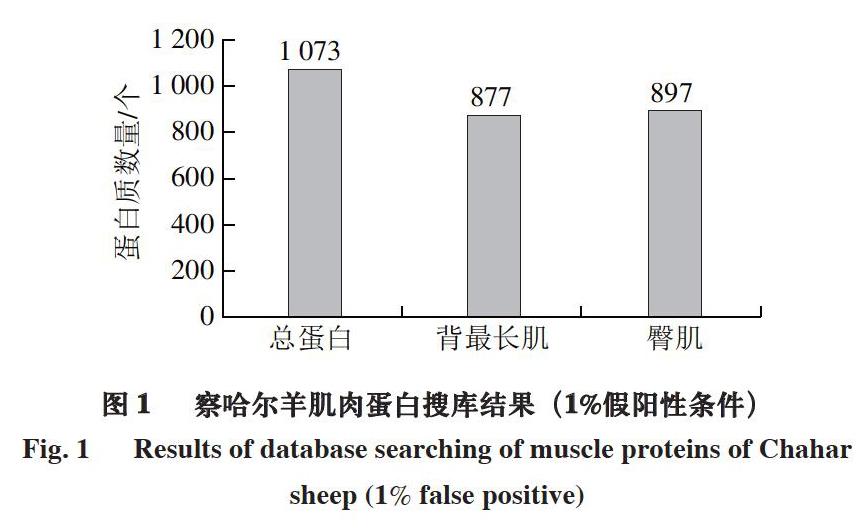
以UniProt/Swiss-Prot蛋白数据库为背景,对总蛋白进行鉴定,初步建立察哈尔羊蛋白质表达谱。由图1可知,1%假阳性条件下,背最长肌和臀肌中共检测到蛋白质1 073 个,其中背最长肌中共检测到877 个,臀肌中共检测到897 个,2 个部位的总蛋白数量相近。
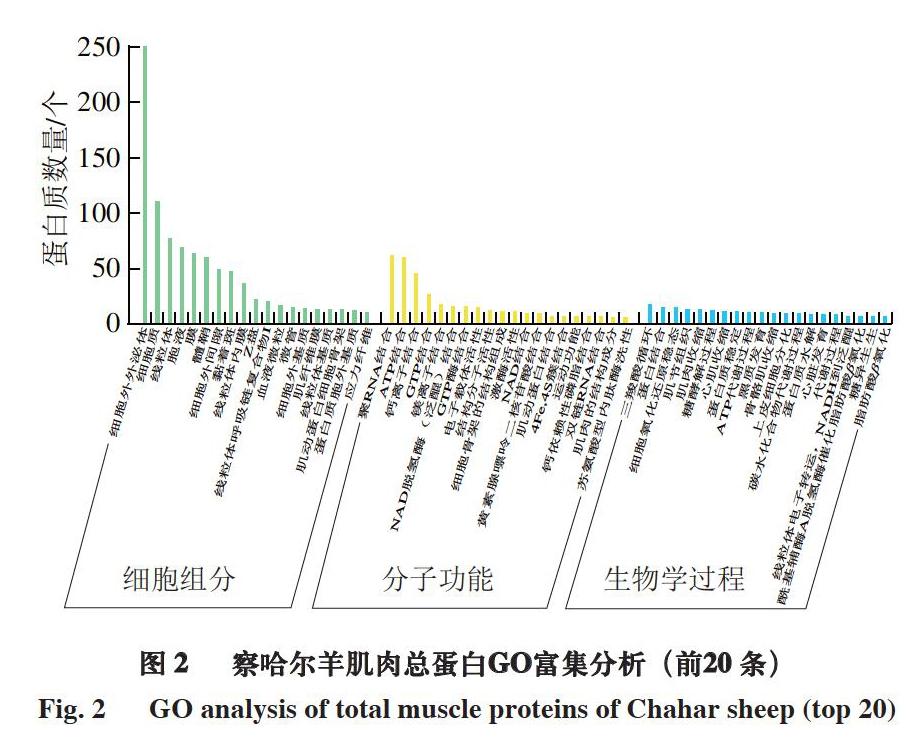
对察哈尔羊肌肉总蛋白进行GO组分富集分析,由图2可知:在细胞组分中,富集于细胞外外泌体中的蛋白质数量最多,其次为富集于细胞质内中的蛋白质数量较多;在分子功能中,蛋白质主要参与聚RNA结合、ATP结合和钙离子结合等功能;在生物学过程中,蛋白质主要参与三羧酸循环、蛋白质结合和细胞氧化还原稳态等生物学过程。
2.2 背最长肌与臀肌差异蛋白筛选与鉴定
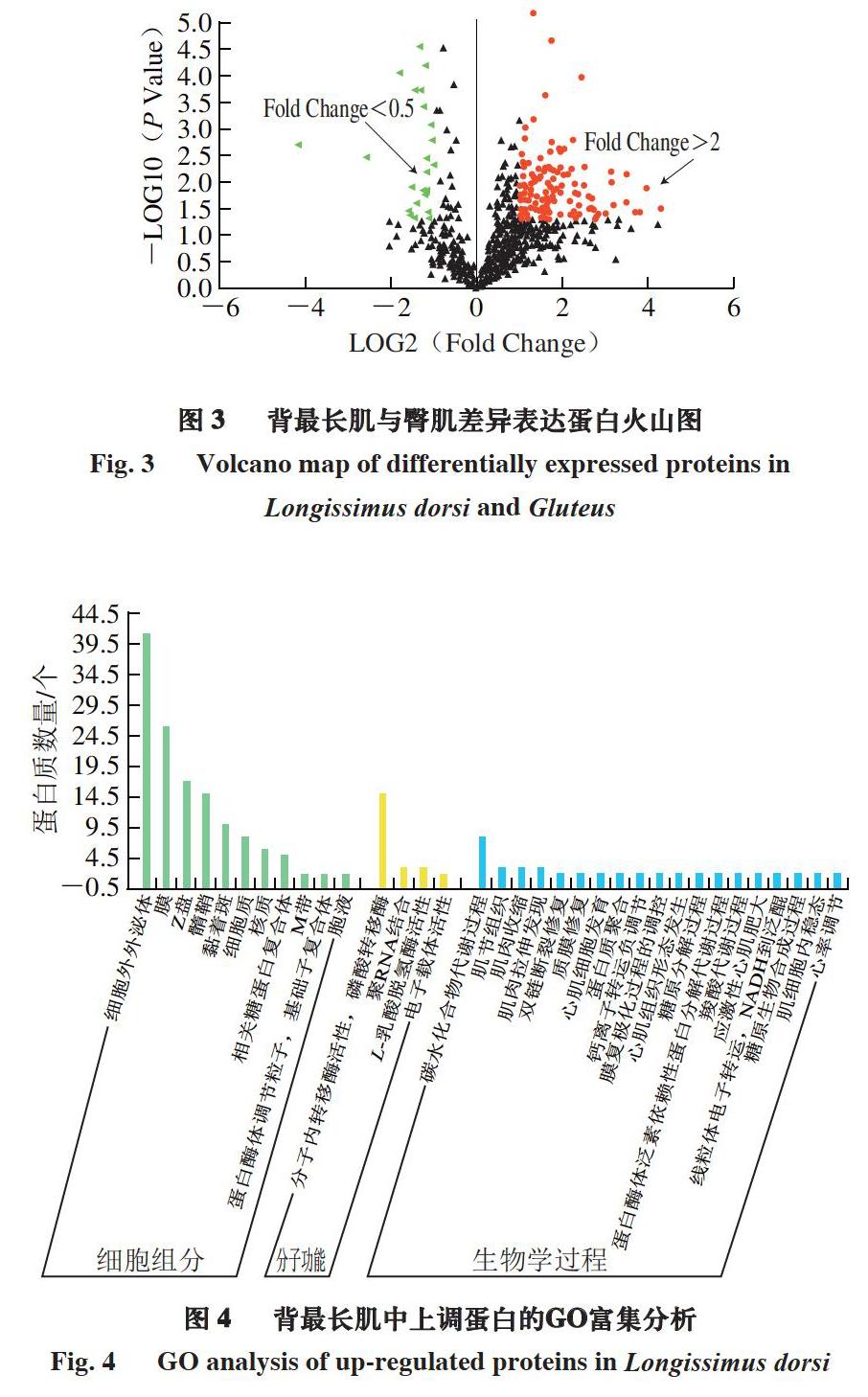
以P Value<0.05、Fold Change>2或<0.5作为差异蛋白筛选的阈值,筛选背最长肌与臀肌中的差异蛋白。由图3可知,共筛选出差异蛋白140 个,在背最长肌中表达上调蛋白116 个,表达下调蛋白24 个。
由图4可知:对于筛选出的背最长肌中上调蛋白,在细胞组分中,富集于细胞外外泌体中的蛋白质数量最多,其次是富集于细胞膜的蛋白质;在分子功能中,蛋白质主要具有分子内转移酶、磷酸转移酶、聚RNA结合和L-乳酸脱氢酶等活性;在生物学过程中,蛋白质主要参与碳水化合物代谢过程、肌节组织和肌肉收缩等过程。
2.3 背最长肌与臀肌差异蛋白网络互作分析结果
ACADS. 线粒体短链特异性酰基辅酶A脱氢酶(mitochondrial short-chain specific acyl-coenzyme A dehydrogenase)、ACAT1. 线粒体乙酰辅酶A乙酰转移酶(mitochondrial acetyl-coenzyme A acetyltransferase)、AGL. 糖原脱支酶(glycogen debranching enzyme)、AK4. 线粒体腺苷酸激酶4(mitochondrial adenylate kinase 4)、AKR1B1. 醛缩酮还原酶家族1成员B1(aldo-keto reductase family 1 member B1)、ALDH4A1. 线粒体δ-1-吡咯-5-羧酸脱氢酶(mitochondrial δ-1-pyrroline-5-carboxylate dehydrogenase)、ALDOA. 果糖二磷酸醛缩酶A(fructose-bisphosphate aldolase A)、APOA2. 载脂蛋白A-II(apolipoprotein A-II)、CAPN2. 钙蛋白酶-2催化亚基(calpain-2 catalytic subunit)、CAPNS1. 钙蛋白酶小亚单位1(calpain small subunit 1)、CAPZB. F-肌动蛋白-帽蛋白亚单位β(F-actin-capping protein subunit β)、CASQ2. 钙素-2(calsequestrin-2)、CAV3. 微囊蛋白-3(caveolin-3)、CCT7. T-复合蛋白1亚单位eta(T-complex protein 1 subunit eta)、CCT8. T-复合蛋白1亚单位θ(T-complex protein 1 subunit theta)、COL3A1. 胶原α-1(III)链(collagen alpha-1(III) chain)、COL6A1. 胶原α-1(VI)链(Collagen alpha-1(VI) chain)、COPS7A. COP9信号体复合亚单位7a(COP9 signalosome complex subunit 7a)、COQ9. 线粒体泛醌生物合成蛋白COQ9(mitochondrial ubiquinone biosynthesis protein COQ9)、COX4I1. 線粒体细胞色素c氧化酶亚基4亚型1(mitochondrial cytochrome c oxidase subunit 4 isoform 1)、DCN. 核心蛋白聚糖(decorin)、DCUN1D1. 类DCN1蛋白1(DCN1-like protein 1)、DDX1. ATP依赖的RNA螺旋酶DDX1(ATP-dependent RNA helicase DDX1)、DHDH. 反式-1,2-二氢苯-1,2-二醇脱氢酶(trans-1,2-dihydrobenzene-1,2-diol dehydrogenase)、EEF2. 延伸因子2(elongation factor 2)、EIF3F. 真核翻译起始因子3亚单位F(eukaryotic translation initiation factor 3 subunit F)、EIF4H. 真核翻译起始因子4H(eukaryotic translation initiation factor 4H)、ESD. S-甲酰谷胱甘肽水解酶(S-formylglutathione hydrolase)、FGA. 纤维蛋白原α链(fibrinogen alpha chain)、GLRX. 谷胱甘肽-1(glutaredoxin-1)、GOT1. 细胞质天冬氨酸转氨酶(cytoplasmic aspartate aminotransferase)、GRB2. 生长因子受体结合蛋白2(growth factor receptor-bound protein 2)、HNRNPK. 核不均一性核糖核蛋白K(heterogeneous nuclear ribonucleoprotein K)、HNRNPU. 核不均一性核糖核蛋白U(heterogeneous nuclear ribonucleoprotein U)、HSPB6. 热休克蛋白β-6(heat shock protein beta-6)、HSPD1. 线粒体60 kDa热休克蛋白(mitochondrial 60 kDa heat shock protein)、HSPG2. 基底膜特异性硫酸乙酰肝素蛋白多糖核心蛋白(basement membrane-specific heparan sulfate proteoglycan core protein)、IDH2. 线粒体异柠檬酸脱氢酶(mitochondrial isocitrate dehydrogenase)、IDH3B. 线粒体异柠檬酸脱氢酶β亚单位(mitochondrial isocitrate dehydrogenase subunit beta)、IPO5. 导入蛋白5(importin-5)、KERA. 角膜蛋白多糖(keratocan)、KLHL41. 类海带蛋白41(kelch-like protein 41)、KPNA4. α3导入蛋白亚基(importin subunit alpha-3)、KRT10. 角蛋白,I型细胞骨架10(keratin, type I cytoskeletal 10)、KRT6C. 角蛋白,Ⅱ型细胞骨架6c(keratin, type II cytoskeletal 6C)、LDHA. L-乳酸脱氢酶A链(L-lactate dehydrogenase A chain)、LDHB. L-乳酸脱氢酶B链(L-lactate dehydrogenase B chain)、MDH2. 线粒体苹果酸脱氢酶(mitochondrial malate dehydrogenase)、MPI. 甘露糖-6-磷酸异构酶(mannose-6-phosphate isomerase)、MT-CYB. 细胞色素b(cytochrome b)、MT-ND5. NADH泛醌氧化还原酶链5(NADH-ubiquinone oxidoreductase chain 5)、MYBPC2. 肌球蛋白结合蛋白c,快速型(myosin-binding protein c, fast-type)、MYH1. 肌球蛋白-1(myosin-1)、MYH11. 肌球蛋白-11(myosin-11)、MYH2. 肌球蛋白-2(myosin-2)、MYH8. 肌球蛋白-8(myosin-8)、MYL2. 肌球蛋白调节轻链2心室/心肌亚型(myosin regulatory light chain 2, ventricular/cardiac muscle isoform)、MYLK2. 肌球蛋白轻链激酶2骨骼肌/心肌型(myosin light chain kinase 2, skeletal/cardiac muscle)、MYOM1. 肌球蛋白-1(myomesin-1) 、NDUFA12. NADH脱氢酶[泛醌]1α亚单位 6(NADH dehydrogenase [ubiquinone] 1 alpha subcomplex subunit 12)、NDUFA6. NADH脱氢酶[泛醌]1α亚单位6(NADH dehydrogenase [ubiquinone] 1 alpha subcomplex subunit 6)、NDUFB8. 线粒体NADH脱氢酶[泛醌]1β亚单位8(mitochondrial NADH dehydrogenase [ubiquinone] 1 beta subcomplex subunit 8)、NNT. 线粒体NAD(P)转氢酶(mitochondrial NAD(P) transhydrogenase)、P4HB. 蛋白二硫异构酶(protein disulfide-isomerase)、GM1. 磷酸葡萄糖变位酶-1(phosphoglucomutase-1)、PGM2L1. 葡萄糖1,6-二磷酸合酶(glucose 1,6-bisphosphate synthase)、PGM5. 磷酸葡萄糖变位酶类蛋白5(phosphoglucomutase-like protein 5)、PHPT1. 14 kDa磷酸组氨酸磷酸酶(14 kDa phosphohistidine phosphatase)、PLEC. 半乳糖(plectin)、PMP2. 髓鞘P2蛋白(myelin P2 protein)、PPP2R2A. 丝氨酸/苏氨酸蛋白磷酸酶2A(serine/threonine-protein phosphatase 2A)、PRELP. 精氨酸(prolargin)、PRKACA. cAMP依赖性蛋白激酶催化亚单位α(cAMP-dependent protein kinase catalytic subunit alpha)、PRKAR1A. cAMP依赖性蛋白激酶Ⅰ型α调节亚单位(cAMP-dependent protein kinase type I-alpha regulatory subunit)、PRPS2. 磷酸核糖焦磷酸激酶2(ribose-phosphate pyrophosphokinase 2)、PRSS1. 胰蛋白1(trypsin-1)、PSMB2. 蛋白酶体亚单位β2型(Proteasome subunit beta type-2)、PSMC4. 26S蛋白酶体调节亚单位6B(26S proteasome regulatory subunit 6B)、PYGM. 糖原磷酸化酶(glycogen phosphorylase)、RAD23A. 紫外线切除修复蛋白rad23同源物A(ultraviolet excision repair protein RAD23 homolog A)、RAD23B. 紫外线切除修复蛋白 rad23同源物 B(ultraviolet excision repair protein RAD23 homolog B)、RAP1b. ras相关蛋白rap-1b(ras-related protein rap-1b)、RBMXL1. RNA结合基序蛋白,X-Link类似物-1(RNA binding motif protein, X-linked-like-1)、RPL14. 60S核糖体蛋白L14(60S ribosomal protein L14)、RPLP2. 60S酸性核糖体蛋白P2(60S acidic ribosomal protein P2)、RTRAF. RNA 转录、翻译与转运因子蛋白(RNA transcription, translation and transport factor protein)、S100A14. 蛋白S100-A14(protein S100-A14)、SAMM50. 分类和组装组织组成同系物50(sorting and assembly machinery component 50 homolog)、SLC25A11. 线粒体2-氧谷氨酸/苹果酸载体蛋白(mitochondrial 2-oxoglutarate/malate carrier protein)、SOD1. 超氧化物歧化酶(superoxide dismutase)、SPTBN1. 收缩蛋白β链,非红细胞1(spectrin beta chain, non-erythrocytic 1)、TCAP. 视松蛋白(telethonin)、TLN2. 踝蛋白2(talin-2)、TMOD4. 原肌球调节蛋白4(tropomodulin-4)、TNNT3. 快速骨骼肌肌钙蛋白T(fast skeletal muscle troponin T)、UQCR10. Cyb-c1复合物亚基 9(Cyb-c1 complex subunit 9)、USP5. 泛素羧基末端水解酶5(ubiquitin carboxyl-terminal hydrolase 5)、VCP. 过渡内质网 ATP 酶(transitional endoplasmic reticulum ATPase)、VIM. 波形蛋白(vimentin)、YHEO. 非特异性蛋白质、YWHAE. 14-3-3 蛋白质ε(14-3-3 protein epsilon)、YWHAG. 14-3-3 蛋白质 γ(14-3-3 protein gamma)。
由图5可知,在察哈尔羊背最长肌与臀肌差异蛋白互作网络中存在5 个功能模块,包括:1)MYH11、MYH1、MYOM1、MYH2、MYH8、MYLK2、MYL2、TNNT3、TCAP和MYBPC2等蛋白质参与的肌纤维组成模块(图5A);2)RPL2、RPL14、EIF3F、EIF4H、EEF2、CCT7、CCT8、KPNA4和IPO5等蛋白质参与的蛋白翻译与组装过程(图5B);3)血影蛋白α链、SPTAN1、AGL、PGM2L1、PYGM、PGM1、LDHA、LDHB、ALDOA、PGK1、MDH2、IDH3B、IDH2、NNT、MPI、PGM5、ESD、PRPS2、ESD和ALDH4A1等蛋白质参与的糖分解与合成过程(图5C);4)PSMD2、PSMC4、PSMB2、PSME2、RAD23A、RAD23B、COPS7A、VCP和USP5等蛋白质参与的泛素化功能模块(图5D);5)COX4I1、NDHFB8、NDUFA12、NDUFA6、MT-CYB、MT-ND5、UQCR10和ATP5F1等蛋白质参与的氧化呼吸链电子传递过程(图5E)。
3 讨 论
蛋白质是动物生理功能的体现者,可以从蛋白质组学的角度分析与肉质相关的问题,并期望有效控制肌肉质量[22]。根据Doherty等[23]的研究,蛋白质成分的变化可能引起肌肉嫩度的变化。如今,蛋白质组学常用于多组样品之间的蛋白质鉴定,筛选与肌肉品质相关的差异蛋白[24]。本研究利用IDA和SWATH技术[25],对察哈尔羊背最长肌和臀肌蛋白质组进行定性及相对定量分析,挑选背最长肌中的枢纽差异蛋白,并对其进行功能分析。
背最长肌中上调差异蛋白在生物学进程中的功能分析表明:背最长肌高表达差异蛋白主要参与碳水化合物代谢、肌节组织和肌肉收缩过程,说明不同部位肌肉中组成肌纤维结构的蛋白质对肉品质有一定影响。研究显示,肌纤维类型是影响肌肉质量的因素,并且肌肉质量越好,Ⅰ型和Ⅱa型肌纤维数量比例越高[26-27]。一般肌纤维类型分为Ⅱa型(快肌纤维,红色肌肉,氧化型肌纖维)、IIb/IIx型(快肌纤维,白色肌肉,糖酵解型肌纤维)和Ⅰ型(慢肌纤维,红色肌肉,氧化型肌纤维)[28],而肌纤维类型取决于不同肌球蛋白轻链异构体的组成[29]。一方面,肌球蛋白轻链主要在氧化型肌纤维中表达,另一方面,肌纤维类型取决于红、白肌纤维肌球蛋白轻链的表达情况(红肌纤维多为Ⅰ型纤维)[30]。肌球蛋白分子由6 条链组成,包括2 条重链和4 条轻链[31-32]。在本研究中,察哈尔羊背最长肌和臀肌差异蛋白的网络互作分析结果表明,肌纤维组成模块中包括MYH11、MYH1、MYOM1、MYH2、MYH8、MYLK2、MYL2、TNNT3、TCAP和MYBPC2等与肌肉组成相关的蛋白质及分子,其中包括4 个肌球蛋白重链,分别为MYH11、MYH1、MYH2和MYH8,以及肌球蛋白轻链MYL2。Lametsch等[33]通过钙蛋白酶诱导的肌纤维及肌原纤维蛋白的降解发现,即使肌原纤维蛋白中肌动蛋白及肌球蛋白重链发生轻微降解,也会影响肉的嫩度。Skarnes等[34]发现,小鼠中MYH1基因的一个靶向零突变导致小鼠生长缓慢、肌肉无力、肌肉收缩和松弛异常。Xiong Xinwei等[35]利用全基因组关联分析技术研究猪肉品质,发现MYH1、MYH2、MYH3和MYH13基因与猪肉品质紧密相关。Zhao Chunping等[36]研究表明,MYH8基因是与牛肉嫩度有关的候选基因。本研究中筛选出的差异肌球蛋白分子,即肌球蛋白重链MYH1、MYH2、MYH8有望成为影响肉品质的重要分子标记。
4 结 论
察哈尔羊背最长肌和臀肌中共检测到蛋白质1 073 个,背最长肌中共检测到877 个,臀肌中共检测到897 个。共挑选出差异表达蛋白140 个,在背最长肌中上调蛋白116 个,下调蛋白24 个。背最长肌和臀肌差异蛋白主要参与碳水化合物代谢、肌节组织和肌肉收缩等生物学过程。在察哈尔羊背最长肌和臀肌差异蛋白互作网络中存在5 个功能模块,分别为肌纤维组成模块、蛋白质翻译与组装过程、糖分解与合成过程、蛋白质参与泛素化功能模块及氧化呼吸链电子传递过程。肌球蛋白分子,即肌球蛋白重链MYH1、MYH2、MYH8有望成为影响肉品质的重要分子标记。
参考文献:
[1] 王景和. 察哈尔羊[J]. 农村百事通, 2015(7): 43-73. DOI:10.19433/j.cnki.1006-9119.2015.07.017.
[2] 内蒙古晨报. 肉羊新品种被农业部命名为“察哈尔羊”[J]. 湖北畜牧兽医, 2014, 35(2): 54. DOI:10.3969/j.issn.1005-5959.2014.02.007.
[3] 毕力格巴特尔, 辛满喜, 巴达玛, 等. 察哈尔羊生长发育规律研究[J]. 中国草食动物科学, 2014, 34(2): 12-14. DOI:10.3969/j.issn.2095-3887.2014.02.003.
[4] 苏德斯琴, 毕力格巴特尔, 辛满喜, 等. 察哈尔羊肉用性能和肉质特性研究[J]. 中国草食动物科学, 2014, 34(1): 11-16. DOI:10.3969/j.issn.2095-3887.2014.01.003.
[5] 崔艺燕, 马现永. 猪肉风味研究进展[J]. 肉类研究, 2017, 31(6): 55-60. DOI:10.7506/rlyj1001-8123-201706011.
[6] 赵雅娟, 苏琳, 尹丽卿, 等. 蛋白质组学技术在肉品质中的研究进展[J]. 食品工业, 2016, 37(4): 233-236.
[7] 赵珺. 内蒙古绒山羊骨骼肌肌肉差异研究[D]. 呼和浩特: 内蒙古农业大学, 2015: 14-61.
[8] 罗嘉, 蒲强, 朱砺. 猪的肌肉纤维类型与肉质研究[J]. 猪业科学, 2014, 31(2): 118-119. DOI:10.3969/j.issn.1673-5358.2014.02.038.
[9] FAHEY A, BRAMELD J, PARR T, et al. The effect of maternal under nutrition before muscle differentiation on the muscle fiber development of the newborn lamb[J]. Journal of Animal Science, 2005, 83(11): 2564-2571. DOI:10.1051/gse:2005023.
[10] KOOMKRONG N, GONGRUTTANANUN N, BOONKAEWWAN C, et al. Fiber characteristics of pork muscle exhibiting different levels of drip loss[J]. Animal Science Journal, 2017, 88(12): 2044-2049. DOI:10.1111/asj.12859.
[11] 吴盛夏, 周鸿媛, 夏杨毅, 等. 肌肉嫩化方法及其机理分析[J]. 食品科技, 2012, 37(9): 126-129. DOI:10.13684/j.cnki.spkj.2012.09.053.
[12] KIM G D, JEONG J Y, JUNG E Y, et al. The influence of fiber size distribution of type IIB on carcass traits and meat quality in pigs[J]. Meat Science, 2013, 94(2): 267-273. DOI:10.1016/j.meatsci.2013.02.001.
[13] KIM J M, LIM K S, KO K B, et al. Estimation of pork quality in live pigs using biopsied muscle fibre number composition[J]. Meat Science, 2018, 137: 130-133. DOI:10.1016/j.meatsci.2017.11.020.
[14] KIM G D, RYU Y C, JEONG J Y, et al. Relationship between pork quality and characteristics of muscle fibers classified by the distribution of myosin heavy chain isoforms[J]. Journal of Animal Science, 2013, 91(11): 5525-5534. DOI:10.2527/jas.2013-6614.
[15] EBHARNT H A, DEGEN S, TANINI V, et al. Comprehensive proteome analysis of human skeletal muscle in cachexia and sarcopenia: a pilot study[J]. Journal of Cachexia, Sarcopenia and Muscle, 2017, 8(4): 567-582. DOI:10.1002/jcsm.12188.
[16] CALNAN H B, JACOB R H, PETHICK D W, et al. Selection for intramuscular fat and lean meat yield will improve the bloomed colour of Australian lamb loin meat[J]. Meat Science, 2017, 131: 187-195. DOI:10.1016/j.meatsci.2017.05.001.
[17] WU Guofang, SHI Xine, ZHOU Jiping , et al. Differential expression of meat quality and intramuscular fat deposition related genes in Hanjiang black pigs[J]. Acta Biochim Biophys Sin, 2014, 46(12): 1087-1090. DOI:10.1093/abbs/gmu087.
[18] 蘇日古嘎. 育肥模式对绒山羊成年母羊肉品质的影响及其与羔羊肉品质比较研究[D]. 呼和浩特: 内蒙古农业大学, 2013: 14-33.
[19] 吴芸. 猪脂联素基因遗传多态性及其与肉质性状的相关性研究[D]. 贵阳: 贵州大学, 2008: 22-35.
[20] 张伟, REIKO Kiyonami, 江峥, 等. 创新数据非依赖性采集用于复杂基质目标蛋白质的定量分析[J]. 分析化学, 2014, 42(12): 1750-1758. DOI:10.11895/j.issn.0253-3820.140365.
[21] RILE N, LIU Z, GAO L, et al. Expression of vimentin in hair follicle growth cycle of inner Mongolian Cashmere goats[J]. BMC Genomics, 2018, 19(1): 38. DOI:10.1186/s12864-017-4418-7.
[22] 黃晓毅. 生鲜猪肉品质变化的差异蛋白质组学研究[D]. 杭州: 浙江工商大学, 2010: 11-12.
[23] DOHERTY M K, MCLEAN L, HAYTER J R, et al. The proteome of chicken skeletal muscle: changes in soluble protein expression during growth in a layer strain[J]. Proteomics, 2004, 4(7): 2082-2093. DOI:10.1002/pmic.200300716.
[24] SCHIAFFINO S, REGGIANI C. Fiber types in mammalian skeletal muscles[J]. Physiological Reviews, 2011, 91: 1447-1531. DOI:10.1152/physrev.00031.2010.
[25] 谢遇春. 内蒙古绒山羊骨骼肌差异蛋白质组学研究[D]. 呼和浩特: 内蒙古农业大学, 2018: 19-30.
[26] RYU Y C, KIM B C. The relationship between muscle fiber characteristics, postmortem metabolic rate, and meat quality of pig Longissimus dorsi muscle[J]. Meat Science, 2005, 71(2): 351-357. DOI:10.1016/j.meatsci.2005.04.015.
[27] 李长强, 陈强, 赖桦, 等. 肌纤维类型转化与肉品质的关系[J]. 云南农业大学学报, 2006, 21(5): 641-645. DOI:10.3969/j.issn.1004-390X.2006.05.021.
[28] 陈宝华. 肌纤维类型与特性的研究进展[J]. 畜牧与饲料科学, 2010, 31(5): 97-98. DOI:10.3969/j.issn.1672-5190.2010.05.048
[29] 赵珺. 内蒙古绒山羊骨骼肌肌肉差异研究[D]. 呼和浩特: 内蒙古农业大学, 2015: 14-61.
[30] WANG Zhixiu, SHANG Peng, LI Qinggang, et al. iTRAQ-based proteomic analysis reveals key proteins a?ecting muscle growth and lipid depositionin pigs[J]. Scientific Reports, 2017, 7: 46717. DOI:10.1038/srep46717.
[31] STUART C A, STONE W L, HOWELL M E, et al. Myosin content of individual human muscle fibers isolated by laser capture microdissection[J]. American Journal of Physiology-Cell Physiology, 2016, 310(5): C381-C389. DOI:10.1152/ajpcell.00317.2015.
[32] 何一旻, 顾鸣敏. 肌球蛋白重链基因在人类遗传性疾病中的研究进展[J]. 遗传, 2017, 39(10): 877-887. DOI:10.16288/j.yczz.17-090.
[33] LAMETSCH R, ROEPSTORFF P, MOILER H S, et al. Identi?cation of myo?brillar substrates for μ-calpain[J]. Meat Science, 2004, 68(4): 515-521. DOI:10.1016/j.meatsci.2004.03.018.
[34] SKARNES W C, ROSEN B, WEST A P, et al. A conditional knockout resource for the genome-wide study of mouse gene function[J]. Nature, 2011, 474: 337-342. DOI:10.1038/nature10163.
[35] XIONG Xinwei, LIU Xianxian, ZHOU Lisheng, et al. Genome-wide association analysis reveals genetic loci and candidate genes for meat quality traits in Chinese Laiwu pigs[J]. Mammalian Genome, 2015, 26(3/4): 181-190. DOI:10.1007/s00335-015-9558-y.
[36] ZHAO Chunping, TIAN Fei, YU Ying , et al. Muscle transcriptomic analyses in Angus cattle with divergent tenderness[J]. Molecular Biology Reports, 2012, 39(4): 4185-4193. DOI:10.1007/s11033-011-1203-6.
