龙眼类受体蛋白激酶CRK家族全基因组鉴定及表达调控分析
2019-12-14孙莹林艺灵赵鹏程徐小萍陈晓慧申序林玉玲赖钟雄
孙莹 林艺灵 赵鹏程 徐小萍 陈晓慧 申序 林玉玲 赖钟雄


摘 要 為了解龙眼富含半胱氨酸的类受体蛋白激酶(cysteine-rich receptor-like kinase,CRK)家族的基本特征与功能,本研究采用生物信息学分析方法对筛选出的98个龙眼CRK基因家族的成员进行分析鉴定,包括分子进化树的构建和对蛋白结构域及其特性、启动子及其顺式作用元件、体胚发生的过程以及组织器官特异性表达的分析。结果显示:通过对龙眼和拟南芥CRK基因做进化树分析,可根据亲缘关系的远近将其分为7个亚家族;不同亚家族成员的蛋白质特性(氨基酸数量、相对分子质量、等电点、信号肽及糖基化位点)有所不同;各成员基因结构特性,启动子顺式作用元件,蛋白结构域特性等与进化树中家族成员亲缘关系的远近相关;98个CRK家族成员在体胚发生过程(NEC、EC、ICpEC、GE)以及生长发育过程中组织器官特异性表达情况有所不同,其中在非胚性愈伤组织以及幼果中表达量较高,在种子和果实中几乎未表达。此外,富含半胱氨酸的类受体蛋白激酶在生物胁迫、非生物胁迫(抗病虫害、抗旱、抗寒、抗盐胁迫等)以及在植物生长发育过程中起着重要作用。
关键词 龙眼;CRK;基因家族;鉴定;表达调控中图分类号 S667.2 文献标识码 A
Genome-wide Identification and Regulation of Expression Analysis of Cysteine-rich Receptor-like Kinase in Longan
SUN Ying, LIN Yiling, ZHAO Pengcheng, XU Xiaoping, CHEN Xiaohui, SHEN Xu, LIN Yuling,LAI Zhongxiong*
Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract In order to understand the basic characteristics and functions of cysteine-rich receptor-like kinase (CRK) family in longan, a series of bioinformatics methods were used to analyze and identify 98 members ofCRKgene family members, including constructing the molecular evolutionary tree, analyzing protein domains and characteristics, promoters, homeopathic elements, somatic embryogenesis and tissue-organ specific expression. Results showed that the CRK gene of longan andArabidopsiscould be divided into seven subfamilies according to the distance of the relationship by evolutionary tree analysis, and the protein characteristics (the quantity of amino acids, the relative molecular weight, the isoelectric point, the signal peptide and sites of glycosylation) of different subfamilies were different. Structural characteristics of the genes of each member, promoter homeopathic elements and protein domain characteristics were closely related to family members in the evolutionary tree. The specific expression of 98 CRK family members during somatic embryogenesis (NEC, EC, ICpEC, GE) and growth were different, particularly higher in non-embryogenic callus and young fruits, but they were almost not expressed in seeds and matured fruits. In addition, cysteine-rich receptor-like protein kinases played important roles in biological stress, abiotic stress (insect-induce diseases, drought resistance, cold resistance, salt resistance, etc.) and it played important roles in plant growth and development as well.
Keywords longan;CRK; gene family; identification; regulation of expression
DOI10.3969/j.issn.1000-2561.2019.10.005
富含半胱氨酸類受体蛋白激酶(cysteinerich receptor-like kinase, CRK)在植物类受体蛋白激酶(receptor-like kinase, RLK)家族中具有重要地位,在植物生长发育、激素信号传导、生物和非生物胁迫以及植物抗病性细胞过敏性死亡中发挥着至关重要的作用[1-2]。
国内外研究发现CRK家族基因可调控植物生长发育及抵抗逆境。在对拟南芥的CRK基因研究中:CRK45通过调控ABA的生物合成而调控着对非生物逆境胁迫,如干旱、高盐以及ABA的响应,对植物耐药性有正向调控作用,即与抗病性相关,参与了水杨酸介导的抗病信号途径[3];CRK5是参与调节基本生理过程的生化机制的重要组成部分,CRKs突变体的功能特性表现出气孔导度降低和衰老加速,与活性氧种类的积累有关,CRK5可以在紫外线照射下表现出细胞死亡和氧化损伤的增强[4],转基因拟南芥对紫外线强度的适应性可通过过表达CRK5来增强[4];CRK17受水杨酸诱导表达参与植物的抗病防御反应[5];用诱导型启动子过量表达CRK4、CRK5、CRK19、CRK20能引起过敏反应导致细胞程序化死亡[4-6];CRK13可通过依赖水杨酸抑制病原菌[7]。从番茄分离的CRK1基因在花粉中可以特异性表达[8];菜豆中CRK基因PvPK20-1可调控病原菌、共生菌与肿瘤因子[9];水稻中OsCRK1基因沉默后严重影响水稻对白叶枯病的抗性,可证明其与叶枯病抗性密切相关[10];在甜瓜中,大多数CRK基因在白粉病和ABA胁迫后下调表达,在盐和低温处理后上调表达,并对冷害胁迫表现较强烈[11]。
龙眼(Dimocarpus longanLour.)是我国重要的亚热带果树,种植面积及产量均居世界首位[12]。但高温、干旱、盐碱、寒冷等非生物胁迫以及生物胁迫均会对龙眼的生长发育造成不良影响,且现今对龙眼生物和非生物胁迫耐受的分子调控机制了解较为匮乏。因此,通过对CRK基因家族的分析,在龙眼生长发育以及抗逆性研究中具有重大意义。本文通过对龙眼CRK家族成员进行分析鉴定以及表达调控研究(进化树分析、基因结构分析、启动子顺式作用元件分析、蛋白保守结构域分析以及在不同体胚发生过程中和生长发育阶段不同组织器官特异性表达的FPKM值分析),了解了CRK家族基因及其在龙眼中的表达情况,可为CRK家族在龙眼生长发育及对其他植物调控的研究中提供理论基础。
1 材料与方法
1.1材料
1.1.1 实验材料 实验材料为福建农林大学园艺植物生物工程研究所提供的‘红核子品种龙眼体胚发生早期胚性愈伤组织(embryonic callus, EC)、非胚性愈伤组织(non-embryoniccallus, NEC)、不完全胚性紧实结构(incomplete embryonic compact structure, ICpEC)、球形胚(globular embryo, GE)[13]。
1.1.2 数据来源 实验室构建的龙眼基因组数据库(NCBI登录号:BioProject PRJNA305337);龙眼转录组数据库(SRA050205);拟南芥(Arabidopsis thaliana)CRK基因家族成员序列下载于https://phytozome.jgi.doe.gov/pz/portal. html。
1.2方法
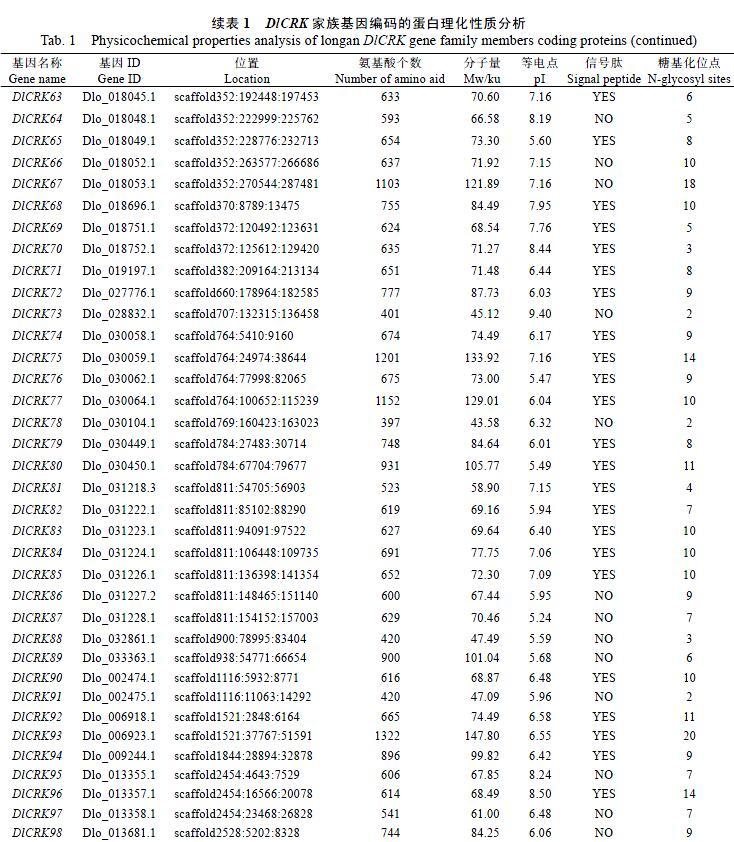
1.2.1 龙眼CRK基因家族成员的鉴定及其基本理化性质分析 对龙眼CRK基因家族成员进行鉴定,经龙眼基因组数据库同源对比,筛选获得98条具有完整Open Reading Frame(ORF)的龙眼CRK候选序列。根据基因注释,采用DNAMAN 6.0软件对CRK的gDNA、CDS以及启动子序列进行比对分析,结合NCBI Blast同源比对分析,初步确定龙眼CRK家族成员。其次,根据其基因座位置[14],将龙眼CRK家族成员命名为CRK1-CRK98(表1)。此外,从ExPASy(www.expasy.org)中获取CRK家族的基本理化性质,并对其分子量(Mw)、氨基酸个数(aa)、等电点(pI)、信号肽(signal peptide)及其糖基化位点(N-glycosyl sites)进行系统的分析。
1.2.2CRK基因家族进化树构建 采用MEGA 6.06软件中的邻近法Neighbor-joining method对龙眼98个基因进行进化树分析,且将龙眼、拟南芥2个物种共141条CRK家族氨基酸序列构建系统进化树,手动删除同源差异较大的序列后進行Bootstrap分析,设置参数为1000次重复性检验。最后使用iTOL(itol.embl.de)对进化树进行修饰编辑。
1.2.3 龙眼CRK基因家族启动子顺式作用元件及蛋白结构域分析 本研究利用PlantCARE对龙眼CRK家族基因各成员ATG上游2000 bp序列进行分析以及利用TBtools结合龙眼CRK家族基因本身进化树进行启动子顺式作用元件分析。为了进一步了解不同龙眼CRK蛋白间motif组成的相似性和多样性,可利用MEME(http://meme)对龙眼CRK蛋白序列中的motif进行预测,其中参数为:保守基序最小宽度≥6,最大宽度为50,保守基序数目设置为25,其他参数为默认值,最后利用TBtools结合龙眼CRK家族自身进化树绘制分析图,对蛋白结构域进行预测分析。
1.2.4 龙眼CRK基因家族不同成员的不同组织器官特异性表达分析 为了解各成员在龙眼不同组织器官或在胚胎中可能发挥的功能特点,通过结合龙眼基因组数据库提取的CRK家族基因在不同体胚发生阶段NEC、EC、ICpEC、GE以及不同组织器官(种子、根、茎、叶、花、花蕾、果肉、幼果、果皮)中特异表达的FPKM值,分析龙眼CRK基因家族各成员在不同组织器官中特异性表达情况。
2 结果与分析
2.1龙眼CRK基因家族成员的鉴定及其基本理化性质分析
根据CRK家族基因成员基因座的位置将98个成员命名为DlCRK1~DlCRK98。为进一步分析龙眼CRK基因家族的基因结构特征,了解其生物学功能,因此对龙眼98条基因的基因结构进行内含子、外显子数目及位置进行分析。结果显示,龙眼CRK基因长度介于2~39 kb,其中大部分CRK基因长度小于5 kb;外显子数目5~14个,其中大多数外显子个数为6~8个。
对龙眼DlCRK家族氨基酸序列的基本理化性质进行分析,结果如表1所示,龙眼CRK家族成员的蛋白质分子量为26.09 ku(DlCRK53)~147.8 ku(DlCRK93),其中大部分基因蛋白分子量分布在60~90 ku之间,平均值为79.34 ku;等电点在5.01(DlCRK41)~9.49(DlCRK5)之间,平均值为6.74,其中pI值大于7的有80条,即大部分为酸性;DlCRK5、DlCRK21、DlCRK35、DlCRK43、DlCRK51、DlCRK66等39个成员不含有信号肽,剩余59个成员均含信号肽,可以引导蛋白质在细胞内运输;糖基化位点有1个(CRK53)~20个(CRK93),大部分分布6~14个,糖基化是一种蛋白转录翻译后的修饰方式,在生命活动中起重要作用,糖基化位点的多少可能严重影响细胞的生命活动[15]。
2.2 CRK基因家族进化树构建
采用龙眼CRK氨基酸序列进行进化树构建时手动删除一个同源差异较大的基因Dlo- 011283.1(DlCRK53),将该基因的长度、蛋白质分子量以及糖基化位点与其他基因相对比,其数值明显较低,且与其他基因的同源差异大,龙眼CRK家族基因与其他模式作物的CRK家族基因亲缘关系较远。利用龙眼和拟南芥2个物种共141条基因在手动删除3条同源差异较大的基因(Dlo-011283.1 DlCRK53、Dlo-032861.1 CRK88、AT4G23170)后构建进化树,可将龙眼和拟南芥2个物种的CRK蛋白家族分为7类(图1):Group1中只含有龙眼CRK家族基因,这部分基因与拟南芥CRK基因同源差异较大,Group4中含有大部分ATCRK基因家族成员与DlCRK46、DlCRK63等聚类相对较近,其余各组中ATCRK基因相对较少且同物种间同源性高。
2.3龙眼CRK基因家族启动子顺式作用元件分析
通过对龙眼CRK基因家族的启动子预测结果分析表明,龙眼CRK家族的启动子区域富含光响应、逆境胁迫响应以及植物激素响应的顺式作用元件。逆境胁迫中包括低温胁迫、干旱胁迫、创伤修复等非生物胁迫。龙眼CRK家族98个成员中可将97个进行聚类,绘制进化树与其启动子顺式作用元件结合,其中DlCRK53同源差异较大,对其单独作图(图2)。其中所有CRK基因启动子均包含至少1个光响应元件;92%的基因响应脱落酸、赤霉素、茉莉酸甲酯、生长素等激素应答;此外,86%的基因序列包含厌氧诱导所必需的元件,其中DlCRK44、DlCRK51、DlCRK97、DlCRK12这4个基因还参与缺氧特异性诱导。含有MBY转录因子是龙眼CRK基因的另一个值得注意的特点,其中72%的龙眼CRK基因包含MYB光响应以及干旱诱导的结合位点,DlCRK98、DlCRK69、DlCRK23、DlCRK31、DlCRK34中包含黄酮类化合物生物合成相关基因调控的MYB转录因子结合位点;还有部分基因(DlCRK41、DlCRK7、DlCRK67、DlCRK68、DlCRK15、DlCRK81、DlCRK31、DlCRK40)包含与细胞周期相关的顺式作用元件。总之,龙眼CRK基因家族含有多个顺式作用元件可推测其在功能上的多样性。
2.4龙眼CRK基因家族蛋白结构域分析
为解龙眼CRK家族基因在龙眼中的蛋白保守结构域特点以及分布情况,使用MEME搜索出25个motif。大部分序列(图3)包含motif10(81)、motif6(74)、motif8(82)、motif17(73),说明这4个基序在龙眼CRK基因家族中比较保守。龙眼CRK基因具有相对保守的蛋白功能结构域(图4),功能结构域分析显示68条基因具有STKc_IRAK结构域,只有DlCRK80和DlCRK86具有B_lecyin结构域。而不能与其他成员进行聚类的CRK53其长度较短,相应的蛋白结构域也仅有一个,其功能特性有缺失。通过对龙眼CRK蛋白家族系统发育树的分析结果可知,位于进化树同一个分支的同源基因有相似的功能结构域,进一步推测这些基因具有相似的生物学功能。
2.5龙眼CRK基因家族不同成员在体胚发生早期不同阶段和不同组织器官特异性表达分析
为了解龙眼CRK基因家族成员们在龙眼体胚发生的不同时期,生长发育过程中不同组织器官中所起到的作用,利用龙眼全基因组数据库中获得DlCRK基因家族成员在体胚发生早期不同阶段,以及生长发育阶段不同组织器官的FPKM值,制作热图对其进行分析(图5)。除了DlCRK36、DlCRK97、DlCRK80、DlCRK88、DlCRK67这5个DlCRK成员在整个体胚发生过程以及生长发育阶段的不同器官中都不表达,其余93个DlCRK成员在体胚发生早期不同阶段或不同组织器官中都有所表达;在不同体胚发生阶段,98个成员中有22个成员在体胚发生阶段完全不表达,其余76个成员大部分在非胚性阶段(NEC)显著表达,少量成员在CE、ICPEC、GE阶段显著表达;另外,龙眼CRK家族成员在不同组织器官形态建成方面(幼果、种子、花、花蕾、叶子、果皮、茎)也发挥着重要作用,但在种子和果实阶段几乎未表达。
在不同体胚发生过程有11种表达模式:DlCRK31、DlCRK7、DlCRK46、DlCRK29、DlCRK56、DlCRK18、DlCRK22、DlCRK19、DlCRK34、DlCRK37、DlCRK35、DlCRK21、DlCRK11、DlCRK98、DlCRK79、DlCRK6、DlCRK53这17个基因在体胚发生早期的4个阶段(NEC、EC、ICpEC、GE)均未表达,不同组织器官中少量表达;在NEC阶段上调表达而其他阶段都下调表达(DlCRK25、71、76、64、1、50、2、43、85、83、55、44、66、20、89、17、40、32、8、59、77、12、61、49、74、60、45、48、5、68、93、3、96);在EC阶段上调表达其他阶段都下调表达(DlCRK58、41、72);在ICpEC阶段上调表达在其他阶段都下调表达(DlCRK30、47、65、9);在NEC和EC阶段上调表达其他阶段都下调表达(DlCRK14且在EC阶段上调表达不明显);在NEC和ICPEC阶段中表达其他阶段下调表达(DlCRK24、91、92、69、4、26、84、95、73、63);在NEC和GE阶段上调表达其他阶段下调表达(DlCRK10、39、13);在EC和ICPEC阶段上调表达其他阶段下调表达(DlCRK94、42、33、16、78、62、51、96、92);在EC和GE階段上调表达其他阶段下调表达(DlCRK28);在ICpEC和GE阶段上调表达其他阶段下调表达(DlCRK38、54、57、27、90、75、87、73);DlCRK81、94、15在EC、ICpEC、GE阶段均上调。总体来看龙眼CRK家族成员在体胚发生过程中主要呈下调趋势。
在研究中发现番茄的SlCRK1基因在花这一器官中表达具有组织特异性(具有花粉特异性的顺式作用元件)[8]。根据龙眼CRK基因家族成员在不同组织器官中特异性表达分析结果来看,部分基因在花中显著表达,所以很可能龙眼CRK家族成员在花这一器官中也具有组织特异性的表达。在DlCRK64、90、74、81中含有种子特异性的顺式作用元件,但DlCRK家族成员在龙眼种子中并未表达,表明虽含有与某种功能相关的顺式作用元件,但最终并不一定会在组织器官中表达出来。拟南芥CRK5可以通过控制植物光和作用来控制植物的生长发育[4],在龙眼CRK家族成员中有与光响应相关的顺式作用元件。对于龙眼来说与光合作用相关性最大的组织器官为叶子,与之相对应有一部分DlCRK基因在叶子中显著表达,所以龙眼CRK家族成员可能通过对植物色素合成、叶片上气孔数量[26]等因素的调控来影响植物光合作用以及抵抗光胁迫[18-20]。龙眼CRK基因家族成员在幼果中表达量呈上调趋势,说明龙眼CRK基因家族成員在花粉的特异性以及在幼果的形成过程中起着重要作用。龙眼CRK家族成员在胚胎与组织表达特性具有多样性与特异性,对整个龙眼生长发育过程有着重要影响。
3.3大多数基因受植物激素和逆境调控
龙眼CRK家族成员中,大部分具有抵抗各种逆境以及受不同激素调控的顺式作用元件,其中包含低温胁迫、干旱胁迫、创伤修复等非生物胁迫;响应脱落酸、赤霉素、茉莉酸甲酯、生长素等激素应答。脱落酸在种子和芽休眠的起始和维持过程中起着重要作用[27],脱落酸可能通过调控龙眼CRK家族基因的表达来影响种子与芽的休眠过程;赤霉素能调节种子中淀粉酶的合成,来打破种子休眠,进而促进茎尖分生组织的细胞分裂,增强顶端优势,也可使果实增大[28],所以龙眼CRK家族基因可能与淀粉酶的合成相关,以此影响种子休眠以及植物生长发育。植物激素在整个植物生长发育过程中起着重要作用,而龙眼CRK家族成员大多数受多种植物激素调控,进一步说明了龙眼CRK基因家族对龙眼生长发育过程中起重要作用。
在龙眼中已发现多个基因家族中含有抵抗逆境相关的功能:龙眼漆酶家族基因可以通过影响细胞壁组成来响应非生物胁[29];DlUGD6参与龙眼中细胞壁多糖合成,可影响植物对逆境的抵抗[30];龙眼Hsf可能通过DNA甲基化来影响植物对逆境的抵抗[13];龙眼ERF家族基因与乙烯之间存在负调控[31]。那么龙眼中CRK基因家族成员抵抗逆境的机理是什么呢?蛋白激酶主要是通过激活不同磷酸化途径来介导外界环境信号的感知与传递,调控下游抗逆基因的转录表达来启动相应的生理生化等适应性的反应来降低或者消除危害[22]。有研究发现拟南芥中CRK45在植物应答非生物胁迫(干旱、高盐以及ABA胁迫)中发挥着重要作用[3],参与水杨酸介导的抗病信号途径的转变[3];AtCRK45和AtCRK36在植物细胞内共同作用,并且参与应答脱落酸和渗透胁迫信号的负调控反应[3,10]。以上可说明龙眼CRK家族基因可能通过感知和传递信号来调控抗逆基因的表达,来启动适应逆境的能力。另外,植物激素可以对拟南芥CRK基因家族成员进行转录调控[32];而龙眼CRK家族成员中有许多响应激素应答的顺式作用元件,其必然与植物抗逆性有直接或间接相关。在植物的生长发育过程中植物激素起着重要作用,而植物抵抗逆境的能力直接决定了植物能否正常的生长发育,因此龙眼CRK家族成员对植物激素的响应与抵抗逆境的能力息息相关。
参考文献
[1]张中起, 王 娇, 靳 炜, 等. 陆地棉CRK基因家族的鉴定及其表达分析[J]. 中国农业科学, 2018, 51(13): 2442-2461.
[2]Elsa-Herminia Q, Gabriel-Xicoténcatl G, Manoj-Kumar A, et al.Cysteine-rich receptor-like kinasegene family identification in the phaseolus genome and comparative analysis of their expression profiles specific to mycorrhizal and rhizobial symbiosis[J]. Genes, 2019, 10(1): 59.
[3]Zhang X J, Han X M, Shi R,et al.Arabidopsiscysteine-rich receptor-like kinase 45positively regulates disease resistance to pseudomonas syringae[J]. Plant Physiology and Biochemistry: PPB/Société Fran?aise de Physiologie Végétale, 2013, 73: 383-391.
[4]Pawe? B, Anna R, Damian W,et al.Cysteine-rich receptor-like kinase CRK5 as a regulator of growth development and ultraviolet radiation responses inArabidopsisthaliana[J]. Journal of Experimental Botany, 2015, 66(11): 3325-3337.
[5]Ohtake Y, Takahashi T, Komeda Y. Salicylic acid induces the expression of a number ofreceptor-like kinasegenes inArabidopsis thaliana[J]. Plant and Cell Physiology, 2000, 41(9): 1038-1044.
[6]Chen K, Fan B, Du L,et al. Activation of hypersensitive cell death by pathogen-inducedreceptor-like protein kinasesfromArabidopsis[J]. Plant Molecular Biology, 2004, 56(2): 271-283.
[7]Acharya B R, Surabhi R, Maqbool S B,et al. Overexpression ofCRK13, anArabidopsis cysteine-rich receptor-like kinase, results in enhanced resistance toPseudomonas syringae[J]. The Plant Journal, 2007, 50(3): 488-499.
[8]Woong B, So Y, Sang K,et al. Identification of a pollen-specificgene,SlCRK1(RFK2)in tomato[J]. Genes & Genomics, 2014, 36(3): 303-311.
[9]Lange J, Xie Z, Broughton W J,et al. A gene encoding areceptor-like protein kinase in the roots of common bean is differentially regulated in response to pathogens symbionts and nodulation factors[J]. Plant Science, 1999, 142(2): 133-145.
[10]張明伟. 水稻抗白叶枯病相关基因OsCRK1的鉴定和克隆[D]. 北京: 中国农业科学院, 2015.
[11] 张海斐. 甜瓜CDPK和CRK基因家族的鉴定及表达分析[D]. 杨凌: 西北农林科技大学, 2017.
[12] 罗 军, 周灿芳, 付丹文, 等. 2011年广东龙眼产业发展现状分析[J]. 广东农业科学, 2012, 39(5): 6-8.
[13] 王 云, 彭丽云, 孙雪丽, 等. 龙眼Hsf基因家族全基因组鉴定及体胚发生过程中的表达分析[J]. 应用与环境生物学报, 2019, 25(2): 420-431.
[14] Jue D W, Sang X L, Liu L Q,et al. Identification ofWRKY gene family fromDimocarpus longanand its expression analysis during flower induction and abiotic stress responses[J]. International Journal of Molecular Sciences, 2018, 19(8): 2169.
[15] 张小倩, 张腾腾, 闫 攀, 等. 蛋白N-糖基化分析方法研究进展[J]. 生物技术进展, 2019, 9(3): 246-252.
[16] 朱巍巍, 马天意, 张梅娟, 等. 类受体蛋白激酶在植物中的研究进展[J]. 基因组学与应用生物学, 2018, 37(1): 451-458.
[17] 郑 超, 李登高, 白 薇. 植物富含半胱氨酸的类受体激酶的研究进展[J]. 生物技术通报, 2016, 32(11): 10-17.
[18] 王文泉, 郑永战, 梅鸿献, 等. 厌氧诱导木葡聚糖转葡糖苷酶(XET)基因在芝麻和小麦根中的表达[J]. 农业生物技术学报, 2004(3): 258-263.
[19] Li J L, Han G L, Sun C F,et al. Research advances ofMYB transcription factors in plant stress resistance and breeding[J]. Plant Signaling & Behavior, 2019, 14(8): 1613-1631.
[20] 杨 雪, 雒 军, 王引权. 调控植物黄酮类化合物生物合成的MYB转录因子研究进展[J]. 甘肃中医药大学学报, 2018, 35(6): 77-81.
[21] 王军妮, 黄艳红, 牟志美, 等. 植物次生代谢物黄酮类化合物的研究进展[J]. 蚕业科学, 2007(3): 499-505.
[22] 王岸娜, 向 琳, 吴立根, 等. 果蔬中黄酮类物质的研究进展[J]. 河南工业大学学报(自然科学版), 2019, 40(3): 118-125.
[23] 赖瑞联, 林玉玲, 赖钟雄. 龙眼不同愈伤组织培养方法的探讨及细胞观察[J]. 龙岩学院学报, 2014, 32(2): 70-75.
[24] 赖钟雄, 潘良镇, 陈振光. 龙眼胚性细胞系的建立与保持[J]. 福建农业大学学报, 1997(2): 33-40.
[25] 陈义挺. 龙眼体胚发生过程中的CDC48和GPX基因克隆与表达[D]. 福州: 福建农林大学, 2009.
[26] Yeh Y H, Chang Y H, Huang P Y,et al. EnhancedArabidopsispatterntriggered immunity by over expression of cysteine-rich receptor-like kinases[J]. Frontiers in Plant Science, 2015, 6: 322.
[27] 傅梅萍. 植物激素ABA/GA代謝与响应通路基因表达在秋茄(Kandelia obovata)显胎生过程中的调控作用[D]. 厦门: 厦门大学, 2018.
[28] 倪德祥, 邓志龙. 植物激素对基因表达的调控[J]. 植物生理学通讯, 1992(6): 461-466.
[29] 徐小萍, 陈晓慧, 吕科良, 等. 龙眼漆酶家族成员全基因组结构与功能分析[J]. 应用与环境生物学报, 2018, 24(4): 833-844.
[30] 徐小萍, 赖瑞联, 林玉玲, 等. 龙眼UGD6基因克隆及其表达特性分析[J]. 西北植物学报, 2017, 37(4): 636-645.
[31] 陈 燕, 吕科良, 厉 雪, 等. 龙眼ERF家族成员鉴定及其在体胚发生早期的表达[J]. 西北植物学报, 2018, 38(11): 1986-1999.
[32] Wrzaczek M, Brosché M, Saloj?rvi J,et al. Transcriptional regulation of theCRK/DUF26 group ofreceptor-like protein kinasesby ozone and plant hormones inArabidopsis[J]. BMC Plant Biology, 2010, 10(1): 95.
