1株牛源蜡样芽孢杆菌的分离鉴定及毒力基因检测
2019-12-10宋丽丽张玲艳贾伟娟白志恒陈云娇王学理
宋丽丽,张玲艳,贾伟娟,白志恒,刘 媛,陈云娇,王学理
(内蒙古民族大学 动物科学技术学院,内蒙古通辽 028042)
蜡样芽孢杆菌(Bacilluscereus)属芽孢杆菌科,蜡样芽孢杆菌属,该菌与苏云金芽孢杆菌及炭疽杆菌等细菌的生物学特性相近,为一种较为常见的食源性条件致病菌。部分蜡样芽孢杆菌可作为促植物生长剂及动物饲料内的微生物添加剂。该菌广泛存在于自然界内,在土壤、污水及一些食物表面均可被分离到。此菌为革兰氏阳性菌,可产生芽孢,兼性厌氧生存。其芽孢热稳定性较强,是该菌引起食源性食物中毒的一个较为重要的因子[1]。该菌可引起人和动物产生呕吐、腹泻等临床症状。近年来,中国养殖业蓬勃发展,通辽地区更是有着中国肉牛之都的称号。本研究从通辽市某肉牛养殖场病死牛体内分离到1株细菌,对该菌进行分离鉴定,以期对通辽地区蜡样芽孢杆菌的流行病学调查及该病的综合防控奠定理论基础。
1 材料与方法
1.1 材 料
氯化钠、营养琼脂、葡萄糖等购自北京化工厂;酵母浸粉与蛋白胨由奥博星公司提供;细菌基因组DNA提取试剂盒、DNA胶回收试剂盒、DL2000 DNA marker、PCR mastermix等均购自TaKaRa公司;全自动凝胶成像分析系统ZF-258;药敏纸片购自赛莫尔公司;生化分析使用BD PhoenixTM100全自动微生物分析系统。
1.2 方法
1.2.1 细菌的分离培养 用接种环无菌采集病死牛的心、肝、脾、肺、肾等病变脏器组织,于LB固体培养基上划线培养。12 h后可见脾脏组织接种的培养基上长出多个单菌落。挑取菌落革兰氏染色后镜检,并对单菌落进行分离、纯化、增菌培养,保存,备用[2]。
1.2.2 分离菌的生化鉴定 使用BD PhoenixTM100全自动微生物分析系统对分离菌进行生化特性检测。吸取25 μL 0.6个麦氏单位的菌液置于AST肉汤培养基内混匀,将混合液加到革兰氏阳性菌鉴定检测板内。将检测板放入机器内,24 h后查看检测结果。
1.2.3 分离菌药敏检测 采用纸片扩散法检测分离菌对30种药物的敏感性[3]。吸取经过夜培养的菌液50 μL于普通琼脂培养基上,使用涂布器将菌液均匀涂布于培养基表面。将药敏片贴于涂布菌液的培养基上,之后将此培养基置于37 ℃培养箱内过夜培养,次日查看试验结果[4]。
1.2.4 分离菌16S rDNA鉴定 使用细菌基因组DNA提取试剂盒提取分离菌的基因组DNA。参照文献[5]合成细菌16S rDNA基因扩增引物,引物序列为上游引物F:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物R:5′-AAGGAGGTGATCCAGCCGCA-3′,目的片段大小为1 500 bp。PCR反应体系为(20 μL):2×Det PCR MasterMix 10 μL,模板DNA 1.0 μL,上下游引物各0.5 μL,ddH2O补至20 μL。PCR反应条件: 95 ℃预变性5 min;94 ℃变性1 min,52 ℃退火 1 min,72 ℃延伸90 s,30个循环;72 ℃延伸 10 min,4 ℃保存。PCR产物采用10 g/L琼脂糖胶电泳进行检测,将扩增所获目的条带使用DNA凝胶回收试剂盒纯化回收并送至上海生工生物工程有限公司测序。将测序结果在NCBI网站上进行BLAST,选取BLAST结果内分离自不同地区的蜡样芽孢杆菌(美国NR074540、朝鲜CP020383、湖南JX294967、美国AY138272、巴西CP008712、四川KU986648、四川KJ720022、湖北GQ381283、拉巴特JN208091、山西KX905299)及致病性蜡样芽孢杆菌代表菌株(AF290547)通过DNAstar软件构建遗传进化树,并进行核酸同源性比对。
1.2.5 分离菌动物致病性检测 选取15只体质量为25~30 g的小鼠随机分为3组,分别腹腔注射0.5 mL 106CUF/mL分离菌、108CUF/mL分离菌和生理盐水。注射后每隔1 h观察并记录小鼠临床状态。
1.2.6 分离菌毒力基因检测 参照文献[6-7],合成蜡样芽孢杆菌各毒素基因及看家基因的引物(表1)。PCR反应条件为:95 ℃预变性5 min; 94 ℃变性1 min,退火1 min(温度见表1),72 ℃延伸90 s,35个循环;72 ℃延伸10 min。扩增产物用10 g/L琼脂糖凝胶电泳进行检测。
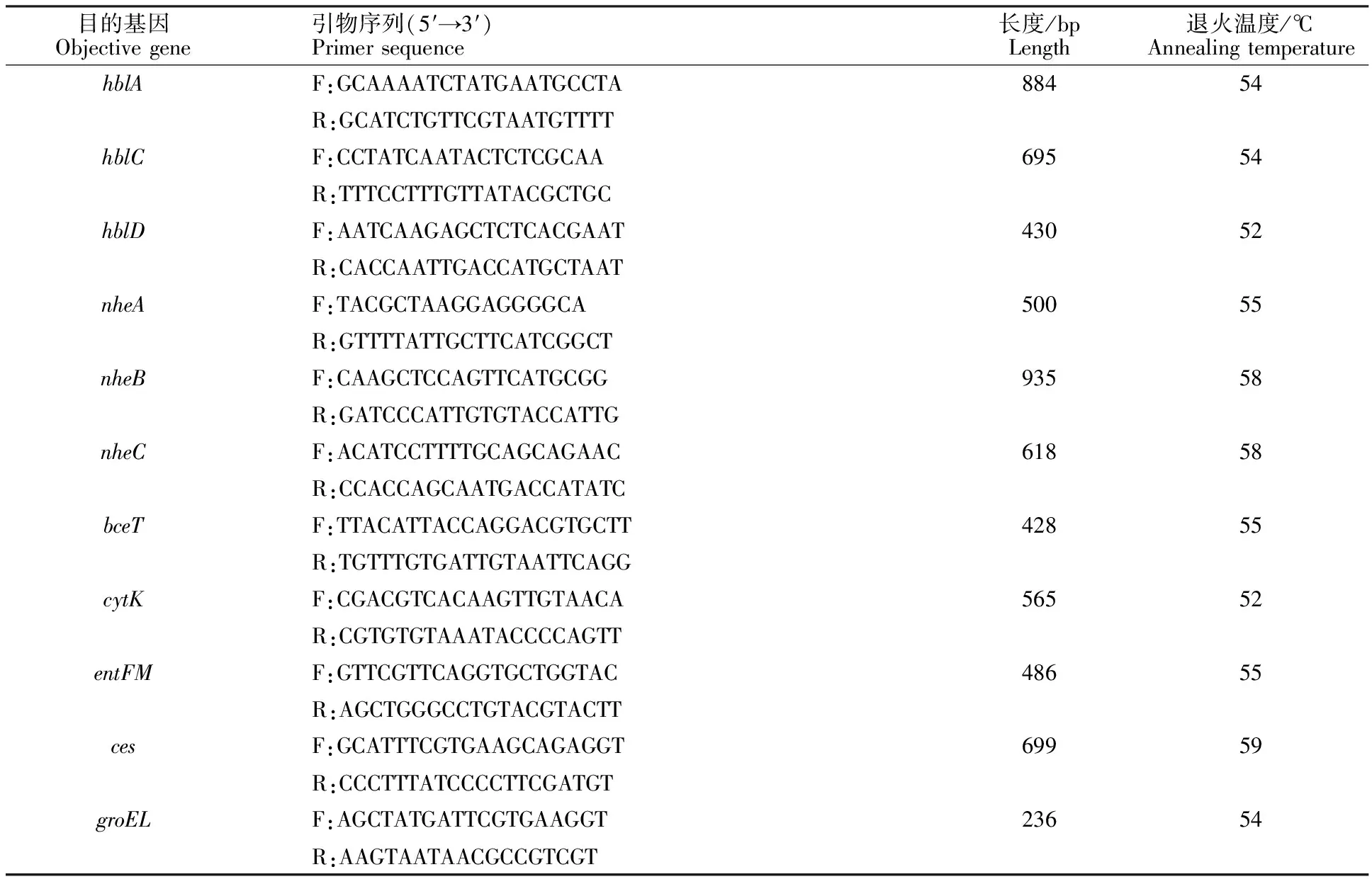
表1 蜡样芽孢杆菌毒力基因引物Table 1 Virulence gene primers of Bacillus cereus
2 结果与分析
2.1 细菌培养特性
病牛脏器组织划线的平板培养12 h后,仅脾脏组织划线的平板上有菌落生长,均为灰白色、不透明的小菌落,挑起时呈丝状。继续培养24 h后可见菌落边缘向外扩展,整体呈蜡滴状。挑取单菌落染色镜检,均为两端钝圆,多呈单个或链状排列的革兰氏阳性杆菌(图1)。
2.2 分离菌生化鉴定
生化结果显示,该菌株能分解葡萄糖、麦芽糖、果糖等,不能分解尿素、D-塔格糖、β-龙胆二糖等(表2)。全自动微生物分析系统提示该菌为蜡样芽孢杆菌。
2.3 分离菌药敏检测
对药敏试验结果进行记录并分析(表3)。结果显示,该菌对头孢氨苄、头孢唑啉、庆大霉素、诺氟沙星等药物敏感,对头孢哌酮、四环素、多粘菌素B等药物中度敏感,对青霉素、新霉素、克林霉素等药物耐药。
2.4 分离菌16S rDNA检测及其进化树分析
由细菌16S rDNA PCR电泳结果可见,样品孔出现与目的基因大小相符的1 500 bp条带(图2)。测序结果显示该片段大小为1 492 bp,为蜡样芽孢杆菌的16S rDNA片段。将所分离细菌菌株命名为TL株,根据进化树结果(图3)可知,TL与山西分离株Kx905299亲源关系最近,同源性为99.8%。与其他参考毒株亲缘关系相对较远。

图1 分离菌株在显微镜下的形态(1 000×)Fig.1 Morphology of isolates under microscope (1 000×)

表2 分离菌株生化试验结果Table 2 Biochemical test results of isolated strains
注:+.阳性;-.阴性。
Note: +.Positive;-.Negative.

表3 分离菌药物敏感性试验Table 3 Drug sensitivity test of isolates
注:R.耐药;I.中度敏感;S.敏感。
Note:R.Drug resistance;I.moderate resistance;S.sensitive.

M.DL2000 DNA marker;16S.16S rDNA
2.5 动物致病性试验
小鼠注射菌液6 h后,106CUF/mL组小鼠出现食欲废绝、精神萎靡现象,108CUF/mL组小鼠死亡1只,2只出现呼吸急促,倒地不起,其余小鼠精神萎靡。注射12 h后, 106CUF/mL组小鼠死亡2只,108CUF/mL组小鼠死亡4只,24 h后两个试验组的小鼠全部死亡。整个试验期对照组小鼠无异常。采集死亡小鼠脏器组织进行细菌培养,从心脏组织中分离到该菌。表明该分离菌具有较强的致病性。
2.6 细菌毒力基因PCR鉴定
对所分离蜡样芽孢杆菌进行毒力基因PCR鉴定,经10 g/L琼脂凝胶电泳检测,结果见图4。样品孔1、2、4、5、6、8、9和11分别扩增出与hblA、hblC、groEL、nheB、nheC、hblD、nheA、entFM基因片段大小相同且清晰可见的条带,多次试验未检测到bceT、cytK、ces基因。由此可知,此蜡样芽孢杆菌分离株含有看家基因groEL,溶血性肠毒素毒力基因hblA、hblC、hblD,非溶血性肠毒素毒力基因nheA、nheB、nheC以及肠毒素毒力基因entFM,不含有肠毒素毒力基因bceT、细胞毒素毒力基因cytK及呕吐毒素毒力基因ces。

图3 16S rDNA基因系统发育进化树Fig.3 Phylogenetic tree of 16S rDNA gene
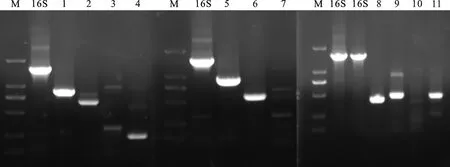
M.DL2000 DNAMarker;16S.16S rDNA;1.hblA;2.hblC;3.ces;4.groEL;5.nheB;6.nheC;7.cytK;8.hblD;9.nheA;10.bceT; 11.entFM
图4 分离菌16S rDNA及毒力基因扩增结果
Fig.4 Results of 16S rDNA and virulence gene amplification of isolated bacteria
3 讨 论
蜡样芽孢杆菌分为无毒菌株和有毒菌株。无毒菌株作为益生菌,在进入动物肠道后,可影响肠道免疫细胞对细胞因子的分泌,并且可产生杆菌肽等抗菌物质来增强机体的免疫能力[8]。此外,该细菌在降低动物腹泻率、提高动物采食量、促进反刍动物瘤胃内容物代谢等方面均有良好的效果[9]。另外,无毒菌株作为益生菌在种植业及鱼类养殖业等方面应用也十分广泛。焦文沁等[10]研究表明,蜡样芽孢杆菌对小麦有明显防病、促生长、提高抗逆性的作用。张洪玉等[11]研究发现,给虾拌饵投喂蜡样芽孢杆菌可显著促进虾的生长,并提高其机体免疫力。
有毒蜡样芽孢杆菌为一种常见的食源性条件致病菌,可引发人或动物的食物中毒,临床多见患者产生腹泻或呕吐症状,这是由于该菌可产生呕吐型肠毒素与腹泻型肠毒素。呕吐毒素Cereulide由ces基因控制合成[12]。腹泻型毒素主要包括溶血型肠毒素HBL(Hemolysin BL)、非溶血型肠毒素Nhe(Nonhemolytic enterotoxin)、细胞毒素CytK(Cytotoxin)、肠毒素T(BceT)、和肠毒素FM(EntFM)。其中HBL通常会由hblA、hblB、hblC、hblD4个基因构成,但有些菌体hblB会有缺失,nhe由nheA、nheB、nheC 3种毒力亚基组成,其余3种毒素为单一基因产物。溶血性肠毒素hbl与细菌的细胞毒性及其与细胞作用过程中孔隙的形成有关[13]。非溶血性肠毒素基因nhe合成的蛋白可引发中毒,细胞毒素K为穿孔毒素,可致细胞发生死亡。呕吐毒素为一种环形小分子肽,可引发伴有呕吐症状的食物中毒。有研究表明nhe基因、entFM基因、bceT基因为蜡样芽孢杆菌的主要毒力基因,这些毒力基因所编码的毒素也被认为是蜡样芽孢杆菌的主要毒力蛋白[14]。本试验对分离菌所含毒素基因进行鉴定,结果显示该菌含有溶血性肠毒素基因hbl、非溶血性肠毒素基因nhe及肠毒素基因entFM。因此可以推测该分离菌株的致病性可能与所检测到的毒力基因所编码的毒素有关。
近年来随着抗生素等药物的滥用和乱用,该菌的侵袭力也在不断发生变化。Veysseyre 等[15]对一所医院5 a内确诊为感染蜡样芽孢杆菌患者的临床症状进行统计,结果显示29.8%的患者发生单纯菌血症,28.1%的患者发生皮肤感染, 17.5%的患者发生骨及关节感染,11.8%的患者发生死亡,54.4%的患者在内科进行治疗。该细菌的靶器官从最初的胃肠道扩展到其他脏器,甚至可使宿主死亡,可见蜡样芽孢杆菌的侵染能力逐渐变强。蜡样芽孢杆菌不仅对人类的侵染性发生变化,其对动物的侵袭力也在逐步增强。
崔一龙等[16]从马皮下脓肿内分离到致病性蜡样芽孢杆菌,赵振宇等[5]从仔猪的肝脏内分离到新型致病性蜡样芽孢杆菌,二者均以小鼠为实验动物进行细菌的动物致病性试验,结果显示两菌株均具有较强的致病性,可使小鼠发生死亡。蜡样芽孢杆菌对牛的致病性主要表现为奶牛乳房炎,而本次所分离的菌株导致牛发生猝死,蜡样芽孢杆菌对牛可导致猝死迄今未见公开报道。核苷酸同源性结果表明,TL株与人源致病菌株Af290547、猪源致病菌株Jx294967的同源性分别为99.6%和99.5%。与参考菌株序列碱基对比结果可见,TL菌株16S rDNA的第265位碱基由T转变为C,而这一不同之处是否与菌株间致病性差异有关还需进行近一步研究。
目前,蜡样芽孢杆菌感染动物的情况逐渐增多,在通辽地区已出现多起牛感染蜡样芽孢杆菌致死案例。
