番茄灰霉生防菌XF的筛选、鉴定及生防因子的初步探索
2019-12-10潘晓梅李昭煜石晓玲林胜红李佳佳田永强
潘晓梅,李昭煜,石晓玲,林胜红,李佳佳,田永强
(兰州交通大学 化学与生物工程学院,兰州 730070)
番茄灰霉病是由灰葡萄孢菌(Botrytiscinerea)引发的一种危害严重的世界性病害,近年来在中国蔓延,已成为影响番茄产量和品质的重要因素。该病在土壤里主要是以菌核、残存菌丝体或分生孢子的形态存留,在低湿高温的环境中萌发生长,主要侵染番茄的叶和果实,造成叶片干枯,果实腐烂,严重时可使番茄减产高达60%以上[1-2]。
目前,灰霉病的防治主要依靠于化学农药和栽培抗病品种。栽培抗病品种是防治病害的根本措施,但育种工作受到时间与技术的限制以及选育的新品种抗病单一,因此选育出有效抗灰霉的番茄品种还有待解决;而化学农药防治虽是速度快、成本低的有效防治措施,但造成环境的污染,且农药残留问题已是人们关注的焦点[3-5]。鉴于此,人们将目光投向了生物防治。近年来,用有益微生物和其代谢产物防治植物病害时有报道,杨利敏等[1]在2015年报道了一株枯草芽孢杆菌的无菌发酵滤液在离体叶片上对番茄灰霉的防治效果可达100%。娄义等[7]在2018年报道了3株芽孢杆菌对番茄种子的胚根、胚轴有明显的促进作用,并处理盆栽番茄后,通过改变番茄根系土壤中微生物的种群变化,从而有效减少了病原真菌尖孢镰刀菌的数量。Elad等[8]报道了2株哈茨木霉可有效控制大豆上的灰霉病,向大豆叶片喷洒发酵液能使灰霉病降低50%~100%。生物防治所使用的菌株均筛选于自然界,对环境友好,也解决了农药残留问题,为植物病害的防治带来新手段。
本试验从甘肃省兴隆山原始森林土壤中分离得到菌株XF,通过形态特征和16S rDNA序列分析鉴定为蜡样芽孢杆菌,观察其对番茄灰霉菌菌丝生长的影响并进一步探讨该菌株的拮抗机理,以期为番茄灰霉病的绿色防治探索新的方法。
1 材料与方法
1.1 材 料
1.1.1 土样的采集 2017年9月份,在甘肃省兴隆山原始森林山脚、山腰和山顶植被保护相对完整的地方,用“S”型采样法采取10~30 cm土层的土样,装入无菌袋,带回实验室,4 ℃保存,用于后续试验。
1.1.2 生防菌 分离自甘肃省兴隆山原始森林10~30 cm土壤的菌株XF。
1.1.3 病原真菌 番茄灰霉病菌(Botrytiscinerea)、番茄叶霉病菌(Fulviafulva)、番茄早疫病菌(Alternariasolani)、茄子菌核病菌(Sclerotiniasclerotiorum)、茄子腐烂病菌(Phytophthoracinnamomi)、枸杞炭疽病菌(ColletotrichumgloeosporioidesPenz)、棉花枯萎病菌(Fusariumoxysporumvasinfectum),试验中用到的所有病原真菌均保存于甘肃农业大学植物保护学院。
1.1.4 培养基 PDA培养基,LB培养基,脱脂牛奶琼脂培养基(Skim Milk Medium), Avicel培养基,几丁质检测培养基,铁载体检测培养基,金氏培养基(King),具体方法见参考文献[9-13]。
发酵培养基:葡萄糖10 g/L,蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,MgSO4·7H2O 1 g/L,琼脂15 g/L,pH 6.0。
1.2 方 法
1.2.1 生防菌的筛选 (1)将土壤配置成 10-1~10-5浓度的悬液,吸取10-5浓度的悬液上清液0.1 mL,采用平板涂布法培养菌落(LB培养基),挑取形态各异的菌落划线纯培养。每个试验重复3次。
(2)将培养5 d的番茄灰霉病菌用打孔器(直径8 mm)打成菌饼,放置在培养皿中央,再用无菌牙签将培养24 h的细菌用十字交叉法接种在距菌饼2 cm处,25 ℃黑暗培养5 d。能产生抑圈带即为生防菌,并测定抑菌率[2]。每个试验重复3次。同时,在光学显微镜下观察菌落边缘菌丝的形态变化。
抑菌率=(对照组菌落直径-处理组菌落直径)/对照组菌落直经×100%
1.2.2 抑菌谱的测定 选取番茄叶霉病菌、番茄早疫病菌、茄子菌核病菌、茄子腐烂病菌、枸杞炭疽病菌、棉花枯萎病菌与筛选的生防菌XF做对峙试验(方法同“1.2.1”),测定菌株XF对其他病原真菌的抑制 效果。
1.2.3 菌株XF的无菌发酵滤液对番茄灰霉菌的抑制作用 将筛选出的生防菌株XF接入100 mL LB液体培养基中,30 ℃ 160 r/min培养24 h后,以1∶100接入发酵培养基中培养60 h后,培养液8 000 r/min离心10 min,取上清,以孔径为0.45 μm的菌膜过滤掉菌体得到滤液,按1∶10, 1∶100(滤液:培养基,V/V)将发酵滤液混入 50 ℃融化的PDA培养基中。待培养基凝固后,在培养皿中心接入直径8 mm的番茄灰霉菌菌饼,25 ℃培养,以不加发酵滤液为对照,每组重复 3次。5 d后,测量各组菌落直径,计算抑菌率。
1.2.4 生防因子的测定 (1)菌株XF分泌蛋白酶、葡聚糖酶、几丁质酶、铁载体能力的定性测定:将培养24 h的菌株XF分别点接在脱脂牛奶琼脂培养基、Avicel培养基、几丁质检测培养基、铬天青(CAS)检测培养基平板上,30 ℃培养24~ 48 h,观察其透明圈的直径大小并计算D值[14](透明圈直径-菌落直经),测定其蛋白酶、葡聚糖酶、几丁质酶和铁载体活性水平。
(2)菌株XF合成生长素(IAA)能力的测定:采用Salkowski比色法[15]。比色液的配置:将 4.5 g FeCl3溶于300 mL蒸馏水,缓慢加入98%浓硫酸587.4 mL,待冷却后定容至1 L,测定IAA范围5~200 mg/L。
1.2.5 菌株XF的分子鉴定 菌株采用16S rDNA基因序列分析并对生防菌进行序列鉴定。采用Ezup柱式细菌基因组DNA抽提试剂盒(上海生工生物工程有限公司)提取拮抗菌株总DNA后,进行PCR扩增。PCR采用的引物为27F(5′-AGAGTTTGATCCTGGCTCA-3′)与 1492R (5 ′-GGTTACCTTGTTACGACTT-3′),PCR的反应体系为25 μL,所用程序为94 ℃预变性 5 min,94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸 90 s,共进行30次循环,然后以72 ℃延伸10 min后结束。4 ℃保存,备用。送至北京华大基因完成测序工作,测序结果于NCBI 数据库 Blast 比对分析并用 MEGA 5.0 软件(Neighbor-Joining 法)构建系统发育树。
2 结果与分析
2.1 生防菌的筛选
于2017年9月采集甘肃省兴隆山原始森林土壤15份,从这些土样中共分离纯化到30株细菌。通过与番茄灰霉病菌的对峙培养结果显示,10株有抑菌效果,处理组菌落直经与对照组菌落直经的差值为3.50~5.64 cm,其中菌株XF的拮抗效果最好,菌落直经差值可达5.64 cm,因此确定菌株XF为目标生防菌株。
2.2 菌株XF对番茄灰霉菌的拮抗作用
在对峙培养平板中拮抗效果明显(图1),抑菌率可达66.35%,与对照组相比,处理组菌丝生长缓慢且稀薄。边缘菌丝显微观察显示(图2,显微镜放大倍数为10×40倍),菌株XF对番茄灰霉菌菌丝的生长有显著的影响,与对照组正常生长的菌丝相比,受生防菌抑制的灰霉菌菌丝膨大变粗,分枝增多,节间缩小(图2-1),出现囊泡状畸形,伴有细胞壁破裂,内涵质外泄的现象(图2-2)。
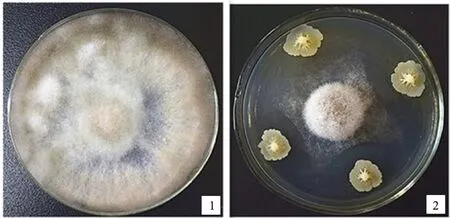
1.对照 Control of B.cinerea; 2.对峙培养 Dual culturing test
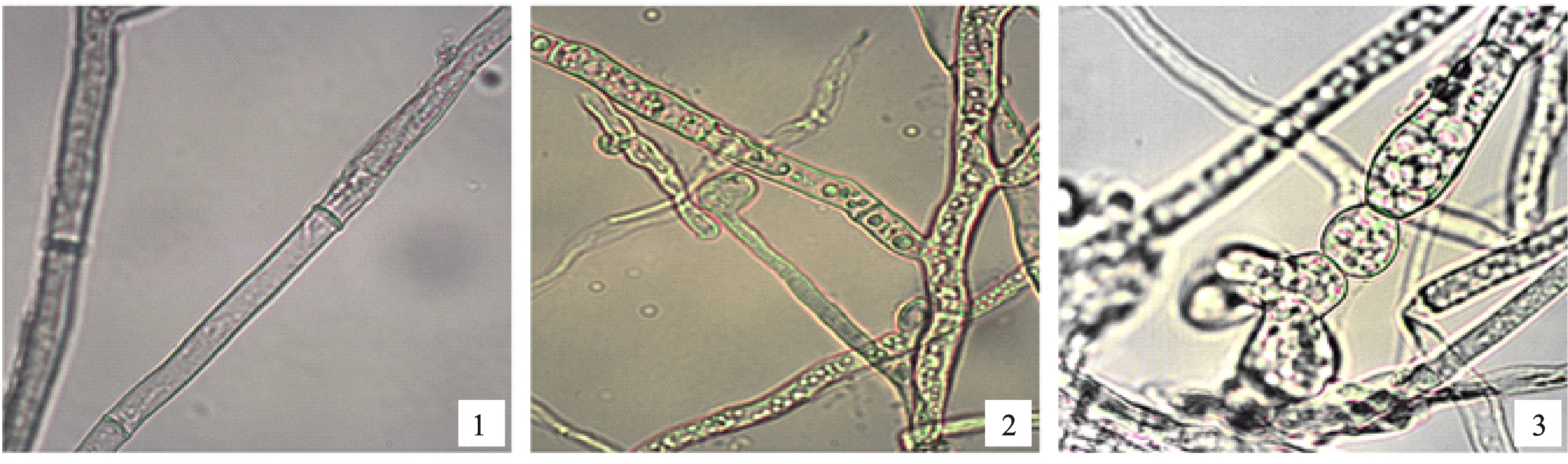
1.正常菌丝 Normal mycelia;2.菌丝膨大变粗,分枝增多,节间缩小 Mycelia branch increased while internode shortened;3.菌丝囊泡状畸形,细胞壁破裂,内涵质外泄 Vesicle-like deformity,Vesicle breakdown
图2 对峙培养中菌株XF对番茄灰霉菌菌丝生长的影响
Fig.2 Inhibition effect of strain XF on mycelia morphology ofB.cinerea
2.3 菌株XF抑菌谱的测定
菌株XF与番茄叶霉病菌(Fulviafulva)、番茄早疫病菌(Alternariasolani)、茄子菌核病菌(Sclerotiniasclerotiorum)、茄子腐烂病菌(Phytophthoracinnamomi)、枸杞炭疽病菌(ColletotrichumgloeosporioidesPenz)、棉花枯萎病菌(Fusariumoxysporumvasinfectum)的PDA对峙培养平板结果显示,菌株XF对这6种病原真菌均有显著的拮抗效果(表1),抑菌率可达60%以上,证明菌株XF对植物病害的防治具有广谱性。
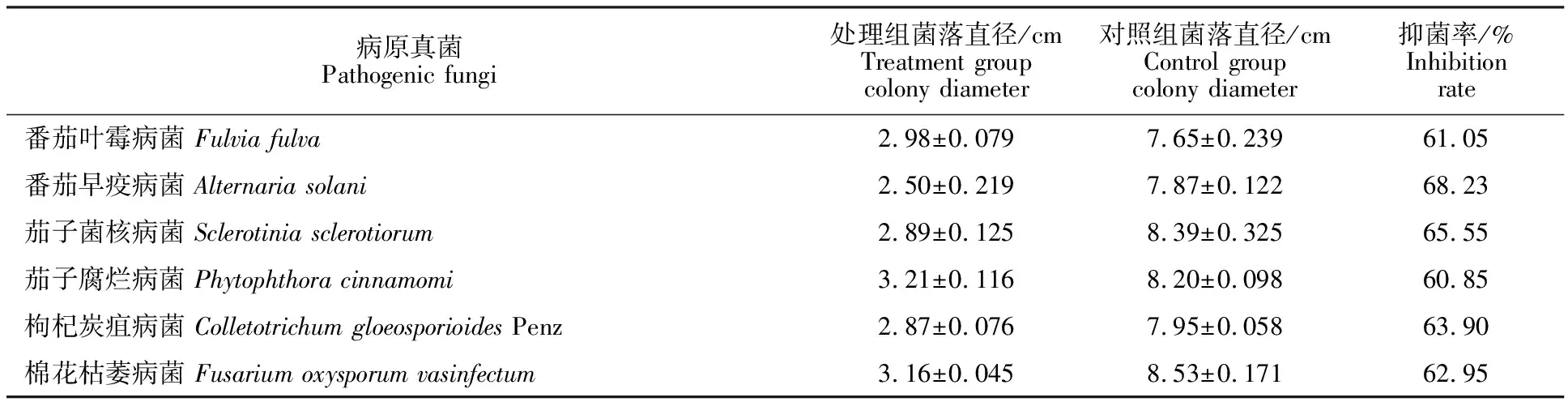
表1 菌株XF抑菌谱的测定Table 1 Determination of bacteriostatic spectrum of strain XF
注:数据为“平均数±标准误”。下同。
Note:Data are “mean±standard” error.The same below.
2.4 菌株XF的无菌发酵滤液对番茄灰霉菌的抑制作用
发酵60 h的无菌滤液以1∶10和1∶100加入到PDA培养基中,对番茄灰霉有显著的抑制效果(表2),抑菌率可达98.19%和83.73%。处理组番茄灰霉菌与对照组相比,菌丝生长缓慢,稀薄。显微观察(显微镜放大倍数为10×40倍)其边缘菌丝形态显示,与对照组相比,菌丝延伸扭曲,有瘤状突起,相互交缠(图3-C、E),菌丝断裂,胞质外泄(图3-F),分生孢子变成椭球状(图3-B)。
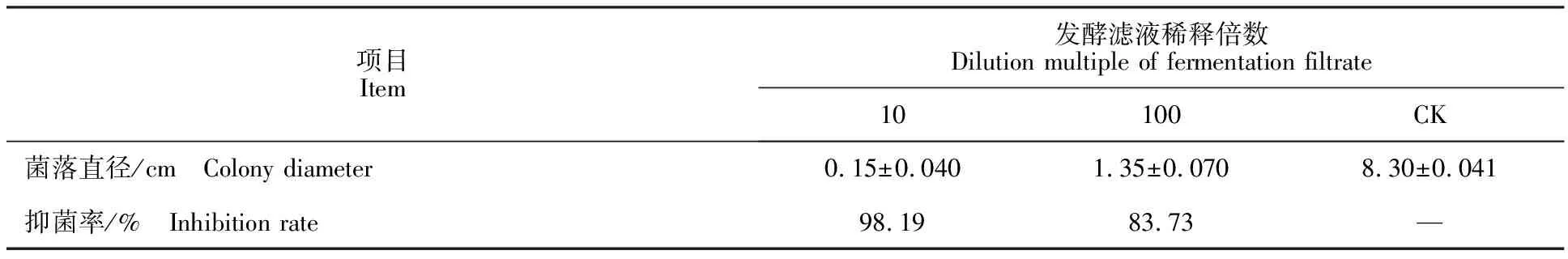
表2 菌株XF的发酵滤液对番茄灰霉菌的抑菌效果Table 2 Effect of strain XF fermentation filtrate on colony diameter and inhibition of B.cinerea

A.正常孢子 Normal spores;B.孢子形态微变 Changed spore morphology;C.菌丝瘤状突起,相互交缠;D.正常菌丝 Normal mycelia;E.菌丝延伸扭曲,瘤状突起 Mycelia elongated , twisted and tuberculous;F.菌丝断裂,胞质外泄 Mycelia ruptured and cytoplasm exserted
图3 菌株XF的无菌发酵滤液对番茄灰霉菌菌丝生长的影响
Fig.3 Inhibition effect of strain XF fermentation filtrate on mycelia morphology ofB.cinere
2.5 菌株XF的生防因子及合成生长素能力的测定
2.5.1 菌株XF分泌蛋白酶、葡聚糖酶、几丁质酶、铁载体能力的定性测定 将菌株XF点接在脱脂牛奶琼脂培养基、Avicel培养基、几丁质检测培养基、铬天青(CAS)检测培养基平板上,48 h后有透明圈产生(表3),表明菌株XF的次生代谢物含有蛋白酶、葡聚糖酶、几丁质酶和铁载体。
2.5.2 菌株XF合成生长素(IAA)能力的测定 定性测定:采用Salkowski比色法的结果表明,在不含色氨酸的金氏培养液接种XF菌株比色反应颜色为淡红色,在含色氨酸的金氏培养液接种XF菌株比色反应颜色为深红色,颜色差异明显(图4)。证明在金氏培养基中加入100 mg/L的色氨酸能显著提高菌株XF合成生长素IAA 的量。
定量测定:采用标准样品IAA制作标准曲线(图5)。在含色氨酸的金氏培养液中,加入比色液比色的OD值为0.575,在不含色氨酸的金氏培养液中,加入比色液比色的OD值为0.302。

表3 菌株XF生防因子的测定Table 3 Determination of biocontrol factor of strain XF
注:++++.D≥2 cm;+++.D=1~2 cm;++.D=0.5~1 cm;+.D<0.5 cm。
Note: ++++.D≥2 cm;+++.D=1-2 cm;++.D=0.5-1 cm;+.D<0.5 cm.

1.CK;2.不含色氨酸 No tryptophan;3.含色氨酸 Contain tryptophan
图4 菌株XF的比色反应
Fig.4 Strain XF colorimetric reaction
根据标准曲线计算得,菌株XF在含色氨酸的金氏培养液中分泌IAA的质量浓度为13.64 mg/L,在不含色氨酸的金氏培养液中分泌IAA的质量浓度为6.59 mg/L,证明色氨酸是菌株XF合成IAA过程中的一种重要前体物质。在后续发酵试验中,可在培养液中适量加入色氨酸,以提高菌株XF分泌IAA的量。

图5 IAA标准曲线Fig.5 IAA standard curve
2.6 菌株XF的鉴定
菌株XF在LB平板上菌落粗糙,似融蜡状(图6-1);菌体细胞杆状,末端方,革兰氏阳性,产芽孢(图6-2红色圈标注)。以菌株XF的总DNA为模板,通过PCR获得16S rDNA基因片段,测序后将数据提交至GenBank数据库进行Blast比对,结果显示,该菌与多种芽孢杆菌Bacillus有较高的同源性,通过MEGA 5.0构建Neighbor Joining系统进化树(图7),其中与蜡样芽孢杆菌(Bacilluscereus)的同源性最高,故确定菌株XF为蜡样芽孢杆菌(Bacilluscereus)。

图6 菌株XF的单菌落(1)及革兰氏染色(2)(10×100倍油镜)Fig.6 Colony(1) and gram staining(2)(the 10×100 times oil mirror) of strain XF
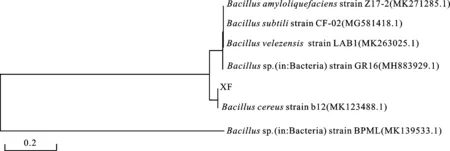
图7 MEGA 5.0构建菌株XF 的系统进化树Fig.7 Phylogenetic tree of strain XF using MEGA 5.0 analysis
3 讨 论
番茄灰霉病已严重影响设施栽培番茄的产量与品质,使用拮抗微生物及其代谢产物进行生物防治,解决了农药残留问题,有效防治了病害的发生,还减缓了病菌的抗药性。因此在番茄的设施栽培中使用有益拮抗微生物进行灰霉病防治,即以菌治病已成为一种有效措施[16-18]。唐容容等[19]研究了蜡样芽孢杆菌BacilluscereusCGMCC4348 菌株对番茄灰霉病菌Botrytiscinerea的生物防治效果,发酵滤液原液对番茄灰霉病的防效达 75.80%;黄海[13]研究了解淀粉芽孢杆菌 Ba168WP 的无菌发酵液对番茄灰霉病菌的抑制效果可达80.63%,且对15 种植物病原真菌均有抑制活性。本研究从甘肃省兴隆山原始森林土壤中分离得到一株蜡样芽孢杆菌,其菌体和发酵滤液对番茄灰霉病菌均有较好的拮抗效果,且效果稳定,同时对番茄叶霉病菌、番茄早疫病菌、茄子菌核病菌、茄子腐烂病菌、枸杞炭疽病菌、棉花枯萎病菌均有拮抗作用,因此是一株有应用前景的生防菌。
国内外学者对芽孢杆菌防治植物病害的机理进行了探索,认为芽孢杆菌可以防治植物病害是因为可以与植物病菌竞争营养和空间位点,并且产生抑菌物质,促进植物生长和诱导植物抗性等[20-23]。Glick[24]认为生防菌株促进植物生长就是间接抑制植物病原菌。Kakar等[25]和Yuan等[26]研究出假单胞菌可产生抗微生物库,包括氰化氢(HCN)、吡虫啉、苯嗪、吡咯硝基、铁蛋白、环脂肽和2,4-二乙酰间苯三酚(DAPG),以及水解酶,如蛋白酶、纤维素酶、几丁质酶和-葡聚糖酶等,以此来抑制番茄灰霉病菌。本研究通过对峙培养和无菌发酵滤液抑制平板上的番茄灰霉菌菌丝的观察发现,处理组菌丝稀薄且生长缓慢;通过对边缘菌丝显微观察发现,菌丝畸形,分支增多,隔间缩小,有囊泡状突起,断裂,内涵质外泄等。通过对菌株XF的蛋白酶活性、几丁质酶活性、葡聚糖酶活性和铁载体活性水平的测定以及对生长素IAA的检测结果显示,葡聚糖酶活性水平最高,为++++;蛋白酶活性水平次之,为+++;几丁质酶活性、铁载体活性水平较低,为+;具有分泌生长素IAA的能力,当在培养液中加入100 mg/L的色氨酸时,IAA的分泌量增长2倍。因此可以推测菌株XF在生长过程中不仅产生了一些酶和活性蛋白类物质,直接抑制番茄灰霉病菌的生长,还产生了植物生长素IAA促进番茄植株的生长而增强对番茄灰霉病的抗性。尽管本试验已确定该蜡样芽胞杆菌对番茄灰霉病菌具有一定的抑制效果, 但具体是哪种活性物质在起作用、其抑菌机制及在田间的防治效果等还有待进一步 研究。
