注水肉快速筛查敏感指标探究
2019-12-06刘丽华张松山张禧庆孙宝忠雷元华修建胜
刘丽华 ,张松山,张禧庆,孙宝忠,雷元华,修建胜,谢 鹏
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.烟台杰科检测服务有限公司,山东莱阳 265231)
关键字:“注水肉”;水分/蛋白质;筛查;聚类分析
自20世纪80年代肉类市场放开经营以来,“注水肉”行为一直屡禁不绝,成为严重危害消费者健康的食品安全问题[1-3]。原国家商务部2001年颁布实施的《畜禽肉水分限量》(GB 18394—2001)国家强制标准,为监管部门提供了执法依据。因当时注水手法单一,在实施初期,该标准对“注水肉”行为起到了极大的震慑作用,有效保障了人们的食品安全,取得了良好的社会效益[4-6]。然而近年来为了躲避监查,不法商贩不断升级畜禽肉注水手法,从单纯注水发展为注水与注射或灌服违法添加物相结合,以达到增大注水量,且肉中水分含量不超标的目的[7]。
与之相应的“注水肉”鉴别手段也从最初的水分含量鉴别[8-9]、感官鉴别[10]、试纸法鉴别[11]、违法添加物筛查[12]等,发展到利用低场核磁技术结合主成分分析方法,来区分生鲜肉与“注水肉”[13-14],利用光谱技术建立“注水肉”判别模型等[15-16]。但从实效来看,这些技术手段准确性有待提高,震慑效果不佳[17],且需要较长的检测时间或专业的检测人员,不利于现场快速筛查。从生理学和病理学角度来看,肉中注水必然会造成机体或肌肉组织中,与水分存在状态有关的某些敏感指标的特异性变化[18]。因此,本研究利用HE 染色法、核磁检测技术和统计学聚类方法,以生鲜肉和“注水肉”中水分、蛋白质、脂肪含量以及水分和蛋白质比值为关键指标,来呈现肉品的指征性变化规律,从而达到鉴别“注水肉”的目的。
1 材料和方法
1.1 试验材料
选择相同饲养条件下,体质量为(95±5)kg的杜大长三元杂交猪234头;随机选择其中153头为生鲜肉组,剩余81头为“注水肉”组。“注水肉”模型建立:先对“注水肉”组活猪,肌内注射现场收缴的违法注水添加物,2 h 后灌服6 kg 清水,以后每间隔3 h 灌服1次,连续2次,2 h 后再灌服1次。对所有试验活猪,按照《生猪屠宰操作规程》(GB/T 17236—2008)屠宰;取左侧胴体背最长肌1 kg,密封后置于4 ℃保温箱中迅速运回实验室,进行相关指标测定。制备HE 组织切片样品时,取背最长肌,沿肌纤维纹理切割约0.5 cm×0.5 cm×0.5 cm大小的肌肉组织块,10%甲醛溶液固定。
1.2 试验仪器
BS214D 型电子天平,购自北京赛多利斯仪器系统有限公司;KD-BM 生物组织包埋机,购自浙江金华科迪仪器设备有限公司;Nikon YS100显微镜,购自南京江南光电股份有限公司;Meso MR23-060H-1型台式核磁共振分析仪,购自上海纽迈电子科技有限公司;KDY-9820型凯式定氮仪,购自北京通润源机电技术有限责任公司。
1.3 试验方法
1.3.1 组织结构测定参考任秋斌[20]的HE 染色法,将HE 组织切片样品,用4%甲醛溶液浸泡48 h,再切割成0.3 cm×0.3 cm×0.3 cm 大小的组织块,用水冲洗,70%酒精脱水过夜,二甲苯透明20 min 后组织包埋、修片、切片、染色,中性树胶封片后显微拍照。
1.3.2 水分分布测定将样品切割成1 cm×1 cm×1 cm 大小的块状,用核磁共振分析仪,测量核磁共振(nuclear magnetic resonance,NMR)横向弛豫时间(T2)。测定时,仪器参数设定选择:CPMG(Carr-Purcell-Meiboom-Gill sequence)序列,测量温度32 ℃,质子共振频率SF=23 MHz,偏移频率O1=286.195 4 kHz,累加次数NS=6,采样点数TD=384 996,PRG=1,模拟增益RG1=20,半回波时间DL1=0.12 ms,回波数NECH=14 000,P1=17 s,P2=35 us,Tw=3 500 ms。每个样品重复测量3次。
1.3.3 营养成分测定参照《食品安全国家标准食品中水分的测定》(GB 5009.3—2016)[21]方法,测定水分含量;参照《食品安全国家标准食品中蛋白质的测定》(GB 5009.3—2016)[22]中第一法:凯式定氮法,测定蛋白质含量;参照《食品安全国家标准食品中脂肪的测定》(GB 5009.3—2016)[23]中第一法:索式抽提法,测定脂肪含量。
1.4 数据统计分析
利用Excel 软件,处理试验数据;采用IBM SPSS Statistics 20、成组t 检验方法,进行组间差异显著性分析。分析时采用双侧检验,试验数据采用均值± 标准差(mean±SD)表示,以P<0.05作为差异显著性判断标准。采用IBM SPSS Modeler 软 件,使 用K-Means 析算法,对试验数据进行聚类分析;使用反演拟合软件V4.09(上海纽迈电子有限公司),分析水分分布的弛豫时间。
2 结果与分析
2.1 肌纤维组织
生鲜肉肌纤维的纵切面组织形态(图1-A)显示,纵切面完整,肌细胞被白色的结缔组织隔开,形态较好;肌纤维排列紧密,肌浆丰富,染色深,横纹清晰。生鲜肉肌纤维的横切面组织形态(图1-B)显示,横断面肌纤维排列紧密,肌浆丰富,染色均匀。
“注水肉”肌纤维的纵切面组织形态(图1-C)显示,纵切面完整,肌细胞边界模糊,形态较差;肌纤维肿胀,呈卷曲波浪状,结缔组织断裂,着色呈现不规则的红白相间条纹状(肌浆流失造成发白),有的整个肌纤维呈灰白色,也有肌纤维断裂现象。“注水肉”肌纤维的横切面组织形态(图1-D)显示,肌浆稀疏,着色浅淡,纤维整体排列无序。
2.2 水分分布
横向弛豫时间测量结果(图2)显示:不同弛豫时间处的特征峰与肉中存在的不同状态水是对应的,即T21、T22和T23(由左至右依次对应的峰)分别表征样品中的结合水、不易流动水和自由水的核磁响应信号[24]。
生鲜肉和“注水肉”的弛豫时间和峰面积比的成组t 检验分析结果(表1)显示:生鲜肉的T21起峰时间和峰顶时间显著晚于“注水肉”(P<0.05),T22结束时间显著早于“注水肉”(P<0.05),峰面积比P21显著小于“注水肉”(P<0.05),峰面积比P22显著大于“注水肉”(P<0.05)。
2.3 营养成分测定

图1 生鲜肉和“注水肉”的肌纤维结构

图2 生鲜肉与“注水肉”的典型横向弛豫时间(T2)
生鲜肉和“注水肉”营养成分的成组t 检验差异分析结果(表2)显示:生鲜肉的蛋白质含量显著高于“注水肉”(P<0.05),脂肪含量略低于“注水肉”;生鲜肉和“注水肉”的水分含量存在显著差异,但二者数值均未超过《畜禽肉水分限量》(GB 18394—2001)所规定的限量值(77%);生鲜肉的水分/蛋白质比值显著低于“注水肉”(P<0.05)。
2.4 营养成分分布规律
生鲜肉和“注水肉”的水分含量分布(图3-A)显示,生鲜肉的水分含量为73.3%~76.6%,“注水肉”为74.2%~76.6%。二者分布区域基本重合,无法有效加以区分。生鲜肉和“注水肉”的脂肪含量分布(图3-B)与水分含量分布呈现相同趋势。

表1 T2的峰时间(ms)和面积比(%)分布
生鲜肉和“注水肉”的蛋白质含量分布(图3-C)显示,生鲜肉的蛋白质含量为20.9%~23.6%,主要集中在22%左右;“注水肉”为18.0%~22.0%,主要集中在19%左右;二者虽具有统计学差异(P<0.05),大部分可以有效区分。
水分/蛋白质比值的分布结果(图3-D)显示,生鲜肉的水分/蛋白质比值为2.80~3.95,主要集中在3.50左右;“注水肉”的水分/蛋白质比值为3.38~4.82,主要集中在4.00左右。二者存在明显差异(P<0.05),大部分可以有效区分。

表2 营养成分含量和水分/蛋白质比值测定结果
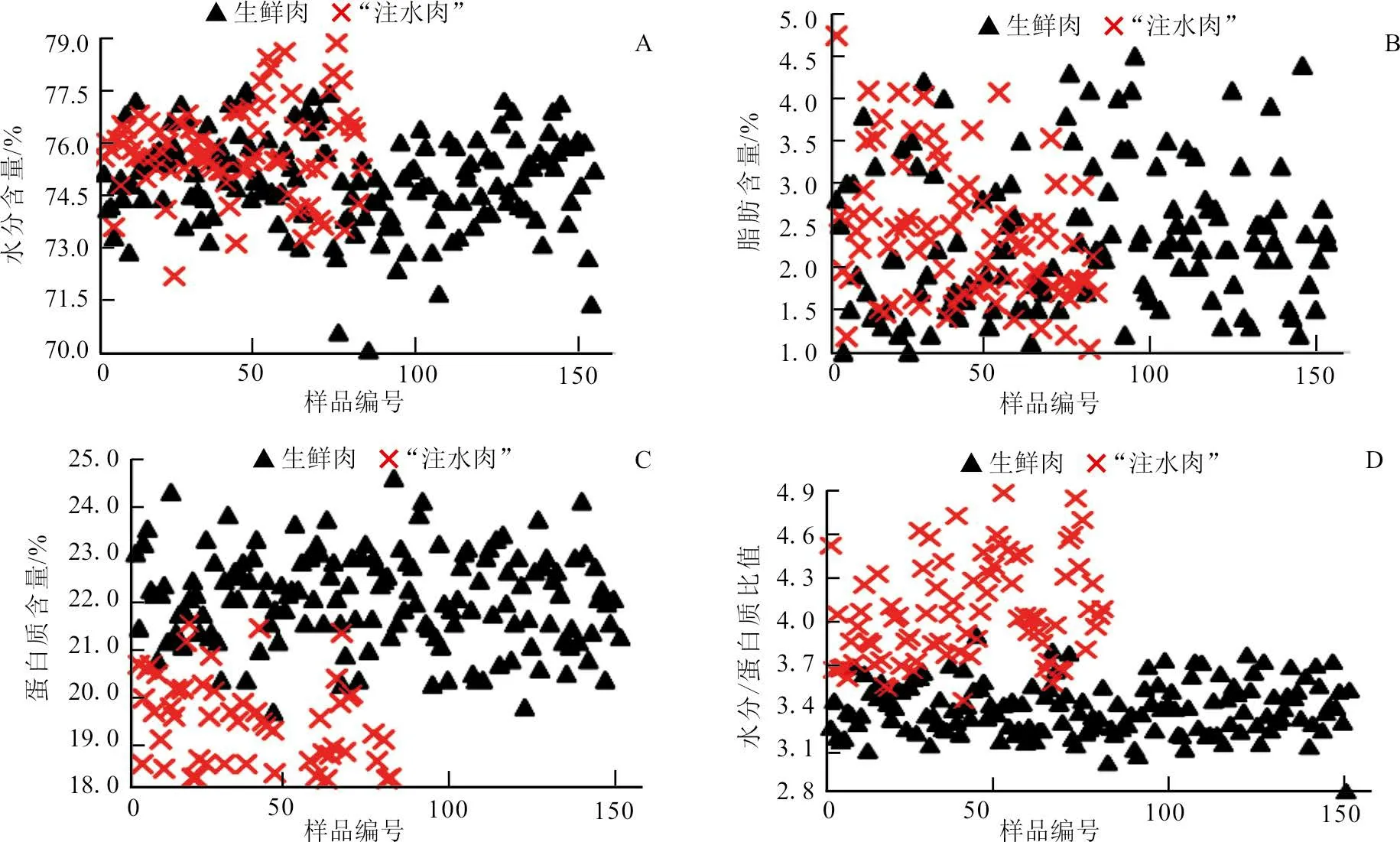
图3 水分、蛋白质、脂肪以及水分/蛋白质比值分布
2.5 营养指标聚类分析
以水分、蛋白质、脂肪、水分/蛋白质比值作为数据源,使用K-Means算法聚类划分生鲜肉和“注水肉”。设置聚类数为2,得出在类别1和类别2中生鲜肉和“注水肉”的个数(表4)。以水分和脂肪分别作为聚类分析项,结果显示生鲜肉和“注水肉”的分布差异不显著(P<0.05)。以蛋白质和水分/蛋白质比值分别作为聚类分析项,结果显示生鲜肉和“注水肉”在两个类别中分布差异都较大(P<0.05)。利用类别1中“注水肉”识别个数除以“注水肉”样品总数计算“注水肉”识别率,各分类项的“注水肉”识别率为80.2%、79.0%、80.2%和88.9%;利用类别2中生鲜肉的识别个数除以生鲜肉总数,计算各分类项的生鲜肉识别率分别为49.7%、94.8%、49.7%和96.7%。结果可见,水分/蛋白质的识别率高于其他分类项。

表4 聚类分析聚类中样品个数结果
3 讨论
HE 染色是肌肉组织学观察的主要方法[25]。李志强[26]研究发现,生鲜猪肉组织的肌纤维排列整齐且纹理清晰可辨别。王彦丽等[27]研究发现,注水行为可使肌细胞渗透压发生显著变化,造成肌细胞破裂,组织形态破坏,因而“注水肉”组织结构呈现肌肉色泽变淡和结缔组织红白花纹不明显的特点。本研究的生鲜猪肉和“注水肉”组织观察结果与以上研究一致。
通常认为LF-NMR 多组分横向弛豫图中,T21反映了与大分子紧密结合的水分,T22反映了蛋白质结构中的水分,而T23则反映了肌纤维外蛋白质晶体结构中存在的水分[28-29]。弛豫时间越短,表明对应水分与底物结合越紧密,水分流动性越低;弛豫时间越长,表明对应水分与底物结合越松散,水分流动性越强[30-31]。本研究发现:“注水肉”的T21起峰和峰顶时间显著早于生鲜肉(P<0.05),P21显著大于生鲜肉(P<0.05),T22峰面积显著小于生鲜肉(P>0.05),P22显著小于生鲜肉(P<0.05)。这与前人研究[32-34]结论一致。而生鲜肉和“注水肉”的T23弛豫时间和峰面积比无显著差异,与王胜威等[35]研究的“注水肉”的T23峰面积显著增大(P<0.05)不一致,其原因可能是其研究利用的是向生鲜肉中直接注水后静置而建立的“注水肉”模型,水分在肉块中可能多以自由水的形式存在。通常情况下,水的流动性越强,弛豫时间越长,自由水的峰面积增大[30]。本研究则是按照现行违法注水操作,活体灌注后采集的样品,因而更具有真实性和代表性。相较于单纯肌肉注水模型,生猪活体注水后必然会引起机体复杂的代谢、代偿反应,同时违法添加物也会影响肌肉组织中水分的流动性,因此导致了本研究中“注水肉”自由水的峰面积比与此前的其他研究不一致。肉的保水性主要取决于肌肉对不易流动水的保持能力。不易流动水主要存在于纤丝、肌原纤维及膜之间。研究显示,不论是肌肉注射水模型,还是本研究使用的活体注射违法添加剂结合水分灌注模型,T22弛豫时间均延长,表明注水行为都对肌肉组织结构产生了损伤,这一点从HE 染色组织学研究也得到了证实。
对比生鲜肉和“注水肉”的水分含量分布可以发现,二者水分含量分布区域基本重叠,不能有效区分“注水肉”,且“注水肉”的水分含量值基本不超过77%的限量值。对生鲜肉和“注水肉”的水分、蛋白质和脂肪的测定结果表明,生鲜肉和“注水肉”单位质量内的脂肪和蛋白质含量发生了显著变化,大大降低了单位肉品中有效营养成分比例[27]。通过含量分布图发现:水分和脂肪含量指标分布区域极度重叠,无法有效区分生鲜肉和“注水肉”;而蛋白质含量和水分/蛋白质比值分布差异显著,可大体区分两者。
有资料[36]显示,在巴西农业畜牧和食品供应部发布的2010年第32号技术规范中,不仅对分割鸡肉的水分含量和蛋白质含量范围提出了要求,并且对水分/蛋白质比值的范围也提出了明确要求。由此可以看出,水分/蛋白质比值已经被一些国家和地区作为评价肉品质量的关键指标。
本研究以营养成分作为聚类分析项,来鉴别生鲜肉和“注水肉”,发现以水分/蛋白质比值的聚类分析结果为最优,其中“注水肉”的识别率为88.9%,生鲜肉的识别率为96.7%,说明利用水分/蛋白质比值能够较准确鉴别生鲜肉和“注水肉”。但受样本量的限制,其具体阈值还有待通过大样本量的测定后加以确定。同时,未来指标阈值的确定可能还要根据物种、品种、年龄等不同而分别研究确定。本研究利用低场核磁技术,重点分析了二者的水分分布差异以及“注水肉”模型特性,因此仅随机各选取6个生鲜肉和“注水肉”样品进行对照分析,而对于所有样品的检测分析,待后续进一步细化研究。
4 结论
本研究模拟当前违法注水案件所采用的方法建立注水肉模型,从水分、蛋白质、脂肪含量以及水分/蛋白质比值等判别“注水肉”指标中,筛选出水分/蛋白质比值为“注水肉”判别的指征性筛查指标,但需进一步研究确定指标阈值。
