鱼类病原性弧菌血清学诊断芯片技术构建
2019-12-06绳秀珍李文涛王欣欣唐小千战文斌
绳秀珍,李文涛,王欣欣,唐小千,邢 婧,战文斌,2
(1.中国海洋大学水产动物病害与免疫学实验室,山东青岛 266003;2.青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室,山东青岛 266071)
弧菌隶属于弧菌科弧菌属(Vibrio),是一类革兰氏阴性菌,可引起海水养殖鱼类、贝类及甲壳类等经济动物的流行性和暴发性死亡,已成为海水养殖动物的主要病原菌之一,给海水养殖产业造成了严重经济损失[1-2]。已报道的海水养殖动物病原弧菌有20多种,其中副溶血弧菌(Vibrio parahaemolyticus)、鳗弧菌(Vibrio anguillarum)、哈维氏弧菌(Vibrio harveyi)、溶藻弧菌(Vibrio alginolyticus)等是海水养殖动物尤其是鱼类弧菌病的主要致病菌[2],并且常出现多种弧菌的混合感染[3]。常规技术每次只能检测单一病原,因而不能全面反映病害发生的原因,这不利于疾病的有效防治,因此迫切需要多病原高通量同步检测技术。免疫芯片技术的基本原理是将抗体或抗原固定在芯片载体上制备微阵列,检测样品中相对应的抗原或抗体,近年来已开始大量应用于人类病原和药物残留的高通量检测,具有多靶标、高通量、并行分析等优势,显示出广阔的应用前景。
细菌是由多种抗原成分组成的复合体。其抗原组分包括菌体抗原、鞭毛抗原、荚膜抗原和菌毛抗原等,能够诱导鱼体产生抗体,因而可以利用抗原-抗体的特异性反应进行病原检测或血清学诊断。但是,各病原菌之间常具有共同的抗原性蛋白,导致不同菌之间存在交叉免疫反应性,因此排除其他菌的交叉反应对结果准确判定的干扰是免疫学技术需要解决的关键问题[4]。传统的免疫学检测诊断技术可以通过筛选病原菌的特异性抗原或者抗体来避免交叉反应,但是费时费力。本课题组前期曾优化了免疫芯片基片制备技术和反应条件[5-6],制备了同步检测鱼类鳗弧菌、海豚链球菌(Streptococcus iniae)、杀鲑气单胞菌(Aeromonas salmonicida)、荧光假单胞菌(Psedomonas fluorescens)、迟缓爱德华氏菌(Edwardsiella tarda)及海分支杆菌(Mycobacterium marinum)6种病原菌的抗体芯片[7],在不筛选病原菌的特异性抗原及抗体情况下,实现了6种病原菌的同步准确检测。
本研究针对鱼肠道弧菌(Vibrio ichthyoenteri)、鳗弧菌、副溶血弧菌、溶藻弧菌、河流弧菌(Vibrio fluvialis)和哈维氏弧菌等鱼类致病性弧菌,提取其菌体蛋白、鞭毛蛋白、外膜蛋白(OMP)和胞外产物(ECP),分析抗原组分的抗原性及其与 6种弧菌的牙鲆抗血清的交叉反应性,构建了6种弧菌血清学诊断抗原芯片,并将其应用于牙鲆(Paralichthys olivaceus)和大菱鲆(Scophthalmus maximus)弧菌病的诊断,以期为鱼类弧菌病的血清学诊断和疫苗免疫效果评价提供技术支撑。
1 材料与方法
1.1 试验鱼、菌株与抗体
健康牙鲆:购自山东省某养殖场(体质量20~27 g),于实验室水族箱中暂养7 d,连续充气,水温控制在20 ℃左右,日投喂商品鱼饲料1次,换水吸污2次。
鳗弧菌、鱼肠道弧菌、溶藻弧菌、副溶血弧菌、哈维氏弧菌以及河流弧菌:由本实验室保存。将各弧菌活化,分别划线培养于2216E固体培养基,在28 ℃条件下培养24 h;用0.01 mol/L 无菌磷酸盐缓冲液(PBS,pH7.4)洗下菌体,4 ℃条件下8 000×g离心15 min,洗涤3次;无菌PBS 重悬,将浓度调整为1×108cfu/mL,4 ℃冰箱保存。
牙鲆抗淋巴囊肿病毒血清[8]及鼠抗牙鲆IgM单抗2D8[9]:由本实验室制备。
1.2 弧菌抗原组分制备
使用Sarkosyl 法[10]提取6种弧菌的外膜蛋白:首先将菌悬液4 ℃、3 000×g离心20 min,0.02 mol/L Tris-HCl(pH8.0)重悬沉淀,超声破碎4 min(振幅39%、脉冲3 s、间隔3 s);4 ℃条件下,将菌液3 000×g离心10 min、23 000×g离心30 min;向沉淀中加入0.1 mL 重蒸水,0.015 mol/L Tris-HCl 0.4 mL(pH7.6,含2.25%十二烷基肌氨酸钠),0.01mol/L Tris-HCl 1.4 mL(pH7.6,含1.5%十二烷基肌氨酸钠)重悬;32 ℃水浴30 min,23 000×g离心30 min,用0.02 mol/L Tris-HCl(pH7.4)重悬,再经23 000×g离心30 min后,0.01 mol/L PBS重悬,即为外膜蛋白样品。
采用平板玻璃纸法[11]提取胞外产物,将6种弧菌的菌悬液转入液体培养基培养24 h,在2216E平板上铺设一层无菌玻璃纸,取0.2 mL 菌液均匀涂布在玻璃纸上,28 ℃条件下培养24~48 h;用3 mL 无菌PBS(pH7.4)洗脱收集每个平板的菌体,4 ℃条件下7 000×g离心30 min;将上清经0.22 μm 滤膜过滤,再加入硫酸铵盐析,将终浓度调整为2.0 mol/L,室温下搅拌1 h,然后4 ℃沉降过夜;次日,4 ℃条件下10 000×g离心1 h,使用无菌PBS 重悬沉淀,再以PBS 透析24 h,即获得胞外产物。
采用酸化高速离心法[12]提取鞭毛蛋白,将6种弧菌悬液于1 500×g离心30 min,收集菌体,使用10 mL 生理盐水重悬;用1 mol/L HC1将pH调整为2.0,室温下搅拌30 min 后,1 500×g离心30 min;将上清液再经53 300×g离心1 h,用1 mol/L NaOH 将pH 调整为7.2,加入硫酸铵至浓度为2.67 mol/L,于4 ℃沉降过夜;次日,53 300×g离心15 min 后,将沉淀溶于2 mL 的0.01 mol/L PBS 中。
全菌蛋白采用各弧菌的破碎液,将菌液置于超声波破碎仪中低温破碎4 min,得到的菌悬液即为全菌蛋白。
获得上述各抗原蛋白后,用Bradford 法[13]测定蛋白含量。
1.3 牙鲆抗血清制备及效价测定
1.3.1 牙鲆抗血清制备将6种弧菌分别使用0.5%~1.0%的甲醛灭活,4 ℃条件下水平振荡48 h;用无菌PBS 清洗细菌,4 ℃条件下8 000×g离心15 min,弃上清,重复3次;用无菌PBS 重悬沉淀,调整菌液浓度为1×108cfu/mL;取0.2 mL 菌液涂于2216E 固体培养基培养24 h,如无细菌生长则表明灭活成功;将牙鲆分为7组,每组30尾;将1×108cfu/mL 的6种灭活弧菌悬液与弗氏完全佐剂混匀(2:1,v/v),腹腔注射牙鲆作为6个试验组,每尾注射0.2 mL;腹腔注射同量PBS 作为对照组,2周后加强免疫,腹腔注射弧菌悬液与弗氏不完全佐剂混合液(2:1,v/v),每尾0.2 mL;1周后,将牙鲆麻醉进行尾静脉采血,室温下倾斜放置1 h,然后4 ℃冰箱过夜;次日,4 ℃条件下10 000×g离心20 min,取上清液即为牙鲆抗血清。连续采血8周,血清保存于-80 ℃冰箱备用,同时抽取对照组牙鲆血清。
1.3.2 ELISA 检测牙鲆血清特异性IgM 水平变化在96孔酶标板中,加入6种弧菌悬液(100 μL/孔),4 ℃包被过夜,然后使用PBST(含吐温-20的PBS 缓冲液)洗3次,每次5 min;使用无菌PBS配制的3%牛血清白蛋白(BSA)于37 ℃封闭1 h,再加入不同时间点的牙鲆抗血清100 μL/孔,37 ℃孵育1 h;每孔加入100 μL 牙鲆IgM 单抗2D8,37 ℃孵育1 h,然后加入100 μL 碱性磷酸酶标记的羊抗鼠IgG(1:5 000),37 ℃孵育45 min;每孔加入100 μL 对硝基苯磷酸脂应用液避光发色5~30 min,再加入50 μL 2 mol/L NaOH 终止反应,稳定3~5 min 后,在405 nm 工作波长下测定OD 值。使用未免疫血清代替牙鲆抗血清作为阴性对照,计算阳性血清与阴性血清光吸收值之比(P/N),P/N≥ 2.1时为阳性。
1.4 牙鲆IgM 单抗标记
按照Glue 活化辣根过氧化物酶(HRP)标记试剂盒的说明,标记牙鲆IgM 单抗2D8;利用Bradford 法测定抗体浓度后,以试剂Ⅰ将抗体浓度调整为1 mg/mL,然后转入试剂Ⅱ活化辣根氧化物酶;4 ℃下离心,使辣根过氧化物酶沉到管底,用试剂Ⅲ将pH 调整为9.5,4 ℃过夜后,加入试剂Ⅳ10 μL,混匀15 min,终止反应;使用1 mol/L HCl将酶标抗体的pH 调为7.0,加甘油至50.0%,-20 ℃保存。
1.5 芯片基片制备
使用前期建立的方法[5]制备抗原芯片基片。首先用洗液将载玻片浸泡过夜,用双蒸水冲洗至中性,晾干;配制1.2%的琼脂糖溶液,吸取2 mL于预热的载玻片上,均匀覆盖,待琼脂糖凝固后,于37 ℃烘箱中干燥。使用前,在室温下将芯片基片用0.02 mol/L NaIO4溶液活化处理30~60 min,使琼脂糖表面醛基化,然后用超纯水洗3遍,干燥后室温保存。
1.6 抗原性分析
用无菌PBS 配制的40.0%~50.0%甘油,调整各抗原组分浓度至1.0 mg/mL;室温下用芯片点样仪点样于芯片基片上,37 ℃固定2 h,PBST 洗3次,每次5 min。设置牙鲆抗淋巴囊肿病毒血清作为阳性对照,PBS 配制的50.0%甘油作为阴性对照。晾干后,用3.0% BSA 封闭1 h,PBST 洗3次;然后分别滴加6种弧菌的牙鲆抗血清,37 ℃孵育1 h,再滴加HRP 标记的牙鲆IgM 单抗2D8(1:2 000),37 ℃孵育1 h;用PBST 洗3次,TMB 发色液避光发色5~20 min,使用2 mol/L H2SO4终止反应,超纯水洗3次后,用芯片扫描仪记录结果。
1.7 牙鲆抗血清与弧菌抗原组分交叉反应分析
将6种弧菌的外膜蛋白、胞外产物、鞭毛蛋白和全菌蛋白分别包被酶标板,按照上述ELISA技术,分析各弧菌的牙鲆抗血清与抗原组分之间的交叉反应。
1.8 抗原芯片构建及检测
将6种弧菌抗原的蛋白浓度分别稀释至1 mg/mL,使用芯片点样仪在芯片基片上点样,使每种弧菌形成一个矩阵。每个矩阵包括4种抗原蛋白及阳性(牙鲆抗淋巴囊肿病毒血清)和阴性(含50 %甘油的PBS 液)对照。按照4×4形式点样,每种成分设置4个重复点,37 ℃固定2 h 后,用PBST将抗原芯片冲洗3次,甩干,冰箱内密封保存。
使用抗原芯片进行检测时,首先用3.0% BSA封闭1 h(无菌PBS 配制,37 ℃),洗涤甩干后,依次滴加牙鲆抗血清及HRP 标记的IgM 单抗2D8(1:3 000),37 ℃孵育1 h;用PBST 洗3次后,再加TMB 发色液避光发色5~20 min,最后使用2 mol/L H2SO4终止反应,超纯水漂洗、晾干,用芯片扫描仪记录结果。
1.9 抗原芯片应用及验证
取鳗弧菌菌液0.2 mL(1×108cfu/mL)腹腔注射牙鲆,观察发病情况;抽取牙鲆尾静脉血,室温倾斜放置1 h,离心取上清作为检测样品,使用构建的抗原芯片进行检测。另外,养殖场送检的发病大菱鲆主要症状表现为体表溃烂、有腹水等,根据症状初步诊断可能是弧菌感染所致。采集大菱鲆血清,使用抗原芯片进行检测。
将96孔酶标板分别包被上述6种弧菌,用ELISA 技术分析牙鲆血清及大菱鲆血清,以验证抗原芯片的检测结果。
2 结果
2.1 弧菌抗原蛋白含量
提取了6种弧菌的外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白,用Bradford 法测定了蛋白含量,结果发现6种弧菌中各抗原蛋白的含量有差异,其中胞外产物中抗原蛋白量最低,哈维氏弧菌最低为1.54 mg/mL(表1)。将抗原蛋白浓度调整为1 mg/mL 用于抗原芯片制备。

表1 Bradford 法测定的各弧菌抗原蛋白含量 单位:mg/mL
2.2 牙鲆抗弧菌特异性IgM 水平变化
ELISA 结果(图1)显示:牙鲆抗6种弧菌血清IgM 与阴性对照血清光吸收值的P/N,在免疫后第2周开始等于或大于2.1,表明产生了特异性抗体,在第4或5周达到峰值,均在第4~6周保持较高水平。所以,使用4~6周的牙鲆抗血清用于后续试验。
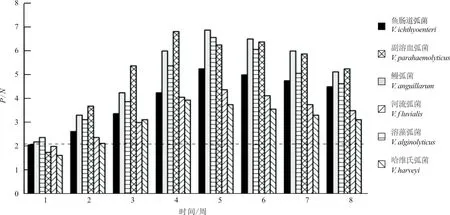
图1 牙鲆免疫后血清特异性IgM 水平变化
2.3 弧菌抗原组分的抗原性分析
结果(图2)显示:6种弧菌的牙鲆抗血清与各自的抗原组分均能发生反应,呈现紫红色,且各矩阵点显色清晰,与阳性对照的显色程度相似,而阴性对照没有明显的紫红色,表明6种弧菌免疫牙鲆后均产生了相应的抗体,且各弧菌组分具有良好的抗原性。因此,提取的各弧菌抗原组分可以用于构建抗原芯片。
2.4 牙鲆抗血清与弧菌抗原组分的免疫交叉反应
牙鲆抗血清与6种弧菌全菌蛋白的免疫反应结果显示,各弧菌的牙鲆抗血清与各自的抗原蛋白反应最强(图3-A)。另外,鱼肠道弧菌抗血清与溶藻弧菌、鳗弧菌、副溶血弧菌的全菌蛋白之间有较明显交叉反应;鳗弧菌抗血清与溶藻弧菌全菌蛋白、溶藻弧菌抗血清与副溶血弧菌全菌蛋白、副溶血弧菌抗血清与溶藻弧菌全菌蛋白之间交叉反应较弱;哈维氏弧菌、河流弧菌抗血清与其它弧菌的全菌蛋白之间无交叉反应。

图2 6种弧菌组分的抗原性分析结果
牙鲆抗血清与6种弧菌OMP 的反应结果(图3-B)显示,各弧菌的牙鲆抗血清与各自的OMP反应最强。另外,鱼肠道弧菌抗血清与哈维氏弧菌、鳗弧菌、溶藻弧菌及副溶血弧菌OMP 之间有较明显的交叉反应;鳗弧菌抗血清与溶藻弧菌、哈维氏弧菌OMP 之间交叉反应较弱,而河流弧菌抗血清与鳗弧菌、副溶血弧菌OMP 之间也有微弱反应;哈维氏弧菌、溶藻弧菌、副溶血弧菌抗血清与其他弧菌OMP 无交叉反应。
牙鲆抗血清与胞外产物的反应结果(图3-C)显示,6种弧菌的牙鲆抗血清分别与各自的胞外产物反应最强烈。另外,鱼肠道弧菌、河流弧菌抗血清与其他菌胞外产物之间有明显的交叉反应,但其他菌抗血清与胞外产物之间无交叉反应。
牙鲆抗血清与弧菌鞭毛蛋白反应结果(图3-D)显示,6种弧菌的牙鲆抗血清分别与各自的鞭毛蛋白反应最强,副溶血弧菌抗血清与鱼肠道弧菌、河流弧菌的鞭毛蛋白有较弱反应,而哈维氏弧菌、河流弧菌、鳗弧菌、溶藻弧菌抗血清与其它弧菌的鞭毛蛋白无交叉反应。
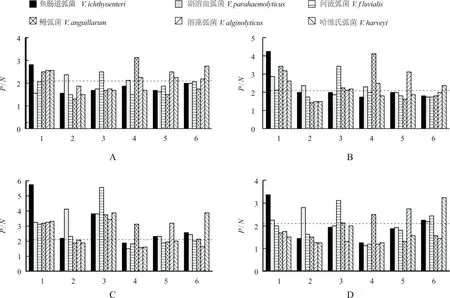
图3 牙鲆抗血清与抗原组分之间的免疫交叉分析结果
2.5 抗原芯片检测结果判定
将6种弧菌的抗原组分,按照示意图所示制备抗原微阵列(图4-A),分别对6种弧菌的牙鲆抗血清进行检测。结果(图4-B)显示:阳性对照呈现明显紫色,阴性对照不显色;各弧菌的牙鲆抗血清与各自抗原点的颜色反应与阳性对照类似,所有矩阵点皆为紫色,但是与其他弧菌抗原点不反应或者仅部分抗原点反应而呈浅紫色。以检测鱼肠道弧菌抗血清为例,滴加鱼肠道弧菌抗血清后,鱼肠道弧菌矩阵中所有抗原点均显示紫红色,颜色与阳性对照点相似(图4-B-a);除此之外,溶藻弧菌矩阵中全菌蛋白和外膜蛋白,以及鳗弧菌矩阵的外膜蛋白点与鱼肠道弧菌抗血清发生交叉反应而显色,而其他抗原点则不显色。由此,结合免疫交叉反应结果,确定抗原芯片检测结果的判定方法如下:阳性对照点呈紫红色,阴性对照点呈无色;如果某抗原矩阵中的所有抗原点均呈紫红色,表明检测结果为阳性,若所有抗原点均无色则为阴性;如果某抗原矩阵中仅部分抗原点显色,则为交叉反应;如果阳性对照点为无色,说明抗体活性消失或者检测操作有问题,结果为无效。
根据确定的检测结果判定方法和牙鲆抗血清检测结果,可知图4-B-b 检测样品中存在鳗弧菌抗体,图4-B-c 检测样品中存在溶藻弧菌抗体,图4-B-d 检测样品中存在副溶血弧菌抗体,图4-B-e检测样品中存在河流弧菌抗体,图4-B-f 检测样品中存在哈维氏弧菌抗体。

图4 抗原芯片示意图及其对6种弧菌的牙鲆抗血清的检测结果
2.6 抗原芯片在牙鲆和大菱鲆弧菌病诊断中的应用
利用制备的抗原芯片检测牙鲆血清时,鳗弧菌矩阵的所有抗原点皆显示紫红色(图5-A),表明血清中具有鳗弧菌的特异性抗体,即牙鲆被鳗弧菌感染。当检测大菱鲆血清时,抗原芯片上溶藻弧菌矩阵的抗原点全部显色(图5-B),可以判定大菱鲆被溶藻弧菌感染。阳性对照矩阵点皆显示紫红色,而阴性对照点不显色。
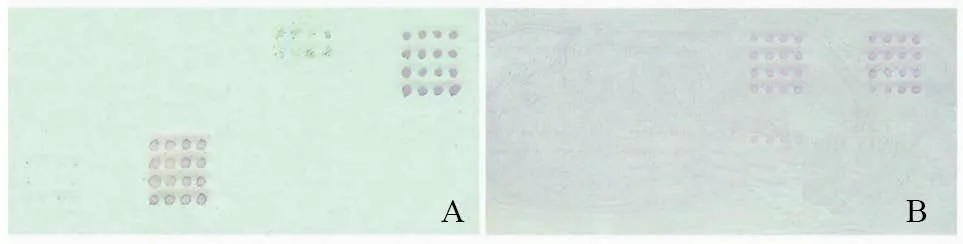
图5 抗原芯片检测患病牙鲆和大菱鲆血清结果
ELISA 结果(图6)显示:牙鲆血清与鳗弧菌反应最强烈,表明牙鲆被鳗弧菌感染;而大菱鲆血清与溶藻弧菌的反应最强烈,表明大菱鲆被溶藻弧菌感染。该结果与抗原芯片检测结果一致。
3 讨论

图6 牙鲆和大菱鲆血清ELISA 检测结果
细菌的外膜蛋白、胞外产物、鞭毛蛋白等抗原组分在其致病过程中皆发挥重要作用。因细菌表面抗原与宿主免疫系统相互作用会产生特异性抗体,所以针对抗原特异性抗体的检测常用于病原感染的血清学诊断、免疫状态评价及流行病学研究[4]。传统的免疫学技术,如免疫荧光技术、ELISA 等,一般每次操作只能检测一种成分,且常常需要对血清进行系列稀释,因而延长了诊断时间,需要的样品和试剂量也较多[14]。病原菌之间的共同抗原导致的免疫交叉反应是免疫学检测技术需要考虑的主要干扰因素。本研究在使用全菌蛋白的同时,使用了外膜蛋白、胞外产物和鞭毛蛋白。它们与其他弧菌抗血清的交叉反应相对较弱,尤其是胞外产物和鞭毛蛋白与其他弧菌抗血清几乎没有交叉反应,能够保证抗原芯片的部分抗原点与其他弧菌抗血清无反应,从而不显色,有助于排除交叉反应的干扰。本研究构建的6种弧菌血清学诊断抗原芯片,在载玻片上很小的区域内,将1种弧菌的多种抗原蛋白排列成矩阵,每种抗原蛋白设置4个重复点,并同时设置阳性和阴性对照点,矩阵内所有抗原点同时显色则为阳性,部分显色则为交叉反应。这种多靶标并行检测的方法有效避免了交叉反应对阳性结果判定的干扰,保证了检测结果的准确性。另外,使用很少量的检测血清样品及试剂情况下,一次操作可同步完成多种抗原-抗体反应。这种高通量检测模式保证了在不筛选特异性抗原情况下,可以实现多靶标的准确检测,因而大大提高了检测效率,节约了检测成本,克服了传统免疫学检测技术的不足[3,12];而使用酶标二抗作为检测抗体,使检测结果肉眼可见,也可使用普通照相机或扫描仪记录结果,因而提高了抗原芯片的实用性。
蛋白芯片通常使用载玻片作为载体,以满足芯片的高密度、检测样品用量少及定量需求。而保存蛋白质构象以保持其三维结构、功能和结合位点,对于保持蛋白芯片的稳定性以及蛋白间的相互作用皆非常重要[15]。本课题组前期比较了不同载体用于蛋白芯片制备的效果以及不同修饰载体的原子力显微镜表征,发现琼脂糖修饰玻片具有均匀的三维多孔结构,有利于抗体的物理吸附及抗原活性的保持[5-6]。因此,本研究采用琼脂糖修饰玻片作为抗原芯片基片,以更好地保存蛋白质的天然构象和抗原性[14]。另外,为了保证有足够的抗原与血清抗体反应,本研究设置了较高浓度的抗原含量(1 μg/mL),结果发现在抗原矩阵中所有抗原点可以同时显示相似的紫红色,与阳性对照点的颜色类似,这有助于准确区分阳性结果和交叉反应。
本研究利用制备的诊断抗原芯片,检测患病牙鲆和大菱鲆血清,发现鳗弧菌矩阵和溶藻弧菌矩阵的所有抗原点均呈现紫红色,表明两种鱼的血清中分别含有鳗弧菌和溶藻弧菌的特异性抗体,即分别被鳗弧菌和溶藻弧菌感染,而其他矩阵仅部分抗原点显示浅紫色,则表示为交叉反应,ELISA 检测结果也验证了这一结果的准确性。文献[16]显示:大菱鲆IgM 基因结构与牙鲆很相似,且大菱鲆IgM 单抗与牙鲆IgM 有一定程度的交叉反应[17]。本研究使用HRP 标记的牙鲆IgM 单抗作为检测抗体,可同时与牙鲆及大菱鲆血清抗体发生结合反应,表明构建的抗原芯片能够用于牙鲆和大菱鲆弧菌病的血清学诊断。本课题组前期曾制备了抗大菱鲆[18]、许氏平鲉(Sebastes schlegeli)[19]、半滑舌鳎(Cynoglossus semilaevis)[20]和花鲈(Lateolabrax japonicus)[21]的IgM 单克隆抗体,发现半滑舌鳎IgM 单抗与牙鲆、大菱鲆、花鲈、许氏平鲉等鱼类的IgM 不发生交叉反应[19],而花鲈IgM 单抗与牙鲆、大菱鲆、半滑舌鳎、许氏平鲉等鱼类的IgM也无交叉[20],因此本研究构建的抗原芯片在使用牙鲆IgM 单抗作为检测抗体情况下,不能对所有鱼类弧菌病的血清学诊断。但是,仅需使用其他鱼类的IgM 单抗代替牙鲆IgM 单抗作为检测抗体,该抗原芯片即可应用于其他鱼类的弧菌病诊断,而且本课题组研制的多种鱼类IgM 单抗也为该抗原芯片应用于鱼类弧菌病的血清学诊断提供了材料基础。另外,构建的抗原芯片可以准确检测6种弧菌的特异性抗体,表明该芯片也可以用于这6种弧菌疫苗的免疫效果评价。
