PM2.5降尘对大鼠的急性肺损伤及复合维生素B的干预作用研究
2019-11-28唐兰兰邓胤铭付茜茜扈正权张青碧霍婷婷
唐兰兰,邓胤铭,付茜茜,扈正权,张青碧,霍婷婷,柏 ●
(1. 西南医科大学 公共卫生学院, 四川 泸州 646000; 2. 西南科技大学 固体废物处理与资源化教育部重点实验室, 四川 绵阳 621000; 3. 泸州市环境监测中心站, 四川 泸州 646000)
大气颗粒物PM2.5由于具有粒径小、比表面积大和易吸附空气中有毒有害物质的特点,会对人体造成严重危害。大量研究结果显示,空气中PM2.5的浓度与呼吸系统疾病、哮喘和冠状动脉粥样硬化等的发病率、死亡率有紧密的联系(Andersonetal., 2012; Gehringetal., 2015; Jacqueminetal., 2015)。PM2.5能深入肺部细支气管和肺泡,从而刺激机体肺部或全身发生炎症和氧化应激(Brooketal., 2010; 章如新等, 2017; 鹿奎奎等, 2017),造成肺部损伤。由此可见,PM2.5对人健康的影响非常严重,应受到广泛关注。但仅靠环境污染治理难以在短时间内有所成效,因此,寻找合理有效的抗PM2.5损伤的物质就很有必要。现今,已有维生素E(李莉珊等, 2016)、红景天(刘平安等, 2015)、富硒酵母(刘洁等, 2017)和阿胶(Liuetal., 2018)等具有抗炎、抗氧化物质引入了干预PM2.5损伤的研究中。有研究表明,PM2.5暴露能使DNA的甲基化发生改变,而这些改变被认为可能是PM2.5诱导机体炎症和氧化应激的基础(Baccarellietal., 2009; Pannietal., 2016)。而DNA甲基化依赖于能够提供甲基的营养素(如B族维生素的叶酸、B6、B12、蛋氨酸等氨基酸)(Ramchandanietal., 1999; Dolinoyetal., 2006; Cropleyetal., 2007)。因此,如果能防止异常的DNA甲基化或许能够抑制PM2.5暴露导致的肺部损伤。B族维生素已用在许多肺部疾病的治疗中,但用于干预PM2.5暴露对机体损伤的研究还很少。Zhong 等(2017)对人群的研究结果显示复合维生素B的补充能够阻止PM2.5暴露导致的线粒体DNA甲基化的改变,但维生素B能否最终减缓PM2.5导致的急性肺损伤还需进一步研究。
本研究拟用PM2.5降尘对SD大鼠进行多次非暴露式气管滴注染毒,给予复合维生素B(叶酸、B6和B12)灌胃干预,观察大鼠肺部病理变化,收集支气管肺泡灌洗液测定总蛋白(TP)、乳酸脱氢酶(LDH)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、丙二醛(MDA)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等指标,从而进一步观察大鼠肺损伤程度的变化,分析复合维生素B对PM2.5所致大鼠肺损伤的保护作用及可能机制,为B族维生素应用于预防PM2.5对健康造成影响提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂
主要仪器有7200型分光光度计(优尼柯上海仪器公司,FJ7200)、酶标仪(Thermo Multiskan Spectrum)、5810R冷冻离心机(Eppendorf,5810R)、数字切片扫描系统(3D Hiestech,Pannoramic 250),试剂包括总蛋白(TP)、乳酸脱氢酶(LDH)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、丙二醛(MDA)和过氧化氢酶(CAT)检测试剂盒(南京建成生物工程研究所)。
1.1.2 实验动物
选用8~10周龄的雄性SD大鼠56只,体重180~200 g,购自西南医科大学实验动物中心[许可证号:SYXK(川)2018-065]。饲养于西南医科大学实验动物中心SPF级动物实验室,自由饮食饮水,饲养温度25±1℃,相对湿度50±5%,昼夜节律为12 h昼夜交替,适应性饲养1周以上。所有的动物研究经西南医科大学动物保护与实验伦理委员会批准。
1.1.3 PM2.5降尘的采集与悬液制备
PM2.5降尘样本由西南科技大学固体废物处理与资源化教育部重点实验室提供。将收集到的PM2.5降尘使用卧式行星球磨机(转速40 Hz)于乙醇中研磨 8 h 后,采用激光粒度分析仪测定研磨后样品在水溶液中的分散粒度,结果显示大部分粉尘粒径≤ 2. 5 μm,符合本实验要求粒度。采用X射线衍射仪对样本的物相分析结果显示降尘中主要物相为石英(杨洁等, 2017)。将收集到的PM2.5降尘与无菌生理盐水混合配制成浓度为0.4、2.0、10.0 mg/mL的PM2.5悬液,低温避光保存,使用前超声30 min混匀后使用。
1.1.4 复合维生素B的配制
干预组复合维生素B的浓度参考Zhong 等(2017)的研究。每片复合维生素B(Webber Naturals, 加拿大产)含1 mg叶酸、50 mg维生素B6、125 μg维生素B12,溶于50 mL纯净水,配得维生素B干预浓度为0.02 mg/mL叶酸、1 mg/mL维生素B6、 0.002 5 mg/mL维生素B12。
1.2 方法
1.2.1 大鼠分组与染毒
设对照组、PM2.5低剂量组(0.4 mg/mL)、PM2.5中剂量组(2.0 mg/mL)、PM2.5高剂量组(10.0 mg/mL)、PM2.5低剂量+复合维生素B组、PM2.5中剂量+复合维生素B组和PM2.5高剂量+复合维生素B组,每组大鼠8只,共56只。干预组和PM2.5组分别以0.01 mL/g的量对大鼠灌胃复合维生素B和纯净水28天后,腹腔注射2%戊巴比妥钠0.25 mL/100 g麻醉大鼠,采用非暴露式气管滴注(柏●等, 2017)进行PM2.5染毒,共3次,每次0.5 mL,每次间隔24 h,染毒期间继续使用复合维生素B或纯净水灌胃。空白对照组用无菌生理盐水滴注和纯净水灌胃。
1.2.2 样本采集及处理
末次染毒后24 h将大鼠麻醉仰卧固定,打开胸腔,暴露气管,灌洗左肺收集支气管肺泡灌洗液(BALF)(柏●等, 2017),1 000 r/min离心10 min,收集上清液于塑料离心管中,分装标记置于-80℃冰箱保存备用。取右侧肺叶主支气管周围肺组织,经生理盐水反复冲洗后,置于福尔马林缓冲液固定,石蜡包埋后切片,经HE(苏木素-伊红)染色,用数字切片扫描系统(Pannoramic 250)观察肺组织损伤和炎性细胞浸润情况。
为进一步明确各处理组大鼠肺损伤的病理分级,根据Szarka 等(1997)建立的病理学分级标准,将肺损伤状况分为0~Ⅴ级,分级标准如表1所示。

表 1 急性肺损伤病理学评分标准Table 1 Pathological scoring criteria for acute lung injury
每个剂量组选取8张病理切片,每片镜下分别截取2张 200 倍彩图照片,基于炎性细胞浸润程度以及肺泡壁增厚程度等病理指标进行评分,评分过程中严格采用双盲法进行病理分级。
1.2.3 BALF中TP、LDH、AKP、ACP、MDA、SOD和CAT的测定
用考马斯亮蓝法、2,4-二硝基苯肼比色法、分光光度法、硫代巴比妥酸法、黄嘌呤氧化酶法和钼酸铵法分别测定BALF中的TP、LDH、AKP、ACP、MDA、SOD和CAT的含量。测试按试剂盒说明书操作(南京建成生物工程研究所)。
1.3 数据处理与分析
2 结果
2.1 肺组织病理学形态改变
不同剂量的PM2.5对肺组织形态学的改变和复合维生素B干预PM2.5所致肺损伤的结果见图1。对照组结构清晰,形态正常(图1a);PM2.5各剂量组有炎性细胞浸润、肺间隔增宽,部分肺泡塌陷、融合等不同程度病理性改变,且随染毒剂量的增加而逐渐加重(图1b、1d、1f箭头所示);而PM2.5各剂量对应的复合维生素B干预组中炎性细胞浸润均有所减少,肺间隔及肺泡塌陷、融合等病理改变有不同程度的减轻(图1c、1e、1g箭头所示)。
2.2 大鼠肺组织病理分级
各处理大鼠肺组织病理分级结果见表2,秩和检验结果显示总体差异有统计学意义。与空白对照组相比,PM2.5各剂量染毒组的秩均值均升高,且随染毒剂量的增加而逐渐升高(P<0.05);PM2.5中、高剂量+复合维生素B组与其对应的染毒组相比,秩均值显著降低(P<0.05),而PM2.5低剂量+复合维生素B组与其对应的染毒组相比,秩均值无显著差异。

图 1 大鼠肺组织病理学形态改变Fig. 1 The histopathologic change of rats’ lung tissuesa—空白对照组; b—PM2.5低剂量组; c—PM2.5低剂量+复合维生素B组; d—PM2.5中剂量组; e—PM2.5中剂量+复合维生素B组; f—PM2.5高剂量组; g—PM2.5高剂量+复合维生素B组a—control group; b—low dose of PM2.5 group; c—low dose of PM2.5+vitamin B complex group; d—medium dose of PM2.5 group; e—medium dose of PM2.5+vitamin B complex group; f—high dose of PM2.5 group; g—high dose of PM2.5+vitamin B complex group
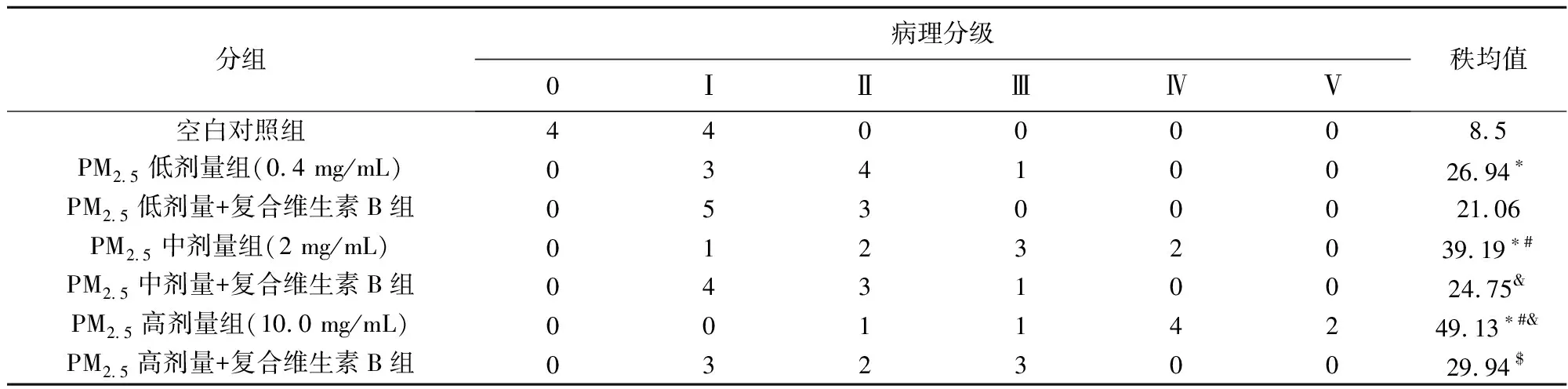
分组病理分级0ⅠⅡⅢⅣⅤ秩均值空白对照组4400008.5PM2.5低剂量组(0.4 mg/mL)03410026.94∗PM2.5低剂量+复合维生素B组05300021.06PM2.5中剂量组(2 mg/mL)01232039.19∗#PM2.5中剂量+复合维生素B组04310024.75&PM2.5高剂量组(10.0 mg/mL)00114249.13∗#&PM2.5高剂量+复合维生素B组03230029.94$
*—与空白对照组相比有显著差异; #—与PM2.5低剂量组相比有显著差异; &—与PM2.5中剂量组相比有显著差异; $—与PM2.5高剂量组相比有显著差异(P<0.05,n=8)。
2.3 大鼠BALF中TP、LDH、ACP和AKP的含量变化
不同剂量的PM2.5及其对应的复合维生素B处理对大鼠BALF中TP、LDH、ACP和AKP含量变化的影响如图2所示。与对照组相比,低、中、高剂量的PM2.5暴露可引起大鼠BALF中LDH、AKP、ACP和TP含量显著升高(P<0.05),且TP含量随染毒剂量的增加而升高(P<0.05);PM2.5低、中、高剂量+复合维生素B组的LDH和TP含量显著降低(P<0.05);PM2.5低、高剂量+复合维生素B组BALF中ACP含量显著降低 (P<0.05);PM2.5中剂量+复合维生素B组BALF中ACP含量无显著改变;仅有PM2.5低剂量+复合维生素B组AKP含量降低(P<0.05),其余干预组AKP含量无显著变化。
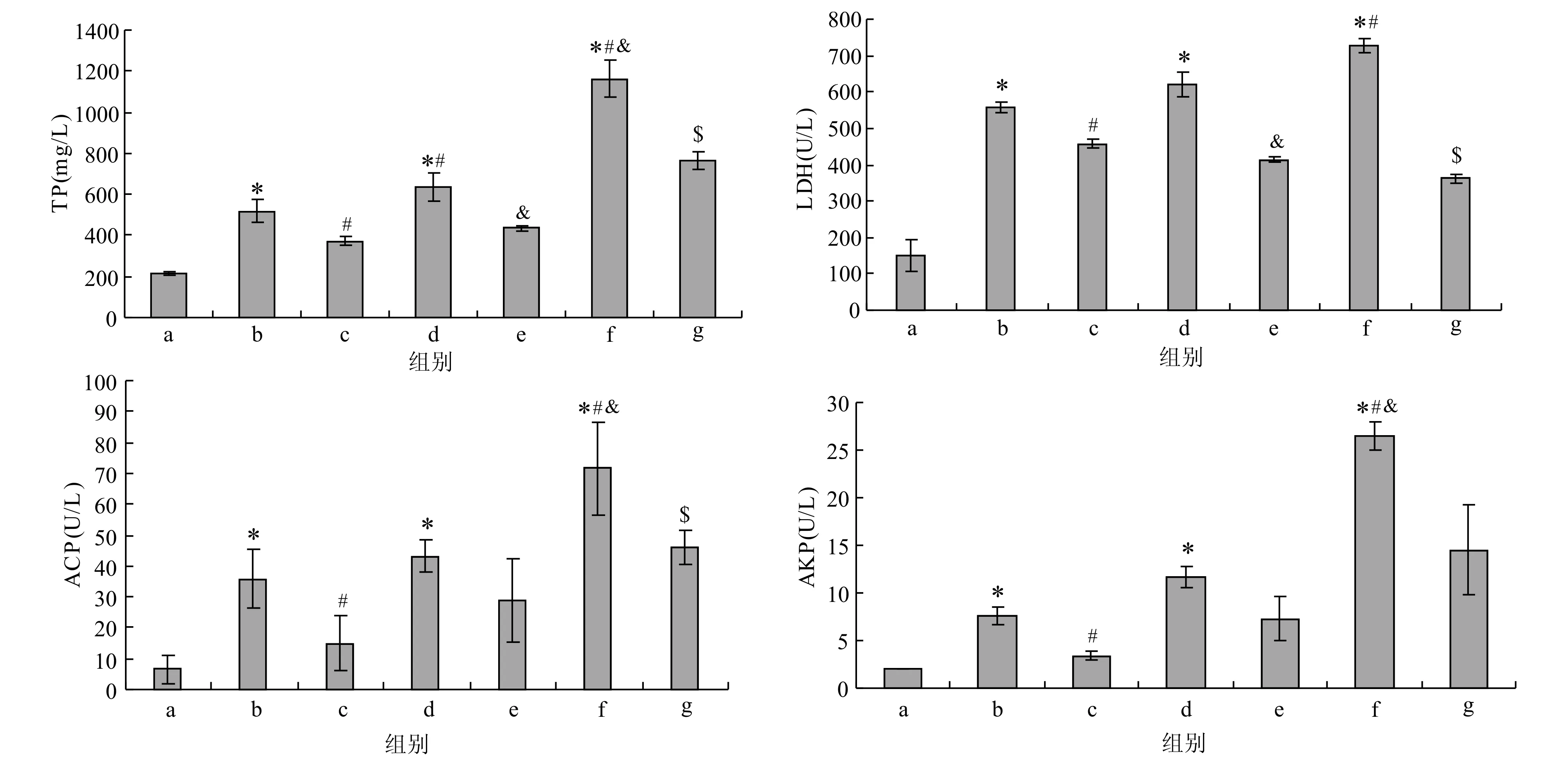
图 2 大鼠BALF中TP、LDH、ACP和AKP的含量Fig. 2 The content of TP, LDH, ACP and AKP in BALF*—与空白对照组相比有显著差异; #—与PM2.5低剂量组相比有显著差异; &—与PM2.5中剂量组相比有显著差异; $—与PM2.5高剂量组相比有显著差异(P<0.05, n=8)*—significant difference compared with the control group; #—significant difference compared with the low dose of PM2.5 group; &—significant difference compared with the medium dose of PM2.5 group; $—significant difference compared with the high dose of PM2.5 group (P<0.05, n=8)
2.4 大鼠BALF中SOD、MDA和CAT的含量变化
不同剂量的PM2.5及其对应的复合维生素B处理对大鼠BALF中MDA、SOD和CAT的含量变化的影响如图3所示。与对照组相比,低、中、高剂量的PM2.5染毒可引起大鼠BALF中MDA含量显著升高(P<0.05),而SOD和CAT活性显著降低(P<0.05),且MDA含量随染毒剂量的增加而升高(P<0.05),CAT活性随染毒剂量的增加而降低(P<0.05);PM2.5低、中、高剂量+复合维生素B组中MDA含量显著降低(P<0.05),而SOD和CAT活性显著升高(P<0.05)。

图 3 BALF中SOD、MDA和CAT的含量Fig. 3 The content of SOD, MDA and CAT in BALF*—与空白对照组相比有显著差异; #—与PM2.5低剂量组相比有显著差异; &—与PM2.5中剂量组相比有显著差异; $—与PM2.5高剂量组相比有显著差异(P<0.05, n=8)*—significant difference compared with the control group; #—significant difference compared with the low dose of PM2.5 group; &—significant difference compared with the medium dose of PM2.5 group; $—significant difference compared with the high dose of PM2.5 group (P<0.05, n=8)
3 讨论
PM2.5粒径小,比表面积大,易于富集空气中的有毒有害物质,通过呼吸道进入肺泡并沉积,通过肺泡入血,随血液流经全身,引起肺部和全身发生炎症反应和氧化应激。急性肺损伤(刘平安等, 2015)是各种直接或间接因素导致肺泡上皮细胞及毛细血管内皮细胞损伤,主要特征为弥漫性肺间质和肺泡水肿,严重时可导致急性呼吸窘迫综合征,至今仍缺乏有效治疗方法。因此,寻找合理有效的抗PM2.5损伤的物质就很有必要。本研究采用PM2.5降尘对SD大鼠进行多次非暴露式气管滴注染毒,并给予复合维生素B(叶酸、B6和B12)灌胃干预,探讨复合维生素B能否对PM2.5所致大鼠急性肺损伤起到保护作用。
TP主要来源于血浆渗出,是一种渗透性标志物,它的水平能够反映肺部血管通透性的破坏程度,TP的升高提示肺泡上皮-毛细血管屏障的完整性受到损伤(钱春燕等, 2011),血浆中的总蛋白、白蛋白大量释放。LDH和AKP是细胞毒性标志物,LDH属于胞浆酶,它的升高是反映细胞膜损伤的早期敏感指标;AKP是由肺泡Ⅱ型细胞产生,被认为是肺泡Ⅱ型细胞损伤或増生的一个特异性的生物标志,当细胞膜损伤或者细胞死亡溶解后,体内的生物酶LDH、AKP会大量释放(杨凌, 2014)。ACP是一种溶酶体酶,主要存在于巨噬细胞中,参与肺部的防御反应,当外界异物侵入肺部时,肺巨噬细胞因发挥吞噬作用而崩解,大量的ACP就会进入肺泡灌洗液(钱春燕等, 2011)。本研究结果显示,PM2.5染毒后,BALF中ACP、AKP、LDH和TP的含量明显增加,肺部出现炎性细胞浸润、肺间隔增宽,部分肺泡塌陷、融合等病理改变,10.0 mg/mL的PM2.5染毒造成的肺组织病理学形态改变最为严重。在取材过程中还发现各组肺组织均有不同程度水肿,病理等级也随染毒剂量的增加呈逐渐加重的趋势,说明PM2.5进入肺部后改变肺泡Ⅱ型细胞和巨噬细胞细胞膜通透性或使细胞死亡,导致各种细胞酶渗出增加,还能破坏肺泡上皮-毛细血管屏障,造成肺水肿(Matthayetal., 2002),甚至使肺泡结构被破坏,最终导致急性肺损伤发生。而复合维生素B的干预使各染毒剂量的大鼠BALF中的ACP、AKP、LDH和TP的含量均呈现降低的趋势,肺组织水肿和病理损伤均有所缓解,降低肺组织病理学评分,减缓肺损伤。
上述反应可以在一定程度上造成肺损伤,氧化应激同样也是介导肺损伤的重要途径。当机体受到氧化损伤时,会刺激机体内的抗氧化防御系统,使机体氧化/抗氧化处于平衡状态。有研究表明,当给大鼠肺部滴注PM2.5悬液后,由于PM2.5成分中含有大量的重金属元素,可以使机体产生过量的自由基,当机体清除自由基的能力无法代偿时,就会产生氧化损伤,使肺泡上皮和血管内皮细胞产生MDA和NO等,同时相关的抗氧化酶如SOD和CAT的含量或活力降低,加速脂质过氧化(Gomes and Negrato, 2014),造成氧化应激,导致机体损伤(Gengetal., 2013; 张岳, 2016)。MDA是脂质过氧化过程中的重要中间产物,是反映机体氧化损伤严重程度的常用指标,SOD和CAT是反映机体清除氧自由基能力的指标,这3个指标常常配合用来反映机体的氧化应激水平(舒琴, 2013;杨一兵, 2018)。本研究结果显示,不同浓度的PM2.5染毒可以使肺泡灌洗液中MDA含量显著升高,且随染毒剂量的增加而升高,SOD和CAT活性显著降低,且CAT活性随染毒剂量的增加而降低。此结果与之前的研究结果一致(Maciejczyketal., 2010; Gomes and Negrato, 2014; 李莉珊等, 2016; 周艳丽等, 2017; 戚子云等, 2019)。这表明当大鼠吸入PM2.5后,肺部氧化和抗氧化平衡被打破,肺泡上皮细胞和血管内皮细胞受到损伤,细胞膜通透性增加,最终引起肺损伤。而复合维生素B的干预能在一定程度上逆转此氧化应激,使MDA的含量呈降低的趋势,SOD和CAT的活力也明显升高。B族维生素是所有人体组织必不可少的水溶性维生素,人体无法自行制造合成,必须额外补充,广泛存在于各种食物中。有研究表明,B族维生素中的叶酸可以通过调控甲基转移酶的活性,刺激DNMTs的mRNA和蛋白表达,提高DNA总甲基化水平,进而影响疾病的发生发展(Wenetal., 2015)。叶酸也可在体内经一碳循环转化为SAM。SAM是体内活性甲基的主要供体,直接参与DNA甲基化反应,进而参与调控相关基因表达。维生素B6和B12是这一代谢中必要的辅酶因子,其中任意一个的缺乏都会使代谢循环发生紊乱,进而影响DNA甲基化。有研究表明,异常的DNA甲基化与许多疾病的发生发展有关(Husnietal., 2016)。因此,此3种B族维生素联合使用也许可以阻止PM2.5暴露导致的DNA甲基化的改变,从而减少PM2.5暴露对机体的损伤作用,但有关作用机制有待进一步研究。
4 结论
(1) PM2.5降尘能够破坏肺泡上皮-毛细血管屏障和肺泡上皮细胞,刺激机体产生过量的自由基,打破机体氧化和抗氧化平衡体系,造成大鼠急性肺损伤。
(2) 复合维生素B能够减轻PM2.5暴露造成的急性肺损伤,对机体起到一定保护作用。
