黏土矿物界面吸附Fe(Ⅱ)耦合对邻硝基苯酚还原转化的增强机理研究
2019-11-28梁剑滔卢鹏澄寇卓瑶吴宏海
梁剑滔,卢鹏澄,寇卓瑶,赵 丹,吴宏海
(华南师范大学 环境学院, 广东 广州 510006)
铁是地壳中丰度最高的过渡金属元素,在厌氧环境下容易由Fe(Ⅲ)还原成Fe(Ⅱ),游离态Fe2+离子能与矿物表面活性基团结合并形成吸附态的Fe(Ⅱ)物种(Hofstetteretal., 2003),而吸附态Fe(Ⅱ)物种的还原电位得到有效降低,因而使该Fe(Ⅱ)物种的还原活性得到提高(Lietal., 2009)。吸附态Fe(Ⅱ)物种,能够有效还原转化一些环境污染物(Heijmanetal., 1995; Ruggeetal., 1998),从而实现环境净化(谢丽等, 2008; 李俊等, 2009)。研究表明,氧化性硝基芳香族化合物在自然界中的主要转化途径是在厌氧环境介质(如沉积物和含水层)中的还原反应,而其中起主要作用的是那些不同吸附形态的Fe(Ⅱ)物种(Roden and Urrutia, 1999; Lovleyetal., 2004)。蒙脱石和高岭石是典型的层状硅酸盐矿物,在自然界中大量存在,并且对重金属离子具有很高的吸附容量,显然它们对Fe2+也具有很强的吸附性能。然而,这两种黏土矿物对Fe(Ⅱ) 的界面吸附形态有所差异。那么,它们界面吸附态Fe(Ⅱ)物种的还原性能是否存在不同呢?因此,本文开展了高岭石、蒙脱石对Fe(Ⅱ) 的吸附对比研究,并着重探讨溶液pH值、Fe(Ⅱ)浓度以及反应温度等因素对邻硝基苯酚(2-NP)还原转化的影响。在此基础上,探讨不同吸附形式对上述还原转化的调控规律。
1 材料和方法
1.1 试剂
钠基蒙脱石(内蒙古)、高岭石(广东茂名)、4-磺酸丙基吗啉(MOPS,大于99.0%)、4-吗啉乙磺酸(MES,大于99.0%)、邻硝基苯酚(2-NP)(99.5%)购自上海阿拉丁试剂厂; 而NaOH、FeSO4·7 H2O、HCl、NaCl 和甲醇等其他试剂(色谱级) 购于天津市大茂化学试剂厂。所有试剂均为分析纯试剂;实验用水均为二次去离子水。
1.2 实验方法
1.2.1 溶液pH值对Fe(Ⅱ)吸附的影响
在规格20 mL的西林瓶中,通高纯氮气除氧并依次加入68.0 mg的黏土和17 mL 混合溶液(0.1或0.5 mmol/L的FeSO4还原剂,0.2 mol/L NaCl 和28 mmol/L MOPS或MES)。盖上橡胶塞,加铝盖密封,避光置于25℃的恒温摇床持续摇动(200 r/min),振荡24 h,后离心(4 000 r/min)5 min;然后,用邻菲罗啉比色法测定(510 nm)溶液中的Fe2+浓度;同时,以不含矿物样品的实验组做空白对照。本文实验主要考查了溶液pH值(4~8)对蒙脱石和高岭石两种矿物表面吸附Fe2+的影响。
1.2.2 邻硝基苯酚(2-NP)的转化
氮气保护的缺氧环境下,将调好pH值含缓冲溶液(MOPS或MES)28 mmol/L、NaCl 0.2 mol/L的250 mL溶液中加入到250 mL的玻璃反应器中,同时加入一定量的高岭石(或蒙脱石)和不同浓度的Fe2+离子,置于DF-101S集热式恒温加热磁力搅拌器(广州比朗仪器有限公司)中,温度恒定在25 ℃、转速400 r/min,搅拌2 h使黏土对Fe2+的吸附达到平衡。之后,加入一定量的邻硝基苯酚(2-NP)使其初始浓度为0.022 mmol/L,反应开始并间隔取样,过0.45 μm滤膜后测试分析。
1.2.3 分析方法
采用高效液相色谱仪(HPLC)测定溶液中的2-NP浓度,仪器为日本岛津Shimadzu LC-10AT,色谱柱为Syncronis-C18反相柱(250 mm×4.6 mm,5 μm)。流动相组成为70%的甲醇(色谱纯级)和30%的水,其中30%的水加盐酸酸化至pH = 2.8。流量为1 mL/min,柱温为25 ℃,进样量为20 μL,检测波长265 nm。
溶液中Fe2+的测定采用邻菲络啉比色法测定(510 nm),分析仪器为7502P CS型紫外可见分光光度计。
2 结果与讨论
2.1 Fe2+离子在黏土矿物上的吸附特征
当Fe2+初始浓度一定时,蒙脱石和高岭石对Fe2+的吸附量随pH值的升高而增大,该吸附过程在pH值5.0~7.0范围内增幅明显;蒙脱石主要通过离子交换以及端面羟基与Fe2+络合吸附Fe(Ⅱ),而高岭石则主要是通过端面羟基与Fe2+的络合吸附Fe(Ⅱ);随着pH值的升高,矿物表面去质子化增强,使得Fe2+与矿物表面形成的配合物增多(Lietal., 2009)。在相同条件下[如pH=6.0、Fe(Ⅱ)浓度为0.1 mmol/L时],蒙脱石对Fe2+的吸附量较之高岭石要大得多。这是因为,蒙脱石本身存在着较大的阳离子交换容量。因此,当pH值固定时,随着Fe2+的浓度的增大,尽管吸附去除率减小,但总的表面吸附量却是增加的(图1)。
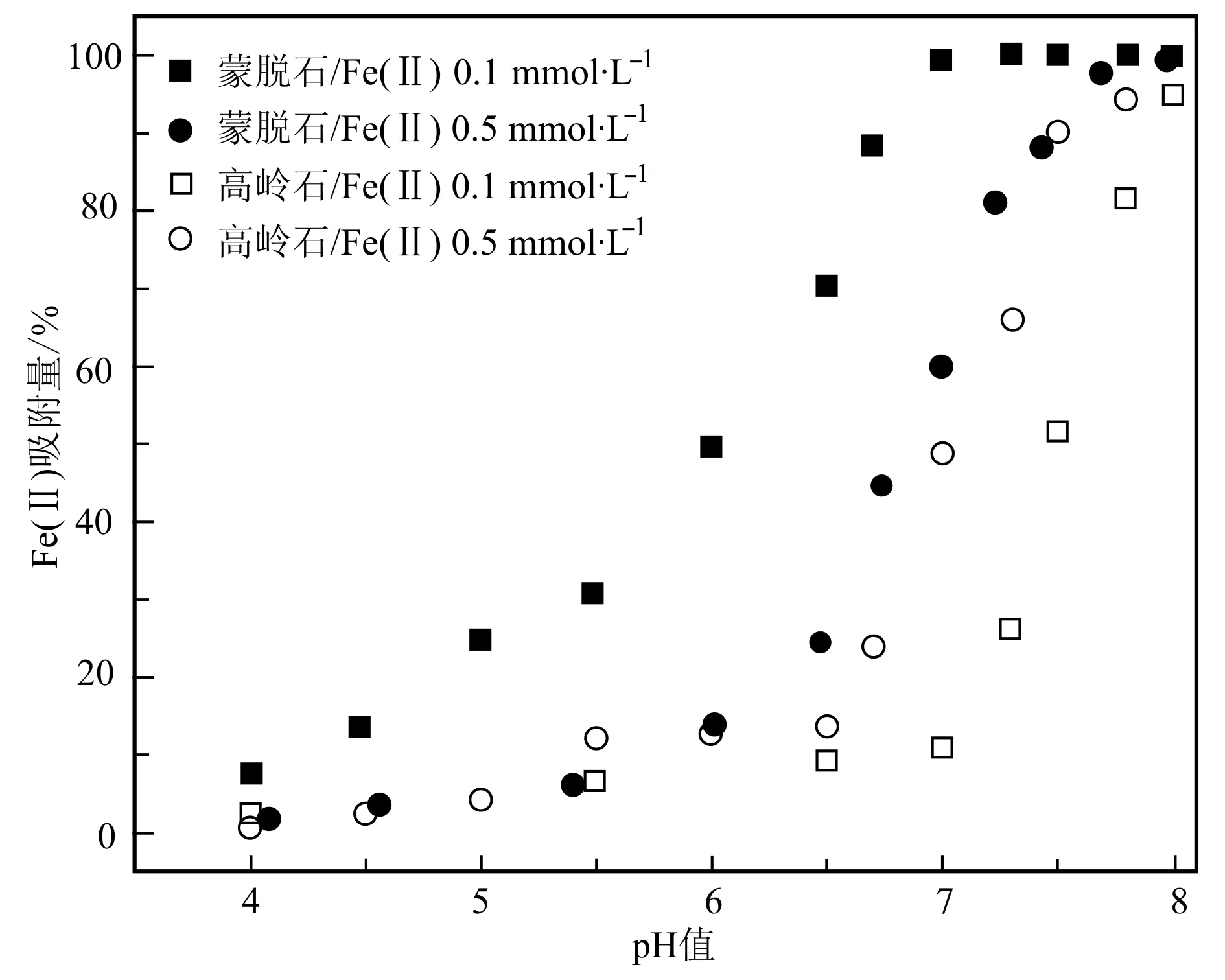
图 1 溶液pH值对高岭石和蒙脱石界面Fe(Ⅱ)吸附量的影响Fig. 1 Effect of pH on the adsorptions of Fe(Ⅱ) onto kaolinite and montmorillonite
2.2 5种不同反应体系中2-NP的转化或去除情况
图2的反应条件为Fe(Ⅱ)和2-NP的初始浓度分别为3.0 mmol/L、0.022 mmol/L,黏土的投加量为4.0 g/L,温度25 ℃和pH = 6.7。从图2[C0、Ct(mmol/L)分别表示初始和反应时间t(min)的2-NP浓度]可以看出,单独黏土存在时对2-NP去除主要仅为吸附,故去除率不高;单独高岭石几乎不发生吸附2-NP,蒙脱石对2-NP吸附弱,在4.0 h内的吸附率仅达20%。在单独Fe(Ⅱ)的均相反应体系中,2-NP的还原转化也较为缓慢,转化率为52.6%;添加高岭石时,2-NP能在4.0 h内完全转化,其还原转化速率显著增大;而添加蒙脱石时,4.0 h内2-NP的去除率为85.8%,稍小于Fe(Ⅱ)/高岭石体系的去除率,但却明显高于单独Fe(Ⅱ)或蒙脱石存在下对2-NP的转化率或去除率。说明在一定的pH值下,加入黏土能够提高2-NP还原转化的速率。由于在Fe(Ⅱ)/蒙脱石体系中有部分Fe(Ⅱ)以离子交换的形式进入蒙脱石,从而减少蒙脱石端面结合态Fe(Ⅱ)的吸附量,从而导致其对2-NP还原转化率稍小于Fe(Ⅱ)/高岭石体系的转化率,即使单独蒙脱石对2-NP有弱吸附。这些与前人的研究报道相吻合(孙克文等, 2008)。

图 2 5种体系对2-NP的转化或去除情况Fig. 2 The comparison of the transformations or removals of 2-NP by the five reaction systems
2.3 不同形态Fe(Ⅱ)还原转化2-NP的动力学分析
由于黏土矿物对2-NP的吸附是物理吸附,而且2-NP的吸附不强但快速,还原转化为限速因素,那么参照文献(Wuetal., 2018)采用伪一级动力学方程拟合2-NP的还原转化过程,用式(1)表示:
ln (Ct/C0) =-kt(1)
式中,C0、Ct(mmol/L)分别表示初始和反应时间t(min)的2-NP浓度,k(min-1)为准一级反应速率常数。图3为单独 Fe(Ⅱ)及其与两种黏土的复合系统对2-NP的还原转化动力学曲线,其反应条件同图2。可以看出,两种矿物体系对2-NP的还原转化均很好的遵循伪一级反应动力学方程(R2>0.99),其中游离的Fe(Ⅱ)对2-NP的转化效率最低,其反应速率常数为0.002 8; Fe(Ⅱ)/高岭石体系比Fe(Ⅱ)/蒙脱石体系对2-NP的转化效果还要好些,它们的还原速率常数分别为0.016 6和0.006 5,两者相差近3倍。
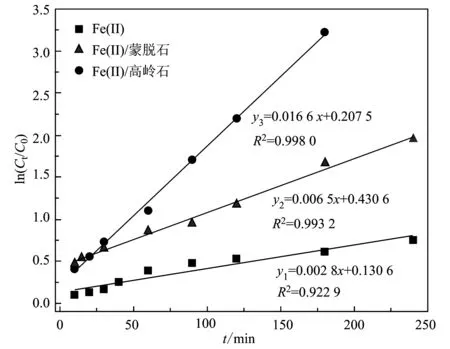
图 3 3种不同体系中2-NP还原转化的假一级动力学方程的拟合参数Fig. 3 Kinetics equation fitting parameters of the 2-NP reductive transformation in the three varying systems
2.4 溶液pH值对2-NP还原转化的影响
图4表示在2-NP初始浓度0.022 mmol/L、黏土投加量4.0 g/L、FeSO4浓度3.0 mmol/L和温度25℃的条件下,溶液 pH 值的改变(6.0、6.7、7.0和7.3)对2-NP还原转化的影响。结果表明,pH值对2-NP的还原转化影响显著。当pH值为6.0时,反应进行得很慢,Fe(Ⅱ)/高岭石体系对2-NP的去除率只有19.5%,而Fe(Ⅱ)/蒙脱石体系对2-NP的去除率为35.6%,可能其中有一大部分是蒙脱石对2-NP的吸附去除。当pH值升高到6.7时,两种黏土体系对2-NP的转化率显著增大,如在Fe(Ⅱ)/高岭石体系中,2-NP能在4 h内反应完全,去除率可达100%。究其原因,随着pH值的升高,矿物表面去质子化增强,从而使得Fe2+离子与矿物形成的表面配合物会相应地逐渐增加。当pH值由6.0升至7.3时,蒙脱石对Fe(Ⅱ)的催化还原能力明显增强。此外,2-NP还原转化一级速率常数的lnk值与pH值之间有显著的线性相关性(R2分别为0.99和0.98),并随着pH值的升高,2-NP还原转化k值也不断增大(图4c)。因为pH值升高,以离子交换形式被蒙脱石吸附的Fe(Ⅱ)减弱,Fe(Ⅱ)水解或在端面配位上吸附增强,甚至可能会在蒙脱石上发生表面沉淀铁氢氧化物(Erbsetal., 1999; Lee and Batchlor, 2002)。这些现象说明,Fe(Ⅱ)/高岭石或蒙脱石的两种体系中,2-NP的还原转化对pH值非常敏感。由于通常蒙脱石存在的环境介质偏碱性,那么蒙脱石表面对Fe(Ⅱ)还原性能的促进不可忽视,其界面所发生反应具有重要的环境意义。

图 4 初始pH值对2-NP还原转化的影响(a,b)及其与lnk的关系(c)Fig. 4 Effect of initial pH on the 2-NP transformation (a, b) and the relationship between the lnk and the pH (c)
2.5 亚铁离子浓度对2-NP还原转化的影响
图5表示2-NP的初始浓度为0.022 mmol/L、黏土投加量4.0 g/L、pH=6.7在温度25℃时,FeSO4初始浓度变化(2.0、3.0、5.0和10.0 mmol/L)对2-NP还原转化的影响。从图5可以看出,2-NP还原转化速率随初始Fe(Ⅱ)浓度的升高而增大。在初始Fe(Ⅱ)浓度为2 mmol/L时,反应进行较慢;当初始Fe2+浓度升高至10.0 mmol/L时,2-NP在2 h内反应完全。这是因为:Fe(Ⅱ)的初始浓度增大,Fe(Ⅱ)吸附量增大,可促进表面结合态Fe(Ⅱ)的形成,从而提高Fe(Ⅱ)的还原能力,并显著加快对2-NP的还原转化。可见,较高的Fe(Ⅱ)初始浓度增强蒙脱石的催化性能,此现象与蒙脱石表面结合态Fe(Ⅱ)的吸附量增加幅度随之增大有关。

图 5 Fe(Ⅱ)初始浓度对2-NP还原转化效果的影响Fig. 5 Effect of initial Fe(Ⅱ) concentration on the reductive transformation of 2-NP
2.6 温度对2-NP还原转化的影响
图6为2-NP初始浓度为0.022 mmol/L、FeSO4初始浓度为3.0 mmol/L、黏土投加量4.0 g/L、pH = 6.7在25℃时,温度对2-NP还原转化的影响情况。由图6可以看出,温度对2-NP的还原转化率影响很大,其还原转化速率随温度升高而明显增大。例如在Fe(Ⅱ)/高岭石体系中,从25 ℃升高至40 ℃时,2-NP可被完全转化的时间从240 min缩短至60 min。此外通过阿累尼乌斯(Arrhenius)方程(式2)可以计算出此条件下高岭石和蒙脱石矿物界面2-NP还原转化的反应活化能,分别为68.90和78.46 kJ/mol。
lnkobs=-Ea/RT+lnA(2)
式中,kobs表示反应热力学常数,Ea表示反应活化能(kJ/mol);R、T分别为理想气体方程常数(8.314 J/mol·K)和绝对温度(K);A为常数项。

图 6 温度对2-NP还原转化效果的影响 Fig. 6 Effect of temperature on the reductive transformation of 2-NP
3 黏土矿物吸附Fe(Ⅱ)对2-NP还原转化增强机理探讨
黏土矿物界面吸附,通常表现为离子交换形式,只是在端面上可能出现表面配位吸附(吴宏海等, 2003)。不同于铁氧化物矿物表面单一的Fe(Ⅱ)配位吸附形式[如α-FeOOH对Fe(Ⅱ)的吸附(Taoetal., 2010)],黏土矿物表面出现多种吸附模式。然而,只有发生配位吸附的Fe(Ⅱ)或者结构Fe(Ⅱ)物种,其还原活性才较之游离态Fe(Ⅱ)强(Wuetal., 2018)。Fe(OH)2和 Fe(OH)3的溶度积常数(Ksp)分别是1.0×10-15、3.2×10-38。当溶液的pH<7.5,Fe(Ⅱ)浓度为3.0 mmol/L时没有Fe(OH)2沉淀产生,而Fe(Ⅱ)浓度为10.0 mmol/L时就刚好有Fe(OH)2产生。Fe(Ⅱ)氧化后大都会以Fe(OH)3沉淀出现。显然,当pH 值范围在6.0 至7.3、Fe(Ⅱ)浓度为3.0 mmol/L时,Fe(Ⅱ)则以吸附存在为主导。Fe(Ⅱ)吸附形态又控制Fe(Ⅱ)的还原性能强弱。
本文通过改变溶液pH值或Fe(Ⅱ)浓度来调控Fe(Ⅱ)在两种黏土矿物上的吸附形态。高岭石表面零电荷点(pHpzc)= 5.2(高嵩等, 2005),而蒙脱石的pHpzc=2.0,当pH 值范围在6.0 至7.3时高岭石则会带点一定量的负电荷,而蒙脱石荷明显的负电荷(Wuetal., 2016)。所以,在pH = 6.7,当Fe2+离子低浓度,如小于2.0 mmol/L时,Fe2+大都为离子交换吸附,两种矿物吸附的Fe2+与单独Fe2+离子表现的2-NP还原转化率差不多。究其原因,是离子交换态Fe2+的还原性能并没有得到增强所致。当Fe2+的初始浓度升高至3.0 mmol/L时,高岭石表面配位吸附的Fe2+容量提高,从而导致高岭石系统的2-NP转化率高于蒙脱石系统,但此时蒙脱石吸附Fe2+仍以离子交换吸附为主导。当Fe2+离子浓度升高至 5.0 mmol/L时,两系统的2-NP转化率就开始出现反转,即蒙脱石高于高岭石。此现象表明,蒙脱石表面配位吸附的Fe2+增加并开始超过高岭石。一般地下水中Fe(Ⅱ)的浓度在3.0 mmol/L以下,那么环境介质的pH值需要7.0以上,黏土矿物吸附诱导作用才能发生显著效应。在我国北方土壤酸碱条件可以满足上述强化还原的要求。而在我国南方土壤,则需要适当升高介质的Fe(Ⅱ)浓度,例如可以通过微生物还原提高Fe(Ⅱ)离子在水溶液中的含量。实际上,联合微生物可以实现持续净化2-NP等氧化性污染物的目标。邻硝基苯酚的最终还原产物为邻氨基苯酚(简称为2-AP),其具体的还原转化方程,见式(3)至(6)。由于通常带—NH2的化合物最易被吸附,那么转化产物2-AP容易被黏土矿物所吸附固定。
本文所采用蒙脱石的阳交换容量为654 cmol/kg(Weietal., 2017),那么可以估算出添加的1.0 g蒙脱石大致能交换3.27 mmol的Fe(Ⅱ)。当Fe2+浓度为3.0 mmol/L时,添加250 mL溶液中只相当于含有0.75 mmol的Fe(Ⅱ)。可见,大部分Fe(Ⅱ)以离子交换被蒙脱石所吸附。此估算值与图2结果相吻合,尽管蒙脱石端面会竞争吸附,但对Fe(Ⅱ)的吸附量低,结果是Fe2+/蒙脱石体系的2-NP还原速率常数k仅比游离态Fe(Ⅱ)的稍高一点;若是Fe2+浓度为2.0 mmol/L时,2-NP还原转化效率还会继续降低(图5)。离子交换态Fe(Ⅱ)因保留着水合水分子而其还原性能未能得到增强;Fe(Ⅱ)通过配位吸附或发生水解,其还原性能才会增强。
Fe(Ⅱ)2++≡SOH0(矿物表面) →≡SOFe(Ⅱ)++H+(3)
Fe(Ⅱ)OH++≡SOH0→≡SOFe(Ⅱ)OH0+H+(4)
≡SOFe(Ⅱ)++2-NP→≡SOFe(Ⅲ)2++2-AP
(5)
≡SOFe(Ⅱ)OH0+2-NP→≡SOFe(Ⅲ)OH++2-AP
(6)
4 结论与展望
在氮气保护的缺氧环境中,耦合Fe(Ⅱ)吸附的黏土微界面结合系统可以有效还原转化2-NP。该转化效率随着系统pH值、Fe(Ⅱ)初始浓度以及温度的升高而增大。蒙脱石和高岭石两种黏土与Fe(Ⅱ)所构筑的矿物界面结合系统对2-NP还原转化反应遵循伪一级反应动力学方程。尽管蒙脱石对Fe2+的吸附量明显高于高岭石,但因较大的阳离子吸附容量而不能更有效地提高蒙脱石对Fe(Ⅱ)的还原催化性能。这些归因于大部分Fe(Ⅱ)以离子交换的形式进入层间域而减少了蒙脱石端面上所形成的表面结合态Fe(Ⅱ)的吸附容量。总之,Fe(Ⅱ)在矿物表面的吸附形态与吸附量,是制约上述2-NP还原转化的关键影响因素。可见,通过对pH值、Fe(Ⅱ)初始浓度的调节,就可以实现黏土矿物界面催化性能的提高。
