河北围场天然沸石的矿物学特征及吸附性研究
2019-11-28李文杰冷少争郭慧东张晓静叶泽鹏
王 程,李文杰,冷少争,郭慧东,卢 佼,张晓静,赵 越,叶泽鹏
(陕西科技大学 材料科学与工程学院 陕西省无机材料绿色制备与功能化重点实验室, 陕西 西安 710021)
沸石是一种多孔的铝硅酸盐矿物,其结构由硅氧四面体和铝氧四面体通过共用氧相互连接而成。带负电的沸石骨架周围存在一些金属阳离子如Na+、K+、Ca2+等,从而使得沸石总体上呈电中性(Cakicioglu-Ozkan and Ozkan, 2005)。截至目前,自然界已发现40余种天然沸石,如斜发沸石、丝光沸石、辉沸石等,而人工合成的沸石已达几百种(Kuleyin, 2007)。天然沸石因其优异的吸附(Guayaetal., 2015; De Velasco-Maldonadoetal., 2018)、催化(Waluyoetal., 2017; Gelvesetal., 2019)、离子交换(Wibowoetal., 2017; Wanetal., 2019; Velazquez-Peaetal., 2019)等性能而备受关注,并已获得了广泛的应用。中国的天然沸石资源非常丰富,已发现近400处的沸石矿床(点),总储量约30亿吨,其中河北围场地区是沸石储量最丰富的地区之一(柳婷婷等, 2011)。然而,与浙江缙云等地的沸石(Wenetal., 2006; Huangetal., 2008; Lietal., 2012)相比,目前关于河北围场地区沸石的研究相对较少。本研究旨在对河北围场地区天然沸石的矿物学特征和吸附性进行研究,以期为该沸石资源的利用提供一定的参考。
1 实验部分
1.1 实验材料
天然沸石样品由北京国投盛世股份有限公司提供,来源于河北围场地区。苯和甲苯等均购自上海阿拉丁生化科技股份技术有限公司。
1.2 分析方法
采用德国Bruker公司AXS D8-Focus型X射线粉末衍射仪对样品的结构进行分析,测试条件: Cu Kα射线,工作电流40 mA,电压40 kV,步长0.01°2θ,曝光时间0.05 s/步。利用k值法分析样品的矿物组成。采用德国Bruker公司S4 Pioneer型X射线荧光光谱仪分析样品的化学组成。采用美国Micromeritics公司Gemini VII2390型气体吸附仪测试样品的N2吸附-脱附等温线,利用BET方程计算样品的比表面积,利用t-plot方法计算样品的微孔比表面积,利用DFT和BJH模型分别计算样品的微孔和介孔分布。采用日本Hitachi公司S-4800型扫描电镜分析样品的微观形貌特征,采用能谱仪分析样品的表面化学成分。采用德国Bruker公司Vector-22型红外光谱仪利用KBr压片法测试并分析样品的分子结构。
1.3 吸附性评价
1.3.1 苯和甲苯的吸附性评价
采用UV-vis评价天然沸石对苯和甲苯的吸附效果。苯溶液的浓度为20~800 mg/L,甲苯溶液的浓度为20~500 mg/L。吸附剂的用量均为0.4 g/L。沸石对污染物的吸附容量和吸附率采用如下公式计算:
qe=(C0-Ce) ×V/W(1)
R=(C0-Ce)/C0×100% (2)
式中,qe是吸附容量(mg/g),C0和Ce分别是污染物的初始浓度和吸附平衡浓度(mg/L),V是溶液的体积(L),W是沸石的用量(g),R为吸附率(%)。
采用假一级和假二级动力学模型研究吸附动力学特征。假一级模型方程如下式所述:
dqt/dt=k1(qe-qt) (3)
其中,k1是假一级速率常数(min-1)。对式(3)在qt=0、t=0和qt=qt、t=t的条件下进行积分,得到下式:
ln(qe-qt)=lnqe-k1t(4)
假二级模型方程如下式所示:
dqt/dt=k2(qe-qt)2(5)
其中,k2是假二级速率常数g/(mg·min)。对式(5)积分后得到下式:
采用Langmuir和Freundlich 吸附模型对吸附等温线进行拟合。Langmuir方程如下所示:
qe=qmonKLCe/(1+KLCe) (7)
其中,qmon是样品对污染物的最大吸附容量(mg/g),KL是Langmuir常数(L/mg)。qmon和KL可利用如下线性方程获得:
1/qe=1/qmon+1/(KLqmonCe) (8)
对于Langmuir吸附过程,可通过分离因子或平衡参数(RL)来判断吸附为“有利的”或是“不利的”。
RL=1/(1+KLC0) (9)
RL值表示等温线的形状是不可逆的(RL=0)、有利的(0
Freundlich方程如下所示:
其中,KF是吸附容量的指标[mg/g(mg·L-1)n],KF值越大吸附容量越大;1/n表示吸附的有利性,n>1表示吸附条件有利。Freundlich模型可以用线性形式表示如下:
lnqe=lnKF+1/nlnCe(11)
KF和1/n分别由截距和斜率确定。
1.3.2 水蒸气的吸附性评价
称取1.0g沸石粉体,置于恒温恒湿箱(BPS-50CL,上海一恒科学仪器有限公司)中,在70%湿度、30℃条件下吸附48 h,通过样品吸附水蒸气前后质量的变化评价其对水蒸气的吸附效果,用以考察其亲水性。
2 结果与讨论
2.1 天然沸石样品的矿物学特征
2.1.1 天然沸石样品的组成和结构
图1是天然沸石样品的XRD图谱。从图中可以看出,该天然沸石样品主要含有斜发沸石(PDF71-1425)和石英(PDF75-0443),且二者的含量分别为77.77%和22.22%。该天然沸石中所含沸石为单一的斜发沸石,这与浙江缙云天然沸石中含有多种沸石(斜发沸石、丝光沸石、片沸石等)(Wenetal., 2006)有所不同。

图 1 天然沸石样品的XRD图谱Fig. 1 XRD patterns of natural zeolite
采用XRF对天然沸石样品的成分进行了分析,结果表明,天然沸石样品中主要含有SiO2(76.35%±0.21%)、Al2O3(14.39%±0.18 %)、K2O(3.68%±0.09%)、CaO(2.58%±0.08%)、Fe2O3(1.02%±0.05%)、MgO(0.78%±0.04%)、Na2O(0.62%±0.03%)、TiO2(0.15%±0.01%)等。天然沸石的SiO2/Al2O3值为5.3,其中斜发沸石的SiO2/Al2O3值为3.76左右(扣除石英含量)。与浙江缙云天然沸石(SiO2/Al2O3=6.0)(Wenetal., 2006)相比,其硅铝比稍低。
图2是天然沸石样品的红外光谱图。图2显示,天然沸石样品在3 627和3 441 cm-1处存在明显的吸收峰,其中3 627 cm-1对应Si—(OH)—Al的伸缩振动峰,3 441 cm-1对应Si—OH的伸缩振动峰。1 638 cm-1对应沸石吸附水的完全振动峰,1 050 cm-1对应T—O(T为Si或Al)的伸缩振动峰,790、603和473 cm-1对应O—T—O (T为Si或Al)的振动峰(Korkunaetal., 2006)。红外光谱分析结果证实了天然沸石表面含有大量Si—(OH)—Al和Si—OH极性基团。

图 2 天然沸石的红外光谱Fig. 2 FTIR spectrum of natural zeolite
2.1.2 天然沸石样品的比表面积及孔结构
图3为天然沸石的N2吸附-脱附曲线和孔径分布图。从图3中可以看出,天然沸石在相对压强p/p0为0~0.02范围内对N2具有一定的吸附作用,表明沸石中含有微孔;在0.45~1范围内存在一个滞后环,表明沸石中含有介孔(Wangetal., 2018)。通过BET理论计算得到样品的比表面积为27.67 m2/g,通过t-plot方法计算样品的微孔比表面积和外比表面积分别为5.16 m2/g和22.52 m2/g。通过DFT和BJH模型分别计算了样品的孔径分布,发现天然沸石的微孔孔径集中于1.2 nm,介孔孔径集中于3.8 nm和15.3 nm。对比浙江缙云天然沸石(比表面积为6.64 m2/g)(Wenetal., 2006),发现围场天然沸石具有更高的比表面积。

图 3 天然沸石的N2吸附-脱附曲线(a)和孔径分布图(b)Fig. 3 N2 adsorption-desorption curves (a) and pore size distribution (b) of natural zeolite
2.1.3 天然沸石的微观形貌特征
图4是天然沸石的SEM照片和能谱分析结果。从图4中可以看出,天然沸石颗粒呈不规则状,颗粒的粒径分布较宽。点能谱显示样品表面主要含有O、Al、Si、K和Ca元素,表面SiO2/Al2O3(质量比)值为6.8左右(利用Si、Al元素摩尔比换算),稍高于XRF的测试结果,这可能是由于天然沸石成分不均一或仪器的误差等因素导致的。面能谱显示样品中这几种元素的分布非常均匀,这与天然沸石的组成相一致。结合XRF和EDS结果,认为该天然沸石属于中硅沸石。
2.2 天然沸石样品的吸附性
2.2.1 天然沸石样品对苯的吸附效果
(1) 吸附动力学
图5为不同吸附时间下沸石样品对苯(600 mg/L)的吸附结果。结果显示,天然沸石样品对苯吸附240 min后,基本达到吸附平衡,此时沸石对苯的吸附量和吸附率分别可达237.66 mg/g和79.22%,具有良好的吸附效果。吸附720 min后,沸石对苯的吸附量和吸附率分别为250.80 m2/g和84.27%。

图 4 天然沸石的SEM照片和能谱分析Fig. 4 SEM image and EDS analyses of natural zeolite

图 5 沸石在不同吸附时间对苯的吸附性能Fig. 5 Adsorption property of zeolite for benzene in different adsorption time spans
分别采用假一级和假二级动力学模型对上述结果进行拟合,拟合结果见图6。假一级动力学模型相关系数(r2)为0.913 7,qe值(86.68 mg/g)与实验数据(237.66 mg/g)不一致,表明天然沸石对苯的吸附不符合假一级动力学模型。而假二级动力学模型的相关系数(r2)为0.998 8, 且qe值(251.89 mg/g)与实验数据非常吻合,表明该吸附服从假二级动力学模型。该结果显示天然沸石对苯的吸附主要为化学吸附。

图 6 沸石吸附苯的假一级(a)和假二级动力学(b)拟合图Fig. 6 Plots of pseudo-first-order (a) and pseudo-second-order kinetic models (b) for adsorption of benzene onto zeolite
(2) 吸附等温线
图7为沸石样品对不同初始浓度(20~800 mg/L)苯的吸附等温线(吸附平衡后浓度为11.42~276.29 mg/L)。图7显示实验未达到吸附平衡状态,理论上这一问题可以通过提高苯溶液的浓度来解决,但受苯在水中的溶解度较低以及紫外可见光分光光度计的检测范围有限等因素的限制,实际中较难配置高浓度的苯溶液实现样品对苯的吸附达到平衡(Wangetal., 2018)。从图7可以看出,当苯的初始浓度为800 mg/L时,吸附平衡后浓度为276.29 mg/L,沸石对苯吸附量最大,可达1 309.29 mg/g。
分别采用Langmuir和Freundlich模型对上述结果进行拟合,结果如图8所示。对比两个模型的相关系数(r2),发现沸石对苯的吸附符合Freundlich吸附等温模型。此外,沸石对苯的吸附并不易于进行(n﹤1),这可能是由于天然沸石表面较为亲水,不利于疏水性苯的吸附。

图 7 天然沸石对苯的吸附等温线Fig. 7 Isotherm for adsorption of benzene onto zeolite

图 8 天然沸石吸附苯的Langmuir(a)和Freundlich(b)拟合图Fig. 8 Langmuir (a) and Freundlich (b) plots for adsorption of benzene onto zeolite
2.2.2 天然沸石样品对甲苯的吸附效果
(1) 吸附动力学
图9为不同吸附时间下沸石样品对甲苯溶液(500 mg/L)的吸附结果。从图9中可以看出,天然沸石样品对甲苯吸附300 min后,基本可达到吸附平衡,沸石对甲苯的吸附量和吸附率分别可达223.92 mg/g和89.57%。

图 9 沸石样品在不同吸附时间对甲苯的吸附性能Fig. 9 Adsorption property of zeolite for methylbenzene in different adsorption time spans
分别采用假一级和假二级动力学模型对上述结果进行拟合,结果(图10)显示,假二级动力学模型的相关性系数高达0.999 8,且qe值为227.79 mg/g,与实验值223.92 mg/g很接近,表明吸附服从假二级动力学模型。该结果显示天然沸石对甲苯的吸附主要为化学吸附。
(2) 吸附等温线
图11为沸石样品对不同初始浓度(20~500 mg/L)甲苯的吸附等温线(吸附平衡后浓度为7.49~59.21 mg/L)。结果表明,当甲苯初始浓度为500 mg/L时,吸附平衡后浓度为59.21 mg/L, 沸石对甲苯的吸附容量可达1 101.96 mg/g。
分别采用Langmuir和Freundlich模型对上述结果进行拟合,结果如图12所示。对比两个模型的相关系数(r2)发现沸石对甲苯的吸附符合Freundlich吸附等温模型。此外,沸石对甲苯的吸附并不易于进行(n﹤1),这可能是由于天然沸石表面较为亲水,不利于疏水性甲苯的吸附。
2.2.3 天然沸石对水蒸气的吸附效果
在70%湿度、30℃、吸附48 h条件下,天然沸石对水蒸气的吸附量为25.89 mg/g,单位面积水蒸气吸附量可达0.935 8 mg/m2(吸附量/样品比表面积)。为了进行对比,又选用3M硝酸处理后沸石(硅铝比为7.7左右)进行水蒸气吸附实验,发现该样品的单位面积水蒸气吸附量仅为0.272 7 mg/m2。说明该天然沸石具有相对较高的亲水性。

图 10 天然沸石吸附甲苯的假一级(a)和假二级动力学(b)拟合图Fig. 10 Plots of pseudo-first-order (a) and pseudo-second-order kinetic models (b) for adsorption of methylbenzene onto natural zeolite

图 11 天然沸石对甲苯的吸附等温线Fig. 11 Isotherm for adsorption of methylbenzene onto natural zeolite
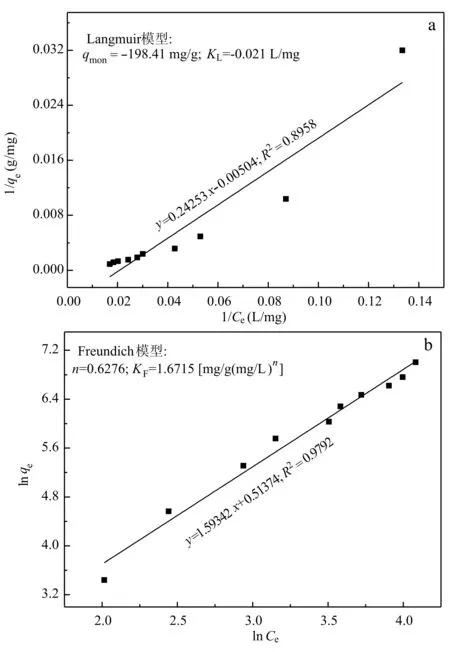
图 12 天然沸石吸附甲苯的Langmuir(a)和Freundlich(b)拟合图Fig. 12 Langmuir (a) and Freundlich (b) plots for adsorption of methylbenzene onto natural zeolite
2.3 天然沸石对苯、甲苯和水蒸气的吸附机理
作为一种多孔铝硅酸盐矿物,天然沸石带负电的骨架氧与孔道中的金属阳离子如Na+、K+、Ca2+等之间形成的强大电场使得沸石产生较高的极性,沸石的极性和亲水性随着硅铝比的降低而增加(Wangetal., 2019);此外,天然沸石表面的Si—(OH)—Al、SiOH等极性基团也会增加其极性。
对于本研究中的天然沸石,其硅铝比较低,约为3.76,且表面富含Si—(OH)—Al、SiOH等极性基团,因此,其具有较高的水蒸气吸附效果,表现出较高的亲水性。
苯和甲苯是芳香族化合物,苯环与沸石中的阳离子如Na+、K+和Ca2+之间存在较强的相互作用(Zengetal., 2007),因此苯和甲苯可通过苯环与沸石中阳离子的相互作用而发生结合。此外,天然沸石丰富的孔道结构也有助于苯和甲苯的吸附。
对于本研究中的天然沸石,其结构中含有较高的K+、Ca2+和Na+含量(K2O+CaO+NaO=6.88%),且其具有较高的比表面积(27.67 m2/g)和丰富的孔结构(在1.2、3.8和15.3 nm处均含孔),因此,其对苯和甲苯表现出良好的吸附效果。
然而,基于Freundlich模型拟合分析,该天然沸石对苯和甲苯的吸附并不易于进行,推测可能是由于天然沸石较为亲水、不利于疏水性苯和甲苯的吸附所致。因此,下一步需对该天然沸石进行表面疏水化改性,以期进一步提高其对疏水性污染物的吸附性。
3 结论
通过对河北围场地区天然沸石的矿物学特征和吸附性进行研究,发现:
(1) 天然沸石中含有77.77%的斜发沸石和22.22%的石英,天然沸石的SiO2/Al2O3值为5.3,其中斜发沸石的SiO2/Al2O3值为3.76左右。
(2) 天然沸石比表面积为27.67 m2/g,其中微孔比表面积为5.16 m2/g;天然沸石的微孔孔径集中在1.2 nm,介孔孔径集中在3.8和15.3 nm。
(3) 天然沸石颗粒呈现不规则状,粒径分布较宽,表面SiO2/Al2O3值为6.78。
(4) 天然沸石对苯和甲苯的最大吸附容量可达1 309.29 mg/g和1 101.96 mg/g,吸附平衡时间分别为240和300 min;吸附动力学和吸附等温线分别符合假二级动力学模型和Freundlich模型,天然沸石对苯和甲苯的吸附均主要为化学吸附。
(5) 天然沸石在70%湿度、30℃、吸附48 h条件下单位面积水蒸气吸附量可达0.935 8 mg/m2,表现出较高的亲水性。
