PER2 基因组织表达及多态性与绵羊季节性繁殖的相关性研究
2019-11-27向光明刘秋月王翔宇胡文萍曾宪垠曹晓涵储明星
向光明,刘秋月,王翔宇,狄 冉,胡文萍,马 琳,曾宪垠,曹晓涵*,储明星*
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.四川农业大学生命科学学院,四川雅安 625014)
绵羊发情主要分为常年发情与季节性发情两大类型,常年发情是指动物一年四季均可发情,不受长、短日照季节的影响,季节性发情是指动物发情受长、短日照季节的影响较大,一般在秋季发情,而其他季节都不发情。我国绵羊大部分属于季节性发情,这限制了我国肉羊产业的发展[1]。目前已经发现很多影响绵羊季节性发情的基因,如褪黑激素受体1A(MTNR1A)[2]、二型脱碘酶(DIO2)[3]、亲吻素-1(KiSS1)、G 蛋白偶联受体54(GPR54)[4]、芳基烷基胺-N-乙酰转移酶(AA-NAT)[5]、小眼畸形相关转录因子(MITF)[6]等。除此之外,研究者还发现钟基因可能与季节性发情调控有关,例如在牛的卵巢颗粒细胞中,钟基因的表达能影响促黄体素受体(LHR)和孕酮的产生,从而影响雌性动物的发情[7];在哺乳动物垂体中存在年节律钟,控制着下丘脑和垂体形态的周期性转变以及EYA3和CHGA基因的表达,从而影响哺乳动物的季节性繁殖[8];还有研究直接表明钟基因的突变会打断发情周期,降低繁殖力等[9]。近来还有研究进一步发现钟基因PER2的表达受繁殖激素影响,如Karman 等[10]在大鼠卵巢中发现促黄体激素(LH)能调控钟基因PER2的表达;Hickok 等[11]证明了下丘脑促性腺激素释放激素(GnRH)神经元中存在生物钟,且GnRH 对PER2基因的周期性表达有影响;Nakamura 等[12]研究发现雌激素也能影响PER1、PER2的周期性表达。哺乳动物成功繁殖是由一系列依靠激素的行为及生理活动组成,这些过程又受生物钟调控[13],PER2是生物钟震荡的核心分子[14],它很可能与繁殖调控有关,但它究竟是怎样影响绵羊繁殖目前还不清楚。
本研究主要检测了不同发情性状的2 种绵羊繁殖相关组织中PER2基因表达特征,并对不同绵羊群体重测序筛选出来的PER2基因g.2852655T>C 位点的多态性进行分析,探究PER2基因与绵羊季节性繁殖的关系,同时确认该位点对小尾寒羊产羔数是否产生影响,以期找到分子标记位点,为绵羊育种研究提供理论基础。
1 材料与方法
1.1 样品采集 苏尼特羊和小尾寒羊均来自天津市畜牧兽医研究所试验基地。选取健康的非发情状态的苏尼特羊母羊(长光照)和小尾寒羊母羊(黄体期)各3 只,在同期发情后第7 天对挑选的绵羊进行屠宰,然后分别采集10 种组织(下丘脑、垂体、松果体、大脑、小脑、卵巢、子宫体、输卵管、肾和肾上腺),迅速装入2 mL的RNase-free 冻存管中,进行冷冻保存备用。大群分型血液DNA 样品选择:共768 只羊,季节性发情绵羊包括苏尼特羊21 只、草原型藏羊161 只和滩羊22 只;常年发情绵羊包括湖羊101 只、策勒黑羊52 只和小尾寒羊411 只(其中380 只有产羔数记录)。每个DNA 样品需要量为20 μL,浓度为40~80 ng/μL。
1.2 引物设计 参照GenBank 提供的绵羊PER2基因mRNA 序列(XM_015091817),利用Primer3 软件进行跨外显子引物设计,以β-actin基因(NM_001009784)作内参。引物由北京天一辉远生物科技有限公司合成,引物具体信息见表1。
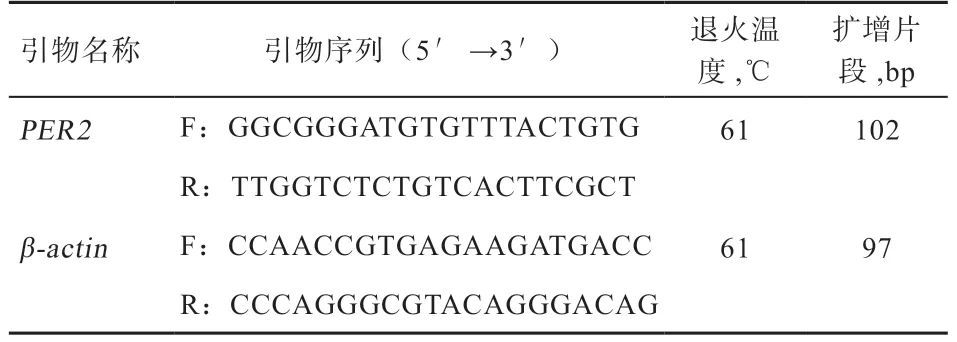
表1 绵羊PER2 基因的引物信息
1.3 RNA 提取和cDNA 第1 链合成 动物组织总RNA提取方法参照本实验室前期RNA 的提取和cDNA 第1 链合成方法[6]。20 μL 反转录体系:PrimeScript RT Enzyme Mix Ⅱ1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,5X Prime Script Buffer(for Real Time)4.0 μL,RNA 1.0 μL,RNase-free ddH2O 12.0 μL。反转录反应程序:37℃ 15 min;85℃ 5 s。20 μL 半定量PCR(sqRT-PCR)反应体系:2×Taq PCR Master Mix 10.0 μL,上、下游引物各0.5 μL,cDNA 模板 1.0 μL,ddH2O 8.0 μL。sqRT-PCR 反应程序:95℃预变性5 min;95℃变性 30 s;61℃退火30 s ;72℃延伸30 s;28 个循环;72℃延伸5 min;4℃保存。20 μL qPCR 体系:SYBR Premix Ex TaqTM Ⅱ 10.0 μL,上、下游引物各0.8 μL,cDNA 模板 2.0 μL,ddH2O 6.4 μL。qPCR 反应程序:94℃预变性5 s;94℃变性5 s,61℃ 30 s,40 个循环。
1.4 sqRT-PCR 和qPCR 反 应 将合成的cDNA 第1 链合成进行5 倍稀释,先进行sqRT-PCR 检测引物特异性将符合标准的cDNA 用于qPCR 反应,检测目的基因PER2的表达。sqRT-PCR 和qPCR 反应体系和反应程序见1.3,qPCR 反应具体步骤参照本实验前期方法[15]。
1.5 基因分型 本实验室前期对10 个绵羊品种的99个个体进行全基因组测序[16],筛选获得PER2基因的g.2852655T>C 位点,然后采用Sequennom Mass ARRAY®SNP 技术对PER2的该位点在不同发情性状的绵羊品种中进行分型。
1.6 统计分析 荧光定量结果采用2-ΔΔCt法计算目的基因相对表达量[15,17],用SPSS 22.0 统计软件中的一般线性模型中单因素方差分析的最小显著差异(LSD)法对不同繁殖性状之间相对表达量以及不同基因型在季节发情和常年发情之间的差异进行分析,同时将PER2基因的g.2852655T>C 位点的多态性与小尾寒羊产羔数做关联分析。用Excel2016 计算PER2基因的g.2852655T>C位点的基因型频率、等位基因频率、多态信息含量(PIC)、杂合度(He)及有效等位基因数(Ne),并进行Hardy-Weinberg 平衡检验。
2 结果与分析
2.1 总的RNA 提取和cDNA 合成 用1.0%的琼脂糖凝胶电泳对RNA 的完整性进行检测,如图1 所示,RNA完整性良好。同时以β-actin为内参,PER2为目的基因作标准曲线,得到单一且锐利的熔解曲线(图略),且扩增效率分别为100%和97.7%,说明引物特异性好,可以进行后续的荧光定量实验。
2.2PER2基因在不同发情性状绵羊之间的sqRT-PCR 检测 如图2 所示,在苏尼特羊中,PER2基因在小脑中表达量最高,垂体、卵巢和子宫中表达量次之;在小尾寒羊中,PER2基因在各个组织中的表达量均较低,在松果体、下丘脑和垂体中较高。
图1 RNA 琼脂糖凝胶电泳图
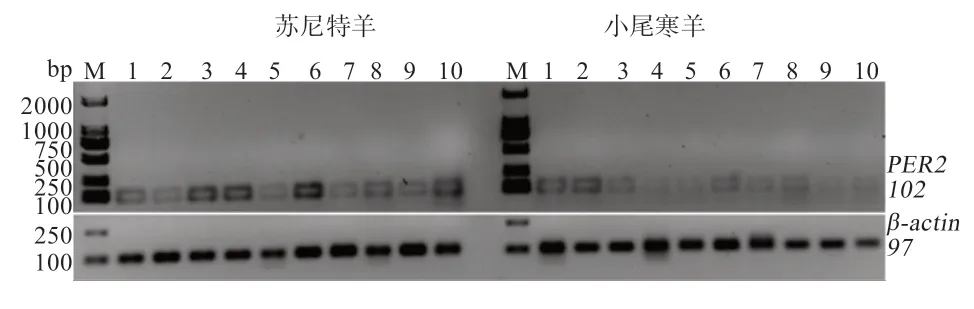
图2 PER2 和β-actin 在苏尼特羊和小尾寒羊10 种组织中的sqRT-PCR
2.3PER2基因在不同发情性状绵羊之间组织表达分析如图3 所示,PER2基因在苏尼特羊和小尾寒羊各繁殖相关组织中均有表达。品种间比较发现,PER2基因在苏尼特羊和小尾寒羊松果体、下丘脑的表达量并无显著差异,垂体中小尾寒羊PER2的表达量略高于苏尼特羊,也没有显著差异,在输卵管中小尾寒羊极显著高于苏尼特羊,但在卵巢中苏尼特羊显著高于小尾寒羊,子宫中的表达量差异达到极显著水平。
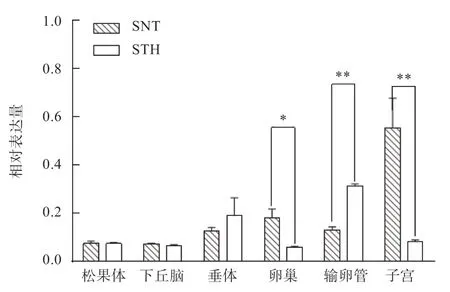
图3 PER2 基因在苏尼特羊和小尾寒羊各组织中的表达
2.4PER2基因的多态性分析 对本实验室前期通过10个绵羊品种的99 个个体进行全基因组重测序筛选的PER2基因的g.2852655T>C 位点进行分型发现,该位点在6 个绵羊品种中存在3 种基因型,分别为TT、TC和CC。
由表2 可以看出,PER2基因g.2852655T>C 位点在季节发情和常年发情绵羊中基因型频率和等位基因频率都具有极显著差异。该位点在2 个不同发情性状的绵羊品种中突变的等位基因C 均为优势等位基因,在季节性发情绵羊品种中TC 为优势基因型,在常年发情品种中CC 为优势基因型。
从表3 可知,PER2基因g.2852655T>C 位点在6个绵羊品种中均处于中度多态性(0.25<PIC<0.5);卡方检验表明,除了小尾寒羊外,该位点在其他5 个绵羊品种均处于哈代温伯格平衡状态(P≥0.05)。
2.5PER2基因g.2852655T>C 位点与小尾寒羊产羔数的关系 为探究PER2位点突变是否会影响绵羊产羔数,将PER2基因g.2852655T>C 位点分别与有产羔记录的380 只小尾寒羊的第1、2、3 胎产羔数进行关联分析。如表4 所示,g.2852655T>C 与小尾寒羊各胎产羔数并无显著关联。
3 讨 论
3.1PER2基因的表达分析 本研究通过sqRT-PCR 发现,PER2基因在2 种绵羊中各组织都有表达,这与PER2基因在生物体的各个组织中均有表达相一致[16,18]。此外,还发现PER2基因在苏尼特羊卵巢和子宫中的表达高于小尾寒羊,暗示PER2基因的表达可能与季节发情调控有关。
qPCR 结果表明,在松果体、下丘脑和垂体中2 种绵羊PER2的表达量均较低。一方面可能与本实验采样在07:00 左右有关,很多研究表明PER2在该时间的表达都很低[19-20]。另外可能是2 种羊都处于非发情期,光照刺激通过增强雌激素的负反馈作用而抑制促性腺轴的活性,导致GnRH/LH 周期性释放活动停止[21],LH 表达降低,使PER2的表达降低。也有研究表明在下丘脑和卵巢中发现LH 处理能提高PER2的表达水平[15,22],导致PER2基因的表达在2 种绵羊的松果体、下丘脑和垂体组织中并没有显著差异。
在卵巢中,苏尼特羊PER2基因的表达量显著高于小尾寒羊。有研究发现,在牛的颗粒细胞中较高水平的PER2表达会抑制促黄体激素受体(LHR)的表达及孕酮的产生[7],所以苏尼特羊PER2基因的高表达会使卵泡的发育和成熟受到抑制,从而处于非发情状态,这也证实了sqRT-PCR 的结果。小尾寒羊从卵泡期转换到黄体期需要孕酮的作用,需要解除PER2基因对孕酮的产生的抑制作用,PER2的表达量自然很低。在输卵管中,小尾寒羊PER2的表达高于苏尼特羊,可能是常年发情的小尾寒羊进入黄体期后,输卵管在卵子运输及为受精准备的过程中发挥重要作用[23]。Kennaway 等[23]发现的大鼠输卵管中PER2基因呈节律性表达也暗示了这一点。在子宫中,苏尼特羊PER2的表达显著高于小尾寒羊,可能与该时期子宫状态有关。子宫对着床的敏感度分为预受期、接受期及不应期3 个时期,而子宫只有在接受期才能接受和适应胚胎[24]。本实验的小尾寒羊刚进入黄体期,子宫可能处于不应期,PER2的表达较低。另外还有研究表明PER2使子宫内膜增殖与非周期性蜕膜基因表达的启动同步,可以为胎儿发育提供良好的环境,而沉默PER2的表达可能会导致流产[25],说明PER2的表达对胎儿发育也起着重要作用。在子宫中苏尼特羊PER2基因表达较高还有可能与子宫样品采集的位置有关。有研究表明,子宫中所有钟基因的表达具有高度区域特异性,而昼夜变化则相对较小[26]。
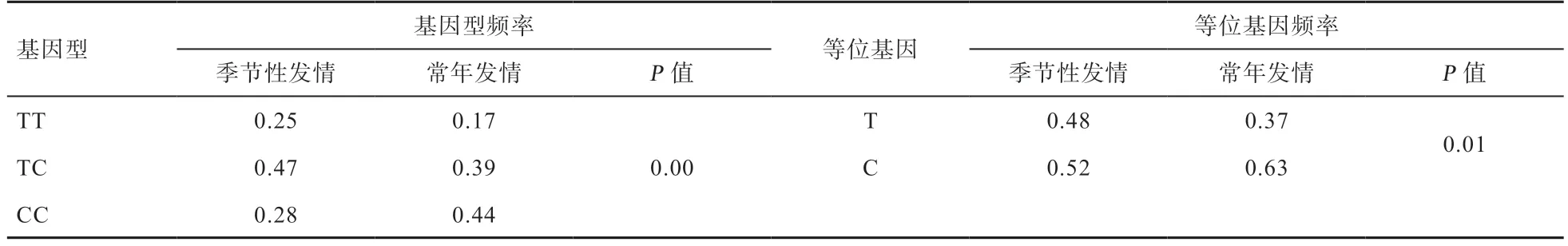
表2 PER2 基因g.2852655T>C 位点在季节性发情、常年发情绵羊品种中基因型频率和等位基因频率
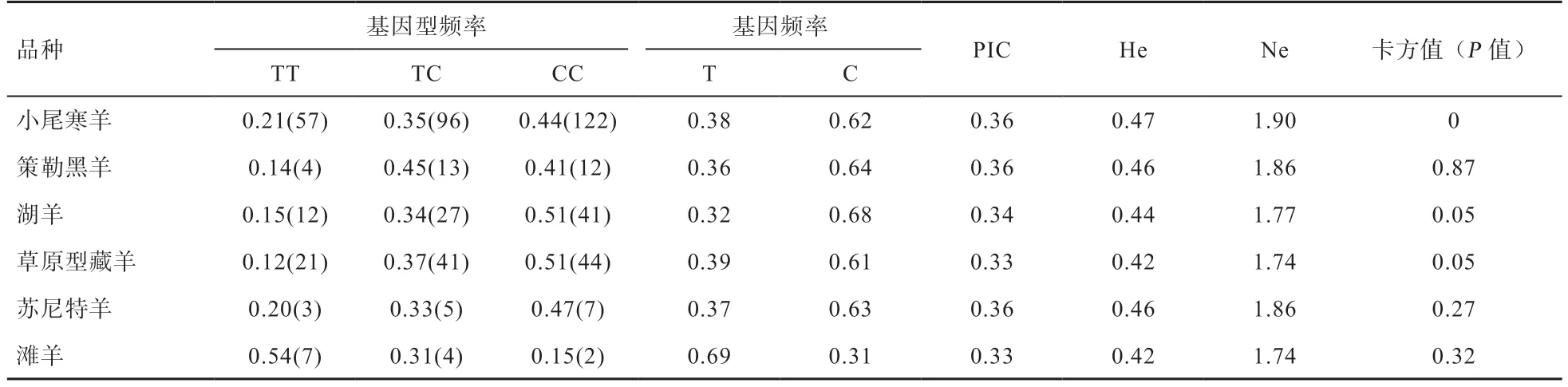
表3 PER2 基因g.2852655T>C 位点在6 个绵羊品种中的群体遗传学分析

表4 PER2 基因g.2852655T>C 位点不同基因型的小尾寒羊不同胎次产羔数(最小二乘均值±标准误)
3.2PER2基因多态位点与绵羊繁殖性状之间的相关性 通过大群分型和群体遗传学分析可知,PER2基因g.2852655T>C 位点在6 个绵羊品种中存在3 种基因型,且该位点在2 种发情性状绵羊品种中基因型频率和等位基因频率具有显著差异,说明该位点是一个绵羊季节性调控的候选位点。该位点在6 个绵羊品种中均处于中度多态性(0.25<PIC<0.5),说明该位点具有较强的选择潜力。关联分析结果显示,该位点与小尾寒羊第1、2、3 胎产羔数虽无显著关联,但相对来说,在小尾寒羊中第1、2 胎杂合突变的TC 基因型的平均产羔数较多,纯合突变次之,野生型较少,说明该位点突变在一定程度上提高了产羔数,对小尾寒羊群体来是一种有益突变。而Pilorz 等[27]研究发现,钟基因PER2突变的中年雌性小鼠,发情周期会发生紊乱,可能是加速了小鼠的老龄化,最终导致雌性繁殖力下降。这与本实验结果不一致,可能是本实验PER2基因只是单碱基位点突变,并没有影响PER2基因的正常功能,反而在一定程度上提高了产羔数。用钟基因突变模型来研究生物钟稳定对哺乳动物繁殖影响时所说的突变是整个或部分基因的敲除[28],导致钟基因不表达或者功能丧失,最后严重影响了哺乳动物繁殖的性能。
4 结 论
本研究发现,季节性发情的苏尼特羊PER2基因在卵巢中的表达量显著高于常年发情小尾寒羊,推测PER2基因在卵巢中较高水平表达抑制LHR 表达及孕酮分泌,进而调控绵羊的季节发情,且PER2可能与卵子受精、胚胎发育调控相关;另外,PER2基因g.2852655T>C 可能是绵羊季节性发情调控的关键位点,对分子育种具有重要参考意义。
