激活原代星形胶质细胞α7尼古丁胆碱能受体对PI3K/Akt/HSP70信号通路的影响
2019-11-27董智慧吕菊谢鹏任真奎官志忠禹文峰
董智慧 吕菊 谢鹏 任真奎,3 官志忠,4 禹文峰
(贵州医科大学 1分子生物学重点实验室,贵州 贵阳 550004;2地方病与少数民族疾病教育部重点实验室;3黔西南州人民医院检验科;4贵州医科大学病理学教研室)
在神经退行性疾病中,阿尔茨海默病(AD)是现在公共卫生最重视的问题之一。AD是一种由多种因素如性别、遗传基因、环境等影响的神经退行性疾病,主要特征在于β淀粉样蛋白(Aβ)和tau蛋白的异常加工,导致细胞外老年斑和细胞内神经原纤维缠结的形成,从而引发一系列细胞毒性作用,最终导致大脑神经元凋亡,甚至坏死,继而出现渐进性认知功能障碍〔1〕。热休克蛋白(HSP)70是HSPs家族中含量最多的成员,可以通过增强β淀粉样蛋白(Aβ)清除、抑制Aβ聚集、恢复和稳定tau蛋白的稳定性及抑制细胞凋亡和神经炎症等多种方式在AD中发挥细胞保护作用〔2,3〕。在星形胶质细胞中,过表达HSP70可减轻脂多糖(LPS)或α-突触核蛋白诱导的神经炎症〔4,5〕。α7尼古丁胆碱能受体(α7nAChR)广泛存在于大脑皮质和海马神经元、星形胶质细胞、小胶质细胞中,在AD中具有神经保护作用而成为AD的重要研究对象〔6〕。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路在细胞生长和生存中具有重要作用。在AD中,α7nAChR可通过PI3k/Akt信号通路参与AD的神经保护作用〔7〕。同时,有研究表明,PI3K/Akt也参与了HSP70 的调控〔8〕。但是对于α7nAChR是否参与了HSP70的调控目前还不清楚。本课题组前期研究表明在星形胶质细胞内,尼古丁可通过α7nAChRs调控内源性cryab蛋白的表达〔9〕。而HSP70与cryab都属于HSPs家族的成员,他们都具有清除蛋白异常聚集的功能。本研究拟探讨在星形胶质细胞内α7nAChR与HSP70蛋白表达的关系,为AD的预防提供新思路。
1 材料和方法
1.1实验动物 1~24 h内新生的Sprangue-Dawley(SD)大鼠,由贵州医科大学动物实验中心提供(动物许可证号:SCXK(黔)2012-0004)。
1.2主要仪器和试剂 胎牛血清,DMEM培养基,购于Gibco公司(美国);尼古丁及鼠抗HSP70单克隆抗体,购于Sigma公司;α7nAChR阻断剂methyllycaconitine(MLA),购于TOXICE公司;PI3K/Akt信号通路阻断剂LY294002,辣根过氧化物酶(HRP)标记的抗鼠的二抗和鼠抗β-肌动蛋白(actin )单克隆抗体,购于美国CST公司;超敏电化学发光法(ECL)发光试剂盒和聚乙烯二氟(PVDF)膜购于美国Millipore 公司;聚氰基丙烯酸正丁酯(BCA)蛋白定量试剂盒和蛋白Marker购于美国Thermo公司;抗体稀释液、封闭液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)快速凝胶配置试剂盒购于碧云天生物技术有限公司;荧光倒置显微镜出自Olympus公司;超高速离心机出自德国的eppendorf公司;二氧化碳培养箱购于日本SANYO公司。
1.3原代星形胶质细胞培养及鉴定方法 主要参照McCarthy等〔10〕和Schildge等〔11〕的方法并进行改良,分离新生SD乳鼠大脑皮质处的星形胶质细胞,剪成约1 cm3,0.25%胰酶消化并进行漂洗后,加入含1 %双抗(青霉素100 U/ml和链霉素100 U/ml)及含10 %FBS的高糖DMEM培养基,继续吹打制成细胞悬液后接种于25 cm2的培养瓶内,在5% CO2、37℃恒温的条件下培养24 h后换液。之后每隔2~3 d换液一次直到细胞铺满整个瓶底。纯化后将细胞传1~3代。将细胞接种于用多聚赖氨酸(PLL)包被好的12孔板内,采用胶质纤维酸性蛋白(GFAP)及神经核抗原(Neu)N进行细胞免疫荧光双染后鉴定星形胶质细胞的纯度。
1.4细胞分组及加药处理 当分离出星形胶质细胞后培养1 w,纯化并鉴定后,以一定密度接种于六孔板内,待细胞快长满孔底时,将细胞分组后加药处理。细胞分组情况:单独空白对照组、单独激动剂尼古丁组、单独阻断剂(MLA或LY294002)组、MLA+尼古丁组、PI3K信号通路阻断剂LY294002组及LY294002+尼古丁组。MLA+尼古丁组或LY294002+尼古丁组预先加MLA或LY294002处理星形胶质细胞2 h后,再加入尼古丁共同处理18 h。
1.5免疫印迹法检测蛋白表达水平 弃去细胞培养液,用预冷的磷酸盐缓冲液(PBS)将残留培养液清洗干净,加入适量细胞裂解液,收集细胞,冰上裂解2 h后12 000 r/min离心20 min,收集上清。通过BCA蛋白定量法检测提取的细胞蛋白浓度。最后,采用免疫印迹法检测目的蛋白HSP70和P-Akt蛋白表达水平,以内参(β-actin/GAPDH)蛋白为内对照。用ImageJ软件分析并计算HSP70和P-Akt蛋白条带与β-actin/GAPDH蛋白条带像素灰度的比值作为蛋白表达相对水平。实验重复3次,每次3复孔。
1.6统计学分析 使用GraphPad Prism5.0软件进行分析,组间两两比较采用配对t检验,多组比较采用单因素方差分析(one-way ANOVA)。
2 结 果
2.1星形胶质细胞的免疫荧光鉴定 荧光显微镜下观察,当星形胶质细胞占所有细胞的98%以上时,继续开展后续实验。见图1。

图1 原代培养星形胶质细胞 GFAP 免疫荧光染色(×200)
2.2尼古丁明显上调HSP70蛋白表达水平 与空白对照组〔(1.00±0.27)%〕比较,用浓度为5 μmol/L的尼古丁刺激星形胶质细胞不同时间段(6、12、18、24 h)后,HSP70蛋白表达水平不同程度升高〔分别为(1.89±0.25)%、(2.55±0.52)%、(4.16±0.67)%、(4.06±0.77)%,P<0.05〕,在18 h、24 h时间段升高最明显(P<0.01)。见图2。

图2 尼古丁上调 HSP70 蛋白表达
2.3尼古丁通过激活α7nAChRs上调HSP70蛋白表达水平 采用浓度为0.1 μmol/L的α7nAChRs 阻断剂MLA预处理星形胶质细胞2 h后,再加入浓度为5 μmol/L尼古丁共培养18 h后检测HSP70蛋白的表达水平。结果显示,对照组、MLA组、尼古丁组、MLA+尼古丁组HSP70蛋白水平分别为(1.00±0.17)%,(1.12±0.17)%,(2.08±0.18)%,(1.19±0.12)%;MLA+尼古丁组与尼古丁组比较,HSP70蛋白表达水平受到抑制(P<0.05)。证明尼古丁可以通过激活α7nAChRs 而上调HSP70蛋白水平。见图3。
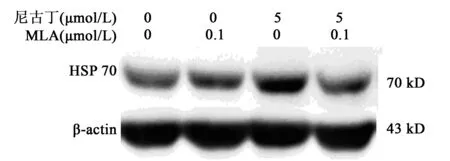
图3 尼古丁通过激活 α7nAChRs上调HSP70 蛋白表达
2.4PI3K/Akt信号通路参与尼古丁激活α7nAChRs上调星形胶质细胞内HSP70蛋白表达水平 用5 μmol/L 尼古丁分别作用于星形胶质细胞不同时间(5 min、10 min、20 min、30 min),结果显示P-Akt蛋白的上调效应出现时间依赖性,对照组,5、10、20、30 min组P-Akt蛋白水平依次为(1.00±0.28)%、(1.00±0.35)%、(1.47±0.27)%、(2.33±0.42)%、(2.21±0.33)%;在20 min后蛋白表达达到稳定阶段,因此选用该时间段进行后续实验(P<0.05),见图4。后续采用LY294002或MLA预处理星形胶质细胞2 h,再加入尼古丁共处理20 min后提取细胞总蛋白检测。结果显示,对照组、尼古丁组、尼古丁+LY294002组、MLA+尼古丁组的P-Akt蛋白水平分别为(1.00±0.15)%、(1.93±0.19)%、(1.35±0.27)%、(0.86±0.20)%,P-Akt蛋白的上调作用可被LY294002或MLA所抑制(P<0.05),见图5,图6。为进一步研究LY294002是否能抑制星形胶质细胞HSP70的上调,用10 μmol/L的LY294002预处理星形胶质细胞2 h,在加入尼古丁5 μmol/L 培养18 h后,对照组、LY294002组、尼古丁组、尼古丁+LY294002组HSP70蛋白表达水平分别为(1.00±0.17)%、(1.07±0.23)%、(1.77±0.14)%、(1.09±0.13)%;与尼古丁组比较,HSP70蛋白表达水平明显受到抑制(P<0.05),见图7。

图4 尼古丁显著上调 P-Akt(ser473)蛋白表达

图5 LY294002对P-Akt蛋白表达的影响

图6 MLA对P-Akt蛋白表达的影响

图7 LY294002对尼古丁上调HSP70蛋白表达水平的影响
3 讨 论
HSP是机体在受到外界刺激(如高温,重金属,有毒物质等)时细胞产生的一种高度保守的分子伴侣蛋白。HSP在蛋白质折叠过程中发挥重要作用,细胞可以将HSP转运至突触和轴突以阻断或阻碍错误折叠蛋白的过程〔12〕。AD的病理机制主要是Aβ的异常折叠、聚集和tau蛋白的过度磷酸化。许多研究表明,HSP不仅可以直接抑制β-淀粉样聚集,保护细胞免受Aβ毒性的影响,也可以促进错误聚集和折叠的蛋白质进行泛素化和降解。HSP70是在中枢神经系统中表达最丰富的一种HSP,HSP70家族由17个成员组成,在细胞的各区室广泛存在,包括细胞核、细胞质、线粒体和内质网。HSP70也具有保护蛋白质正确折叠的功能,并有助于损伤蛋白质的再折叠和再活化〔13〕。在神经退行性疾病中,HSP70与Aβ和路易小体有共存的现象。在AD脑组织中,也发现受影响区域中HSP70的高水平表达〔14〕。HSP70过表达在AD中具有神经保护作用。在AD动物模型APP/PS1转基因小鼠的大脑中,过表达HSP70改善了小鼠的认知功能障碍,减轻了AD相关表型〔15,16〕。HSP70可以与APP结合并干扰其分泌途径以减少Aβ的形成,通过蛋白酶体系统降解tau和Aβ寡聚体〔17〕,也可直接结合异常tau蛋白,并通过促进tau蛋白的降解和去磷酸化来降低其浓度〔14〕。外源性的HSP70对Aβ42的细胞外沉积诱导的毒性具有高度保护作用〔18〕。此外,在星形胶质细胞内,过表达HSP70可以抑制α-突触核蛋白或LPS诱导的神经炎症〔4,5〕。
α7nAChR是配体门控离子通道家族中的成员,在调节兴奋性神经递质释放、提高学习和记忆能力及增强认知功能中起重要作用〔6〕。在神经退行性疾病中,α7nAChRs表达显著降低〔19〕。在AD动物模型中,激动 α7nAChR会对大鼠的学习和记忆能力产生影响。而α7nAChR在 AD 及精神分裂患者的治疗中,也可明显改善患者的认知功能障碍〔20〕。此外,有研究表明,PI3K/Akt信号通路参与了神经保护作用,在AD的海马神经元中发现Akt表达明显减少,从而导致神经元细胞凋亡〔21〕。同时,α7nAChR参与了P13K/Akt信号通路的调控,激活α7nAChR可使PI3K/Akt信号通路中Akt被激活,活化的Akt可使GSK-3β第9位点处的丝氨酸磷酸化(Ser9)水平升高,从而抑制GSK-3β活化导致的tau蛋白病变〔19〕。PI3K/Akt信号通路参与了诱导HSP70的表达,这种调节可能依赖于Akt激活后抑制了GSK-3β的活性。GSK-3β的抑制可使HSP70表达上调,阻断PI3K/Akt通路会激活GSK-3β的活性,从而抑制HSP70的表达〔22,23〕。
在本实验研究中,用尼古丁处理原代星形胶质细胞能显著上调PI3K/Akt信号通路中P-Akt蛋白表达水平,而该上调作用可以被该通路的抑制剂LY294002 或α7nAChR的阻断剂MLA 所抑制。这说明尼古丁可以通过激活α7nAChR,使PI3K/Akt信号通路激活引起细胞内相应蛋白的表达变化。该研究结果与前期结果〔9〕相一致。另外,阻断PI3K/Akt信号通路可以抑制HSP70蛋白的表达。本文进一步研究也发现,在星形胶质细胞中,使用PI3K/Akt信号通路阻断剂LY294002能显著降低HSP70的表达水平,说明尼古丁很有可能通过激活α7nAChRs从而激活PI3K/Akt/HSP70信号通路来发挥对AD的保护作用,为进一步研究HSP70蛋白是否可作为AD的一个有效的治疗靶点奠定了一定的基础。
