土壤细菌群落组成对有机与无机培肥措施的响应
2019-11-20马晓英冶秀香杨金娟牛红霞
马晓英,马 琨 ,周 艳,冶秀香,杨金娟,牛红霞,马 玲
(1.宁夏科技发展战略和信息研究所,银川 750001;2.宁夏大学 西北土地退化与生态恢复国家重点实验室培育基地,银川 750021;3.宁夏大学 农学院,银川 750021)
化肥和有机肥是耕地土壤养分的主要来源,但长期应用无机肥而不输入有机肥是导致土壤有机质流失,土壤结构恶化,生物活性降低,土壤肥力下降的主要原因[1]。有机肥、无机肥的配合施用不但有助于植物营养供给,而且能通过土壤有机质的补充保持土壤肥力[2]。因此,有机肥与无机肥的配合施用是发展可持续肥料管理策略的一种有效途径。
土壤微生物在土壤有机质分解和碳、氮等养分循环中起着重要作用[3]。有研究认为,采用有机、无机肥配施的方法,可以调控长期连作棉田土壤微生物区系和组成结构比例[4];黄砂壤上有机、无机肥配施可以增加土壤细菌丰富度、多样性和均匀度指数,提高微生物功能多样性[5]。Zhong和Cai[6]报道,矿质肥料的施用增加了微生物的生物量和多样性。有机和无机肥料的施用也会影响土壤微生物的多样性、组成、丰富度和功能;其中,有机和无机肥料施用下,氮肥是驱动相对丰度较高的土壤细菌分类群变化的重要因素,有机物料引起细菌分类群的变化则主要体现在丰度较低的细菌群落上[7]。Wang等[8]研究发现,连续36a无机肥处理下,土壤细菌多样性呈下降趋势,而在有机肥处理下,细菌的多样性呈上升趋势。单独施用有机肥或与无机肥料配合施用都会增加土壤细菌多样性[9],但稻田中水稻秸秆的翻压施用却没影响细菌多样性[10]。在土壤有机碳和养分缺乏的状况下,有机肥的施用增强了土壤细菌和真菌群落,对土壤放线菌没有影响,而化学肥料的影响则与之相反[11]。因此,土壤细菌群落受不同施肥措施的影响可能会产生不同的响应。
宁夏中部干旱区,水资源相对紧缺,区域土壤有机碳含量偏低[12]。利用传统有机、无机结合的培肥方式,随外源有机物的类型及输入数量的高低变化,会对旱作区土壤细菌群落结构产生何种影响? 因此,本研究选择连续8a 有机、无机肥定位培肥试验农田土壤,利用Illumina MiSeq平台的高通量测序方法,假设连续中长期有机、无机相结合的培肥方式在促进土壤肥力提升的同时,会显著影响土壤细菌多样性、改变土壤细菌群落结构组成,土壤细菌的优势种群会因外源有机碳输入数量及类型而产生显著差异。研究旨在揭示农田培肥措施与土壤细菌群落间的相互关系,以期为旱作农业生产过程中施肥制度选择以及土地生产力的提升,提供理论支撑。
1 材料与方法
1.1 试验地概况
试验地位于宁夏吴忠市同心县王团镇旱作节水示范园区(105°59′E,36°51′N),该区域年均降雨量200 mm,年均蒸发量2 325 mm。供试土壤为灰钙土,试验前0~20 cm土壤基础理化性状为:全氮0.25 g·kg-1、全磷0.45 g·kg-1、有机碳2.77 g·kg-1、碱解氮11.06 mg· kg-1、速效磷10.86 mg·kg-1、速效钾97.08 mg·kg-1、pH 8.74。
1.2 试验设计
试验开始于2011年4月,采用单因素随机区组设计,小区面积为90 m2(15 m×6 m),3次重复,2011-2018年,采用马铃薯(Solanumtuberosum)-马铃薯-油用向日葵(HelianthusannuusLinn.)-马铃薯-油用向日葵-玉米(ZeamaysLinn.)-玉米-玉米轮作方式,滴灌量150 m3。设6个处理,分别为不施肥(T0)、单施化肥[(化学氮、磷、钾肥配施),T1]、化肥与牛粪配合施用(T2)、化肥与羊粪配合施用(T3)、化肥与生物有机肥配合施用(T4)和化肥与黄腐酸钾配合施用(T5)。
马铃薯、玉米的氮、磷、钾(化学)肥施用量分别为(N)391.35 kg·hm-2、(P2O5)195.6 kg·hm-2、(K2O)210 kg·hm-2;油用向日葵氮、磷、钾(化学)肥施用量分别为(N) 391.35 kg·hm-2、(P2O5) 195.6 kg·hm-2、(K2O )98 kg·hm-2。牛粪、羊粪基施量为37 500 kg·hm-2·a-1,折合有机碳用量分别为10 110 kg·hm-2·a-1、12 555 kg·hm-2·a-1;生物有机肥、黄腐酸钾施用量为1 200 kg·hm-2·a-1,折合有机碳用量分别为210 kg·hm-2·a-1、350 kg·hm-2·a-1。70%的化学氮肥及全部磷、钾肥和有机肥作基肥,剩余30%的氮肥作追肥,各施肥处理中化学肥料的氮、磷、钾总量相同。2018年作物收获时,采用多点取样法采集0~20 cm土层土壤样品,每小区采集2个土壤样本,各小区土壤样本独立,共采集36个土壤样本,放入冰盒带回实验室。一部分土样过1 mm筛,存放于 -80 ℃冰箱,用于土壤细菌多样分析,另一部分土样风干后用于土壤理化性质测定。
1.3 测定项目及方法
1.3.1 土壤基本理化性状测定 土壤全氮、有机质、碱解氮、全磷、速效磷、速效钾、pH测定分别采用半微量开氏法、重铬酸钾容量法、碱解扩散法、硫酸-高氯酸消煮 钼锑抗比色法、Olsen法、NH4OAc浸提 火焰光度法测定,pH水土质量比为5∶1[13]。
1.3.2 土壤微生物细菌总DNA的提取与检测 土壤细菌DNA的提取采用Fast DNA Spin Kit(MP Biomedicals,Santa Ana,CA,USA)试剂盒,按照说明书步骤进行。选择细菌16S rDNA V3-V4 区 (前引物序列ACTCCTACGGGAGGCAGCA,后引物序列GGACTACHVGGGTWTCTAAT,扩增片段大小为500 bp。
反应体系为:Q5反应缓冲液 (5×), Q5高保真GC缓冲液 (5× ), 0.25 μL,Q5高保真DNA聚合酶 (5 U/μL ),2 μL (2.5 mmol/L ) dNTPs、上下游引物 (10 μmol/L ) 各1.0 μL,2 μL DNA模板和8.75 μL ddH2O。扩增程序: 98 ℃ 预变性2 min,98 ℃ 变性15 s,55 ℃退火 30 s,72 ℃ 延长30 s,72 ℃终延伸5 min,10 ℃持续25~30个循环。对扩增子纯化后使用PicoGreen dsDNA Kit 分析试剂盒(Invitrogen,Carlsbad,CA,USA ) 进行定量,通过20 g/L琼脂糖凝胶电泳对扩增产物进行检测,再利用AXYGEN公司的凝胶回收试剂盒对目标片段进行切胶回收。
采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,质检合格后的文库利用Illumina MiSeq PE25测序平台进行双末端PE测序,委托天津诺和致远生物科技股份有限司完成。
1.4 数据处理与分析
使用QIIME (Quantitative Insights Into Microbial Ecology,v1.8.0 ) 和R (v3.2.0 ) 软件,调用USEARCH序列比对工具,对前述获得的序列按97%相似度水平的OTUs (Operational Taxonomic Units ) 代表序列进行生物学信息统计分析。利用Mothur软件在97%的相似度水平下进行OTUs聚类,统计获得OTU的个数,得到每个OUT所对应的物种分类学信息,统计观察样本数,计算样品的覆盖率指数。Mothur软件计算Simpson和Shannon多样性指数,Chao1和Ace丰富度指数,PD-whole tree等Alpha多样性指数。通过UniFrac分析,评估样本的Beta多样性,根据样本之间的加权(Weighted)的UniFrac距离矩阵进行NMDS分析,绘制样本聚类树。细菌群落样本组成之间的差异采用非度量多维尺度分析(Non-metric Multidimensional scaling,NMDS)和相似度分析检验(ANOSIM),通过基于999个排列的ANOSIM计算与NMDS相关的r值,NMDS和ANOSIM的计算均基于R 软件Vegan 程序包。采用Microsof Excel 2010软件进行数据处理,利用DPS 7.05软件进行单因素(LSD)方差分析比较差异显著性(P<0.05),采用 Canoco 5.0软件进行主成分分析。
2 结果与分析
2.1 有机与无机肥配施对土壤基本理化性状的 影响
连续有机、无机培肥8 a后,除土壤C/N外(F=1.06,P=0.377),土壤主要理化性状指标均极显著受到土壤培肥方式的影响(P>0.001)(表1);与T0相比,化肥配施较高量外源有机碳(T2、T3)下,土壤全氮分别增加64.00%和 56.00%;化肥配施较低量外源有机碳(T4、T5)下,土壤全氮均增加28.00%;但低量外源有机碳输入下,土壤全氮的增幅明显低于外源高量有机碳输入处理。土壤碱解氮质量分数也表现出与土壤全氮类似的变化趋势。可见,土壤全氮、碱解氮质量分数的高低,明显受到外源有机碳输入数量及类型的影响,有机、无机相结合的培肥措施整体上增强土壤氮的容量和强度,以化肥配施高量外源有机碳(肥)的效果最好。
不同培肥措施下土壤全磷与T0间均显著差异,但各培肥处理间无明显差别。与T0相比,土壤速效磷质量分数也表现出与全磷类似趋势。其中化肥配施高量外源有机碳处理下(T2、T3),土壤速效磷较T0分别增加1.24倍、1.14倍,但T2、T3之间无显著差异。外源低量有机碳输入下,化肥配施生物有机肥、黄腐酸钾肥料的处理与单施化肥处理间土壤速效磷也无显著差异。不同培肥措施下土壤pH较T0下降0.07~0.14;T2、T3处理较T0土壤pH也分别降低2.51%、 2.05%。较高量外源有机碳输入下,化肥配施牛粪(T2)、羊粪(T3)较化肥配施低量有机碳(T4、T5)土壤的pH仅分别下降0.61%~1.22%、 1.71%~2.32%。
土壤C/N是衡量土壤碳、氮营养平衡状况的指标[14]。与T0相比,试验中有机与无机相结合的培肥措施均降低了土壤C/N,其下降平均在 4.41%~15.10%。分析认为,试验中不同有机、无机培肥措施在促进土壤有机碳和全氮累积的同时,引起了土壤C/N的变动;由于土壤C/N的变化与土壤养分循环与周转直接相关,因此,土壤有机质、有机氮的分解矿化以及土壤无机氮素的有效性必然与土壤微生物群落结构变化间存在着紧密的联系。
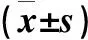
表1 有机肥与无机肥配施对土壤理化性状的影响Table 1 Effects of organic and inorganic fertilizer application on soil physicochemical properties
注:同列数据后不同字母表示处理间差异达显著差异(P<0.05)。下同。
Note:Different lowercase letters within a column indicated significant difference(P<0.05).The same below.
2.2 有机与无机肥配施对土壤细菌群落多样性及组成的影响
表2中土壤有机、无机培肥措施下各处理土壤样品细菌文库的覆盖率均超过0.97,说明土壤细菌的物种信息得到了较充分的体现,测序结果能反映土壤细菌群落的真实情况。土壤细菌群落丰富度指数(Chao1指数、Ace指数)、多样性指数(Shannon指数、Simpson指数)在各处理之间均无显著差异(P>0.05)。这说明与对照相比,连续8 a的土壤培肥措施总体上并未显著改变细菌群落的丰富度及多样性。
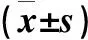
表2 有机肥与无机肥配施对细菌多样性及丰富度的影响Table 2 Effects of organic fertilizer and inorganic fertilizer application to soil bacterial communitiy diversity and richness index
试验中总计36个土壤样品共获得的细菌序列46 531条,3 494个细菌OTUs,分属于58门67纲143目271科639属435种。相对丰度较高的前10门中变形菌门 (Proteobacteria),放线菌门 (Actinobacteria)、酸杆菌门 (Acidobacteria)、拟杆菌门 (Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)的相对丰度均较高(图1)。除了未确定门的其他细菌类群外,其余5门中绿湾菌门(Chloroflexi)所占比例分别为3.22%~ 4.86%,厚壁菌门(Firmicutes)为0.69%~ 6.11%、梭杆菌门(Fusobacteria)为0.006 8%~1.068%、疣微菌门(Verrucomicrobia)为 1.26%~ 1.61%、奇古菌门为(Thaumarchaeota) 0.82%~1.79%,所占比例均较低。
变形菌门中,除T4与T0间的相对丰度无明显差异外, T1、T2、T3、T5处理与T0相比,相对丰度分别提高5.18%、19.83%、11.91%、 9.90%,所占比例达37.76%~ 43.03%,变形菌门为优势门(图1)。与对照(T0)相比,外源较高量有机碳与化肥配施处理(T2、T3)的变形菌门相对丰度平均增幅为11.91%~19.83 % ,明显高于低量外源有机碳和化肥配施以及单施化肥处理的增加幅度。酸杆菌门也表现出类似的趋势,但外源较低量有机碳配施化肥的情况下,酸杆菌门相对丰度却表现出较对照降低的趋势,平均下降为10.52%~14.41%。不同处理下基于门水平上拟杆菌门相对丰度较对照处理都呈上升的趋势;较低量外源有机碳和化肥配施处理中,其相对丰度为13.88%~15.40%,与较高量外源有机碳与化肥配施处理下的相对丰度相比,拟杆菌门的相对丰度反而高出了10.70%、24.14%。
土壤细菌基于门水平上的相对丰度方差分析结果表明(图1),门水平上,单施化肥处理下,相对丰度较高的前10个门中土壤放线菌门(P= 0.001)、酸杆菌门(P=0.002)、芽孢杆菌门(P=0.013)、绿湾菌门(P=0.001)与对照间有极显著性差异。牛粪配施化肥处理的土壤变形菌门 (P=0.008 66)、放线菌门(P=0.002 7) 、绿湾菌门(P=0.000 13)与对照间有极显著差异;而羊粪配施化肥下,则表现为变形菌门(P=0.032)、绿湾菌门(P=0.046)有显著性差异。较高量有机碳及化肥配施下,细菌前10门的相对丰度中,除绿湾菌门(P=0.008 197)在牛粪配施化肥、羊粪配施化肥间有极显著差异外,其他菌门间的相对丰度无明显差异。较低量有机碳及化肥配施下,细菌前10门的相对丰度中各菌门的相对丰度间均无明显差异,基于门水平上的细菌组成比较相似;但与对照相比,T4、T5处理也仅表现为绿湾菌门(P=0.026、P=0.029)有显著性差异。变形菌门、放线菌门、酸杆菌门、拟杆菌门、芽单胞菌门是宁夏中部旱作区不同有机、无机培肥模式下土壤的优势菌群;与对照相比,各有机、无机培肥方式下的土壤样品主要菌门的相对丰度之间存在差异。
根据Beta多样性距离矩阵进行层次聚类分析,比较土壤细菌群落的相似性和差异关系可以看出(图1),6个处理可聚为4大类,其中T0、T1处理分别单独聚为一类; T2和 T3处理的细菌群落聚类关系较近,聚为一类; T4、T5在聚类关系上也较近。总体上,低量外源有机碳配施化肥处理下土壤菌群结构相似度与T0处理间较近,其与高量外源有机碳和化肥配施以及单施化肥处理间的差异较大;牛粪配施化肥与羊粪配施化肥处理间的土壤菌群结构相似度较高。外源有机碳量的高低及有机肥料类型会对土壤细菌群落相似性产生影响。
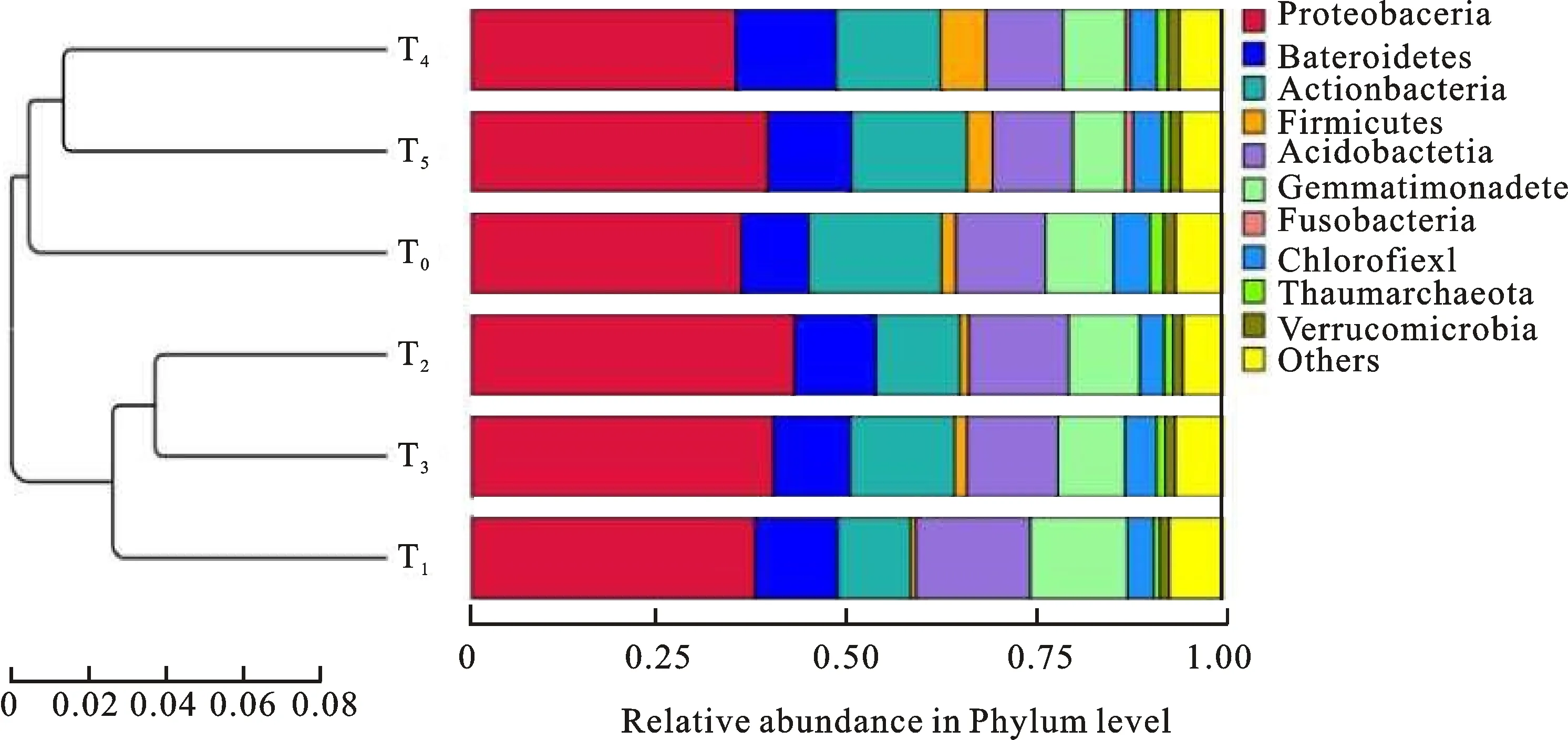
图1 基于加权配对算术平均法的土壤细菌群落聚类分析及门水平上分类学组成和分布Fig.1 The clustering analysis of soil bacterial communities,the taxonomic composition and the distribution based on the phylum level by the method of Weighted Paired Arithmetic Mean(PGMA)

图2 不同有机与无机培肥方式影响下的土壤细菌Beta多样性非度量多维尺度分析Fig.2 Analysis of soil bacterial beta diversity of Nonmetric Multidimensional scaling(NMDS) under the treatment of organic fertilizer and chemical fertilizer application
采用非度量多维尺度分析(NMDS)来反映土壤细菌群落的Beta多样性,结果表明(图2),对于基于门水平上的土壤细菌群落,不同有机与无机肥配施措施下各采样点彼此间距离较近。整体上,T2、T3与T0的距离较T1和T4与T0间的距离稍远,这说明中长期有机、无机培肥措施下,高量外源有机碳配施化肥(T2、T3)对土壤细菌Beta多样性的影响较其他处理略高。通过对999个排列组合的相似性(ANOSIM)分析发现,与T0相比,有机、无机肥配施各措施对土壤细菌Beta多样性的影响均显著。其中T1与T0相比(ANOSIM,R=0. 94,P<0.01)、T2与T0相比(ANOSIM,R=1.00,P<0.01)、T3与T0相比(ANOSIM,R=0. 67,P<0.01)、T4与T0相比(ANOSIM,R=0.29,P<0.01)、T5与T0相比(ANOSIM,R=0. 35,P<0.01) 均有显著性差异。但低量外源有机碳配施化肥的T4、T5之间(ANOSIM,R=-0.003,P=0.487)无显著性差异。高量外源有机碳配施化肥的T2、T3之间(ANOSIM,R=0.33,P=0.006)有显著性差异。可见,有机、无机相结合的培肥方式以及外源有机碳类型在持续培肥下会对土壤细菌群落组成产生显著影响。
2.3 有机与无机肥配施下土壤细菌群落与土壤性质的相关分析
主成分分析(PCA)分析显示了不同有机、无机培肥方式下,土壤理化性质与基于门水平上细菌相对丰度之间的关系(图3)。第一排序轴、第二排序轴能分别在累积变量61.53%和17.14%上解释相对丰度较高的前十门细菌群落的空间变化。变形菌门、酸杆菌门、芽单胞菌门的相对丰度与土壤pH、土壤碱解氮呈负相关;厚壁菌门、梭菌门、奇古菌门的相对丰度与土壤pH、土壤碱解氮呈正相关;拟杆菌门的相对丰度与土壤有机碳间有正相关关系(图3-A)。图3-B中,土壤细菌群落的Simpson指数和Shannon指数以及ACE和Chao1丰富度指数均与土壤有机碳和碱解氮呈负相关。第一排序轴、第二排序轴分别解释了土壤细菌丰富度、多样性变化的87.82%和 9.67%。第一排序轴对不同有机、无机培肥措施下的土壤细菌丰富度及多样性的变化解释量要比第二、三、四排序轴解释量的总和还要大。
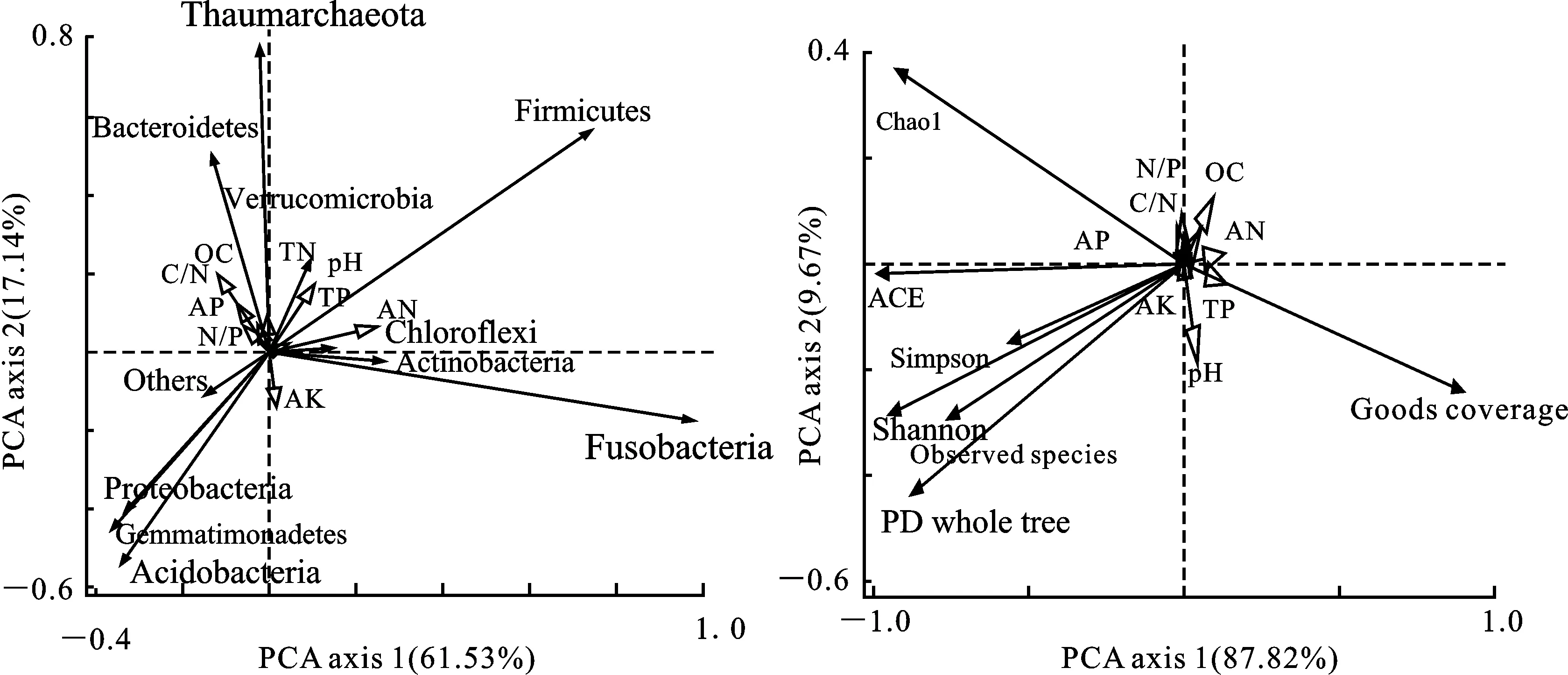
Chao1.Chao1指数 Chao1 index;ACE.ACE指数 ACE index;Shannon-香浓指数 Shanno index;Simpson-辛普森指数 Simpson index;pH;TN.土壤全氮 Total nitrogen;TP.土壤全磷 Total phouphorus);AP.土壤速效磷 Available phosphorus;AN.土壤碱解氮 Available nitrogen;AK.土壤速效钾 Available potassium;OC.土壤有机碳 Organic carbon;C/N.土壤碳氮比 Ratio of soil carbon and nitrogen;N/P.土壤氮磷比 Ratio of soil nitrogen and phosphorus
图3 基于门水平上土壤壤细菌相对丰度、多样性与土壤理化性状间的主成分分析
Fig.3 Principal component analysis(PCA) between relative abundance,diversity and richness of
soil bacterial communities based on phylum level and soil physical and chemical characteristics
3 讨 论
3.1 有机与无机肥配施对土壤理化性质的影响
试验结果表明,连续8 a有机、无机相结合的培肥方式,显著提高了土壤主要理化性状指标中各养分的含量,化肥配施牛粪(T2)、羊粪(T3)等较高量外源有机碳处理对土壤有机碳质量分数增加的效果较为显著。相关研究也证实,单施化肥、有机肥配施化肥均能显著提高土壤氮、磷等养分含量[15];氮肥、磷肥结合的长期定位试验显著增加了土壤总氮、有效氮、有效磷、总有机碳的含量[16]。分析认为,由于土壤有机质具有储存营养物质,驱动微生物活动和养分循环、促进土壤物理性质和保水能力等功能[17]。因此,培肥过程中,随外源输入有机碳数量的增加,有机、无机结合的方法促进了植物枯落物、植物地下作物根茬以及根系分泌物来增加碳的输入量,而输入较高量外源有机肥也可以直接为土壤提供丰富的有机碳源。Hai等[17]也认为,长期有机肥施用对土壤有机质的正效应可归因于有机肥的施用增加了土壤可提取的不稳定态及矿物结合态有机质库的缘故。因此,土壤有机质是直接和间接地影响土壤物理、化学、生物和土壤性质的主要因子[18]。
土壤C/N可以反映土壤碳和氮循环中的复合效应影响,通常用作估算土壤有机质质量的参数,其与土壤硝化和有机质的分解有关[19]。本试验中,有机肥、化肥配施有降低土壤C/N值的趋势,但各处理间无显著差异。相关研究认为,低C/N的有机物质输入可以导致土壤碳的正启动效应[19]。这意味着,可能由于牛粪、羊粪、生物有机肥往往具有相对较低的C/N,在化学氮肥施用量一定的情况下,随外源有机碳的输入,土壤微生物的分解速率加快。此外,土壤低C/N增加与碳循环有关酶的活性,相应加速纤维素、木质素和其他难以分解碳源的降解,进一步提高碳的有效性和氮相关的酶活性,通过提高氮的矿化速率,增加无机氮的含量[20]。这也就解释为什么外源有机肥配施化肥情况下,土壤C/N在不同培肥方式下均较低的原因。
3.2 有机肥与无机肥配施对土壤细菌群落多样性的影响
通常认为,有机和无机肥料的施用会影响土壤微生物的多样性、组成、丰富度和功能,各种有机物料的施用会对微生物多样性产生不同的影响[21]。由于土壤细菌是土壤生产力的基础,在土壤化学、物理性质,包括养分循环、有机物分解等方面伴有重要的角色。因此,伴随着施肥而引起土壤化学性状的改变就会影响细菌群落的组成和多样性[22]。已有报道发现,粪肥施用可以缓解长期施用无机肥导致的细菌多样性下降[23]。但本研究结果表明,连续8 a不同有机、无机配施的土壤培肥措施下土壤细菌的多样性和丰度与对照处理间均无显著差异。这与杨亚东等[24]在长期施肥(11 a)和灌溉对土壤细菌多样性和群落结构影响中发现,施有机肥和化肥处理的细菌群落ACE、Chao1 和香浓指数差异均不显著的研究结果是一致的。但张凯煜等[25]研究认为,肥料类型、施肥活动与土壤微生物群落组成及其多样性紧密相关,由于向土壤中人为大量输入外源物质从而导致土壤生态系统稳定性改变,有可能是导致土壤细菌群落多样性下降的主要原因。樊晓刚等[26]认为,土壤微生物通常具有比较稳定的多样性特征,其多样性一般比较稳定,在土壤培肥过程中,短期土壤培肥,对土壤微生物的影响作用比较有限。随培肥措施的应用,尽管土壤氮、磷、钾等无机元素和有机质等可利用性增加,能为更多的微生物提供生长和繁殖的条件,但由于土壤物理、化学性质(例如土壤类型、pH、含盐量)、作物品种、作物与微生物间的交互作用差异仅对特定细菌的发育产生较大影响[27]。 此外,目前的研究证实,土壤细菌的多样性主要由土壤pH和空间距离决定[28]。土壤 pH 是土壤微生物生物量和细菌群落多样性的限制因素[24]。因此,试验中同一试验地的不同有机、无机培肥措施下尽管已实施8 a,但土壤pH的差异只有0.07~0.22,这可能是导致不同处理下土壤细菌多样性只有极小差别,无显著性差异的原因。
耕地土壤细菌群落结构的变化明显依赖于土壤的理化性质,如土壤pH[29]、土壤类型[30]和土壤有机物含量的变化[31]。因此,在不同的土壤培肥措施下土壤优势菌群就可能存在变化。本试验结果表明,有机、无机相结合的土壤培肥措施下,土壤变形菌门是优势菌门,土壤变形菌门、 放线菌门、酸杆菌门相对丰度均较高,无论高量或低量外源有机物与化肥配施均提高土壤变形菌门的相对丰度,降低土壤放线菌门的相对丰度。Liu等[29]结果也证实畜禽粪便与化肥配合施用下土壤酸杆菌门,变形菌门、放线菌门、拟杆菌门和芽单胞菌门是土壤中普遍存在的主要类群。长期施用有机肥料和化学肥料下土壤绿湾菌门、变形菌门和酸杆菌门的相对丰度的总和超过总序列的70%,是不同处理下的主要菌门[32]。施用化肥能引起某些细菌种群的变化,无机化肥的施用可导致a-变形杆菌和g-变形杆菌的增殖,降低古细菌和氯酸杆菌的相对丰度[16]。分析认为,有机与无机肥配施增加土壤有机碳、全磷、速效磷等土壤养分,能消弱环境因子对土壤细菌群落的影响。例如,试验中在有机与无机培肥结合后放线菌门相对丰度反而降低,是因为土壤中放线菌门的优势多倾向于土壤有机质含量较低的土壤中,而外源土壤有机碳的输入及有机碳累积抑制了土壤放线菌门细菌的增长[32];变性菌门、拟杆菌门、酸杆菌门的细菌更适合于土壤养分含量相对较丰富的土壤,而导致相对丰度增加的趋势。
相关研究证实,绝大多数优势菌门都与土壤化学因子有一定的相关性[33]。本研究中,拟杆菌门的相对丰度与土壤有机碳呈正相关;相对丰度较高的变形菌门等细菌类群与土壤pH、土壤碱解氮质量分数呈负相关。这同侯建伟等[34]在研究中得出变形菌门相对丰富度与土壤碱解氮呈显著负相关(P<0.05)是一致的,但与土壤 pH 和 C/N与变形菌门极显著正相关的结论正好相反。侯建伟等[34]认为,由于细菌是土壤中最重要的分解者,因此长期无机或有机肥料的施用会导致能有效利用土壤营养物质的特定微生物的富集。通常而言,变形菌门细菌是一种营养丰富的共生性细菌,多存在于富含土壤有机碳的土壤条件下[28]。因此,化肥配施下,外源有机碳种类以及添加量高低导致土壤有机质含量的增加,可能是通过影响土壤 pH、碱解氮等因子与土壤细菌菌群的相互作用,从而促进参与分解过程的土壤细菌碳同化强弱来改变其群落组成的相对丰度。
4 结 论
变形菌门是中、长期有机、无机培肥措施下土壤细菌群落的优势菌门,受外源有机碳输入数量及有机肥类型的影响,基于门水平上土壤细菌群落结构组成的相对丰度发生改变,但土壤细菌群落的丰富度和多样性在不同处理间无显著差异。
土壤pH、土壤碱解氮、有机碳含量高低是驱动基于门水平上土壤主要细菌类群相对丰度高低变化的主要影响因素。有机与无机相结合的培肥方式对提高土壤肥力,促进旱作农业生产过程中合理施肥制度选择具有重要作用。
