纳米Fe/Ni催化降解2,4-二氯酚的机理及过程中参数变化
2019-11-20王珺雯宁晓勇范先媛
刘 红,王珺雯,阮 霞,宁晓勇,范先媛
(1. 武汉科技大学资源与环境工程学院,湖北 武汉,430081;2. 武汉科技大学冶金矿产资源高效利用与造块湖北省重点实验室,湖北 武汉,430081)
2,4-二氯酚是一种常见的氯代有机物,广泛应用于化工、医药、制革、电子和农药等诸多行业[1],但其毒性强、难降解、易在生物体中积累,常藉由挥发、容器泄漏、废水排放、农药和杀虫剂喷洒等方式进入环境[2],对地下及地表水资源造成不同程度的污染,因此,有效降解此类有机物是防治相关水体污染的重要途径。
纳米Fe颗粒具有粒径小、比表面积大、还原性强等优点[3],能降解环境中许多常规工艺难以处理的氯代有机物,Orth等[4]率先将其应用于多氯联苯(PCBs)还原脱氯并取得了较好的实验结果。然而,纳米Fe又常因团聚及氧化而导致自身活性降低,尤其作为降解剂单独使用时对含有苯环结构的氯代有机物脱氯降解效果欠佳。已有研究表明,如果将过渡金属Pd、Ni或Cu等沉积于纳米Fe表面,所制纳米铁基双金属则能催化加速氯代有机物的脱氯降解过程,并且该双金属体系还可以有效避免纳米Fe发生氧化,保持其反应活性及稳定性[5]。为进一步明确双金属体系降解氯代有机物的内在机理,本文以纳米Fe为基体结合过渡金属Ni制备纳米Fe/Ni双金属材料,重点分析了该材料对2,4-二氯酚的降解机理以及Ni在其中所起的作用,同时还探讨了在降解反应过程中,溶液的氧化还原电位、pH值、溶解氧及溶解铁等参数变化的根本原因。
1 实验材料与方法
1.1 试剂
FeSO4、NaBH4、NiSO4、2,4-二氯酚等,以上均为分析纯。
1.2 材料的制备
采用液相还原法制备纳米Fe/Ni双金属材料,具体步骤为:在N2保护条件下,向盛有50 mL FeSO4溶液(浓度为2 mol/L)的三颈烧瓶中逐滴加入相同浓度的NaBH4溶液总计100 mL并持续搅拌15 min,待其反应完全后再加入1 mL 浓度仍为2 mol/L的NiSO4溶液继续搅拌15 min,然后将混合液抽滤,所得固体产物经去离子水冲洗2~3次后再置于真空冷冻干燥机中干燥8 h,即可制得纳米Fe/Ni双金属复合材料。在上述制备过程中发生的主要化学反应为
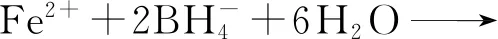
(1)
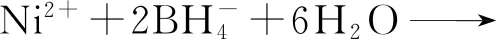
(2)
1.3 测试与表征
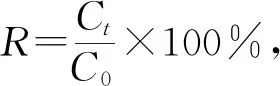
借助FEI Nova 400 Nano型场发射扫描电镜(SEM)及D/max-2500型 X射线衍射仪(XRD)对相关样品的微观组织结构进行表征。降解反应过程中的氧化还原电位数据由CHI-660E型电化学工作站测量得到;采用Sartorius PB-10型酸度计连续测量降解反应期间溶液pH值的变化;将JPSJ-606L型溶解氧测定仪置于反应溶液中以测量不同时间点的溶液溶解氧浓度;使用novAA 350型全自动火焰原子吸收光谱仪测量溶液中Fe2+含量变化。
2 结果与讨论
2.1 纳米Fe/Ni催化降解2,4-二氯酚的机理
2.1.1 纳米Fe/Ni催化降解2,4-二氯酚的方式
向2,4-二氯酚溶液中单独加入纳米Fe或纳米Fe/Ni双金属复合材料,在降解反应过程中2,4-二氯酚及其脱氯产物2-氯酚、4-氯酚和苯酚浓度的变化结果如图1所示。由图1可见,单独加入纳米Fe对2,4-二氯酚的降解效果较差,反应120 min时,纳米Fe仅去除了约16.7%的2,4-二氯酚,且脱氯产物生成量极低,而单独加入纳米Fe/Ni与2,4-二氯酚反应仅20 min时,溶液中2,4-二氯酚浓度降幅就已达70%,同时中间脱氯产物2-氯酚、4-氯酚以及最终脱氯产物苯酚生成量明显升高,相应浓度分别达到0.89、0.23、3.13 mg/L,当反应进行40 min后,溶液中2,4-二氯酚及中间脱氯产物2-氯酚、4-氯酚的浓度逐渐趋近于0,而苯酚浓度相比其峰值(约6 mg/L)虽略有减小,但降幅不大。上述实验结果表明,单独使用纳米Fe材料对2,4-二氯酚进行脱氯降解时效果不佳,该反应过程中2,4-二氯酚浓度小幅下降应归因于纳米Fe表面氧化物的吸附作用;当纳米Fe表面沉积金属Ni后,所制纳米Fe/Ni双金属复合材料对2,4-二氯酚的催化降解作用明显增强,降解率接近100%,且最终脱氯产物主要为苯酚。
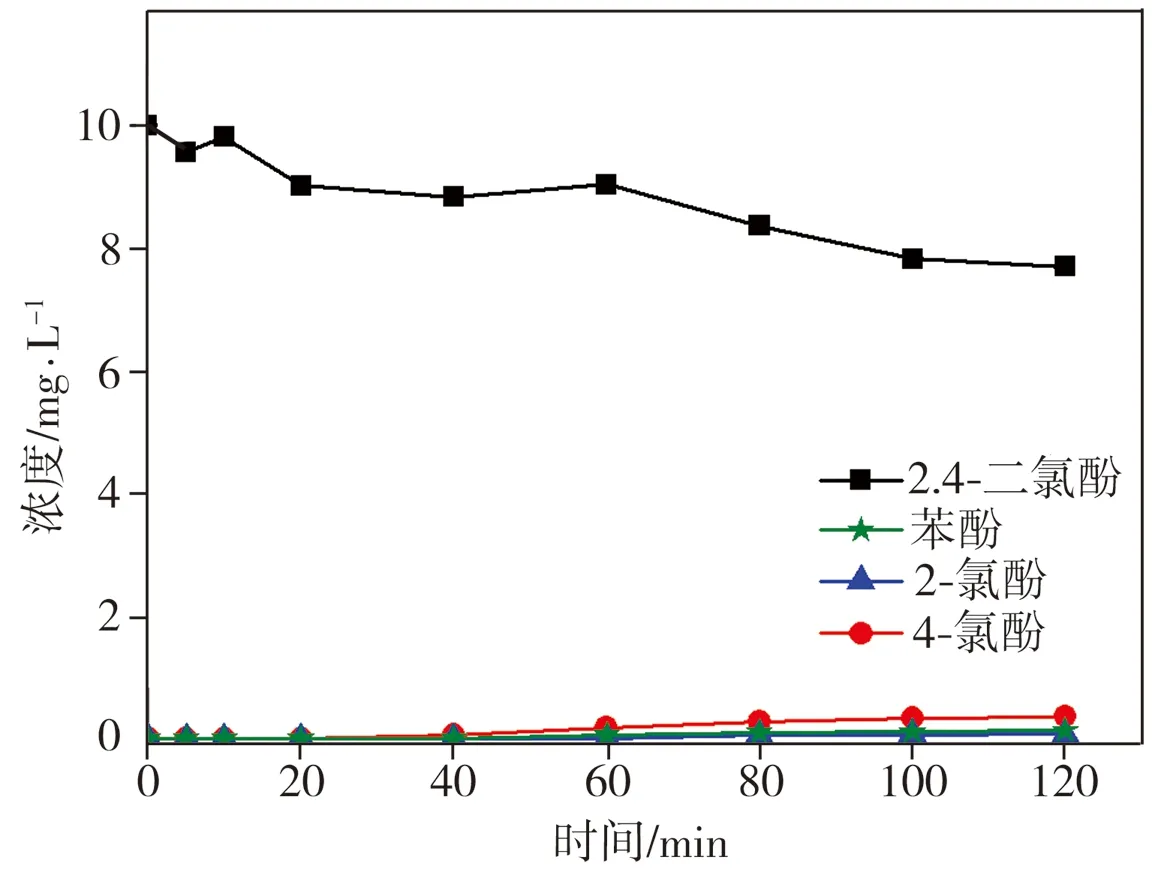
(a)纳米Fe
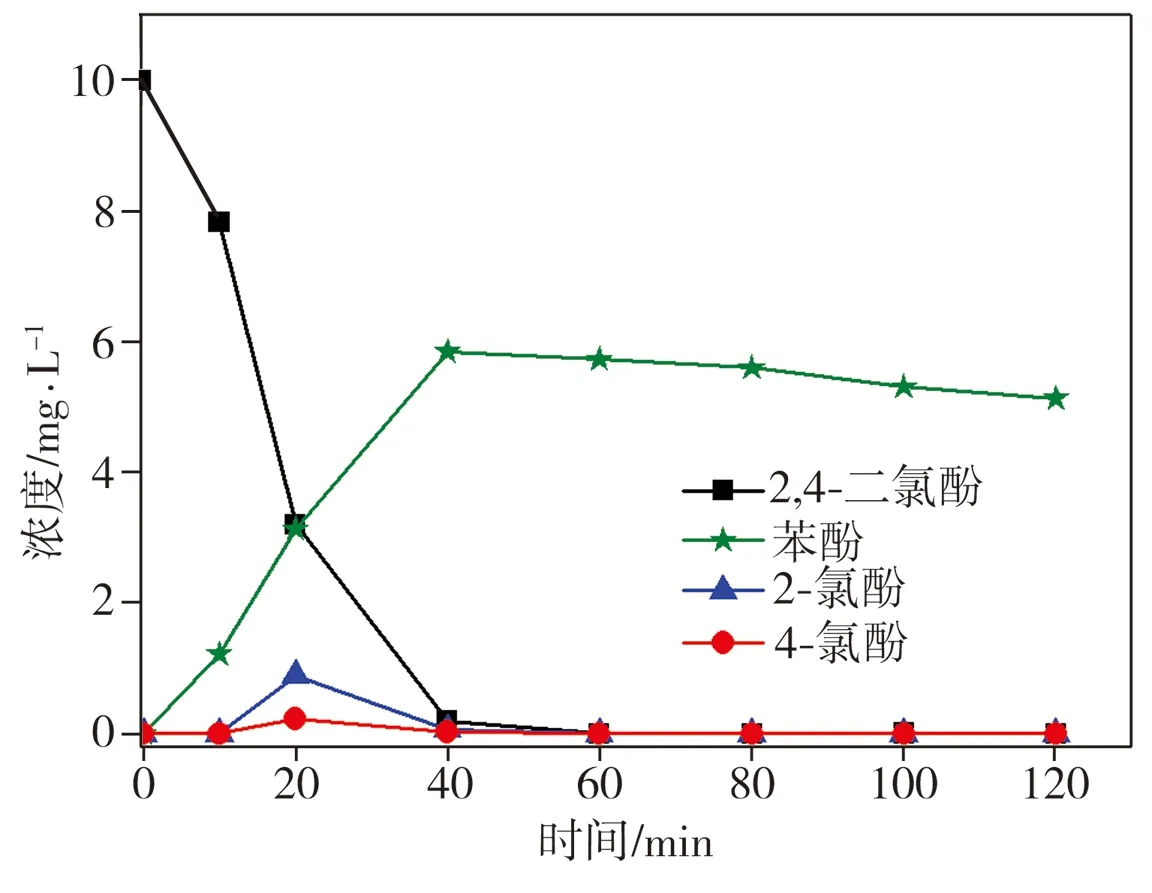
(b)纳米Fe/Ni
Fig.1 Degradation of 2,4-dichlorophenol by nano iron and nano Fe/Ni
对图1(b)数据进行质量平衡分析,结果如图2所示。由图2可见,溶液中2,4-二氯酚的浓度在反应阶段前20 min内急剧降低,同时生成了2-氯酚、4-氯酚及苯酚等3种脱氯产物,反应20 min时各产物相应的质量分数分别为8.25%、2.25%及67.78%;当反应进行至40 min时,2-氯酚及4-氯酚的质量分数均趋近于0,苯酚质量分数却持续升高至98.19%;当反应进行60 min后,溶液中几乎检测不到2,4-二氯酚、2-氯酚及4-氯酚的存在,而且苯酚的质量分数也较反应40 min时的相应值有所降低,这是因为当反应时间较长时,纳米Fe的腐蚀产物吸附了少量苯酚所致[6-7]。质量平衡分析结果表明,溶液中的2,4-二氯酚在纳米Fe/Ni作用下发生脱氯反应,能同时生成2-氯酚、4-氯酚及苯酚三种脱氯产物,其中2-氯酚和4-氯酚是该反应的中间产物且含量较少,随着反应的进行,二者将继续脱氯从而转变为苯酚。因此,纳米Fe/Ni降解溶液中2,4-二氯酚的主要方式为一次性脱除其苯环上的2个氯原子,将其直接转变为苯酚,同时,也有少量2,4-二氯酚先被降解为2-氯酚和4-氯酚,后两者再进一步被降解最终生成苯酚。
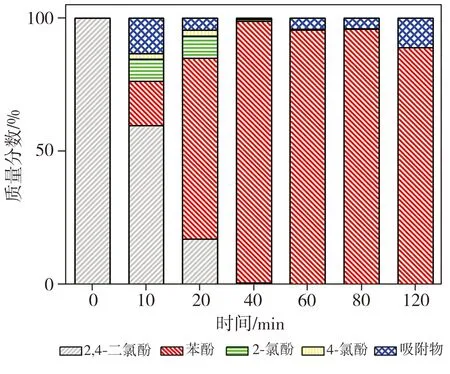
图2 质量平衡分析
2.1.2 SEM及XRD分析
纳米Fe/Ni双金属复合材料在降解反应前后的SEM照片及XRD图谱分别如图3、图4所示。由图3(a)可见,Fe/Ni颗粒呈球形且多数颗粒之间因磁性作用链接成串珠状,还有部分颗粒团聚形成尺寸较大的树枝状聚集体;当与2,4-二氯酚反应后,Fe/Ni球形颗粒消失,先前的串珠结构相应转变为扁平纤维结构并聚集成刺球状团聚体(图3(b))。这是因为在降解2,4-二氯酚的过程中,纳米Fe/Ni中的纳米Fe0与溶液中的2,4-二氯酚、水及溶解氧发生腐蚀反应后被氧化,最终生成氧化铁、氢氧化物或羟基氧化铁等,故材料形貌发生较大改变。从图4中可以看出,当发生降解反应后,纳米Fe/Ni XRD图谱中在2θ为44.7°

(a)反应前

(b)反应后
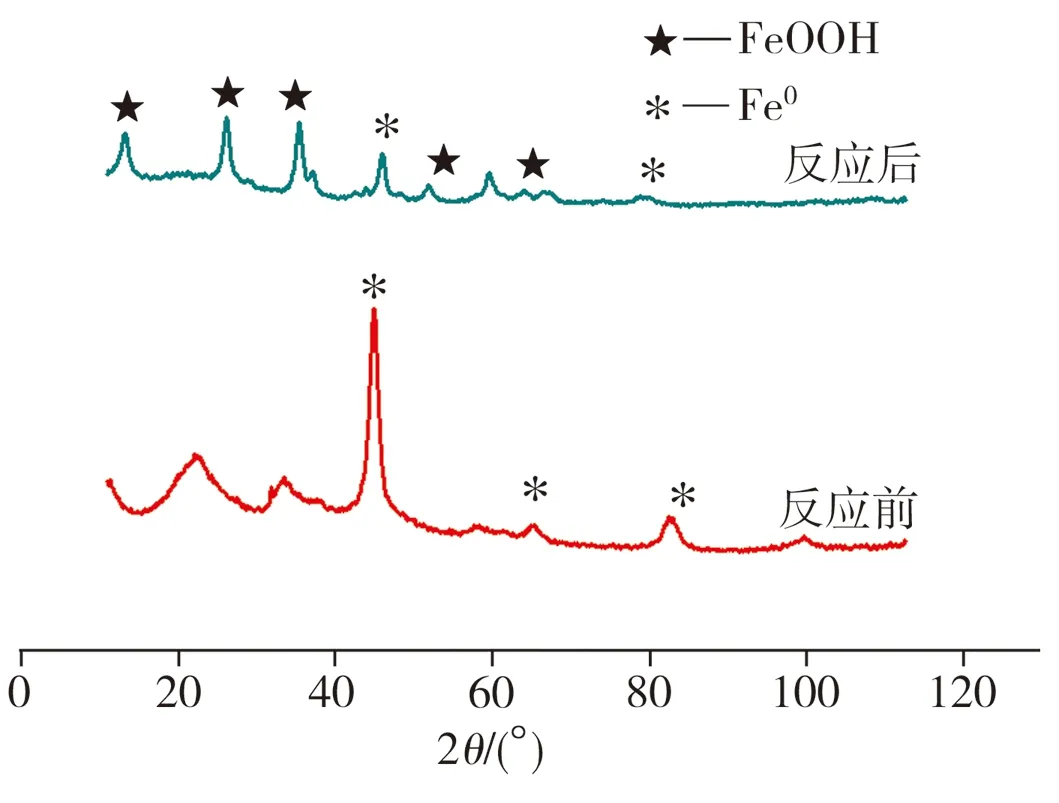
图4 XRD图谱
处纳米Fe0的特征峰强度明显降低,并且在2θ为13.3°、26.0°、35.5°、52.1°以及59.6°处均出现FeOOH(针铁矿)的特征峰,这表明在纳米Fe/Ni去除2,4-二氯酚的过程中,纳米Fe0被腐蚀消耗,主要转变产物为FeOOH。
2.1.3 Ni的催化作用
Ni主要通过三种途径来增强纳米Fe的脱氯降解能力[8-9]:(1)沉积于纳米Fe表面的Ni可在一定程度上避免其氧化,从而使其活性得到更好的发挥;(2)Ni可作为催化剂将纳米Fe的腐蚀产物H2催化转化为活性氢原子,而后者能打断2,4-二氯酚苯环上的C—Cl键使其脱氯降解;(3)Ni作为纳米Fe-Ni原电池的阴极,可促进电子转移从而加速反应。为明确Ni在纳米Fe/Ni双金属复合材料降解2,4-二氯酚过程中的催化作用及相应机制,分别在通氢及无氢条件下往2,4-二氯酚溶液中加入不同催化剂进行降解实验,其中在通氢状态时溶液溶解氢浓度为800 μg/L,测试结果如图5所示。从图5中可以看出,在仅通入H2的条件下,进行降解反应120 min时,2,4-二氯酚浓度虽相比初始值有所下降,但脱氯产物苯酚生成量极低,这表明单独使用H2不能有效还原降解2,4-二氯酚,后者浓度略有降低可能与其在通气状态下的挥发有关。在无H2加入纳米Fe的条件下,2,4-二氯酚浓度随反应时间出现先降低后升高的变化,可能是因为2,4-二氯酚先被纳米Fe的腐蚀产物所吸附,之后又随该产物的进一步转化发生了脱附;而在通H2加入纳米Fe的条件下,2,4-二氯酚浓度的变化与无H2加入纳米Fe时相似,只是2,4-二氯酚去除率相比后者略偏低,这应是纳米Fe及其腐蚀产物表面因附着H2而导致自身对2,4-二氯酚的吸附能力下降所致。在无H2加入纳米Ni的条件下降解2,4-二氯酚120 min时,仅有14.1%的2,4-二氯酚被吸附去除且几乎没有脱氯产物苯酚生成,而当通入H2后,在相同实验条件下反应40 min时,2,4-二氯酚的去除率已高达97.1%,且最终脱氯产物苯酚的生成率为95.8%,该实验结果证实Ni对H2具有较强的催化转化作用。当加入纳米Fe/Ni双金属催化剂时,无需通入H2,反应100 min时2,4-二氯酚的去除率即可达到93.8%,这是因为纳米Fe的自身腐蚀可产生H2,H2又在纳米Fe表面沉积的Ni的作用下进一步转化为活性氢原子,而活性氢原子对2,4-二氯酚的脱氯降解能力极强;在通入H2的条件下,纳米Fe/Ni对2,4-二氯酚的最大降解率较未通H2时略微增大,降解速率也稍有提高,反应60 min时2,4-二氯酚的降解
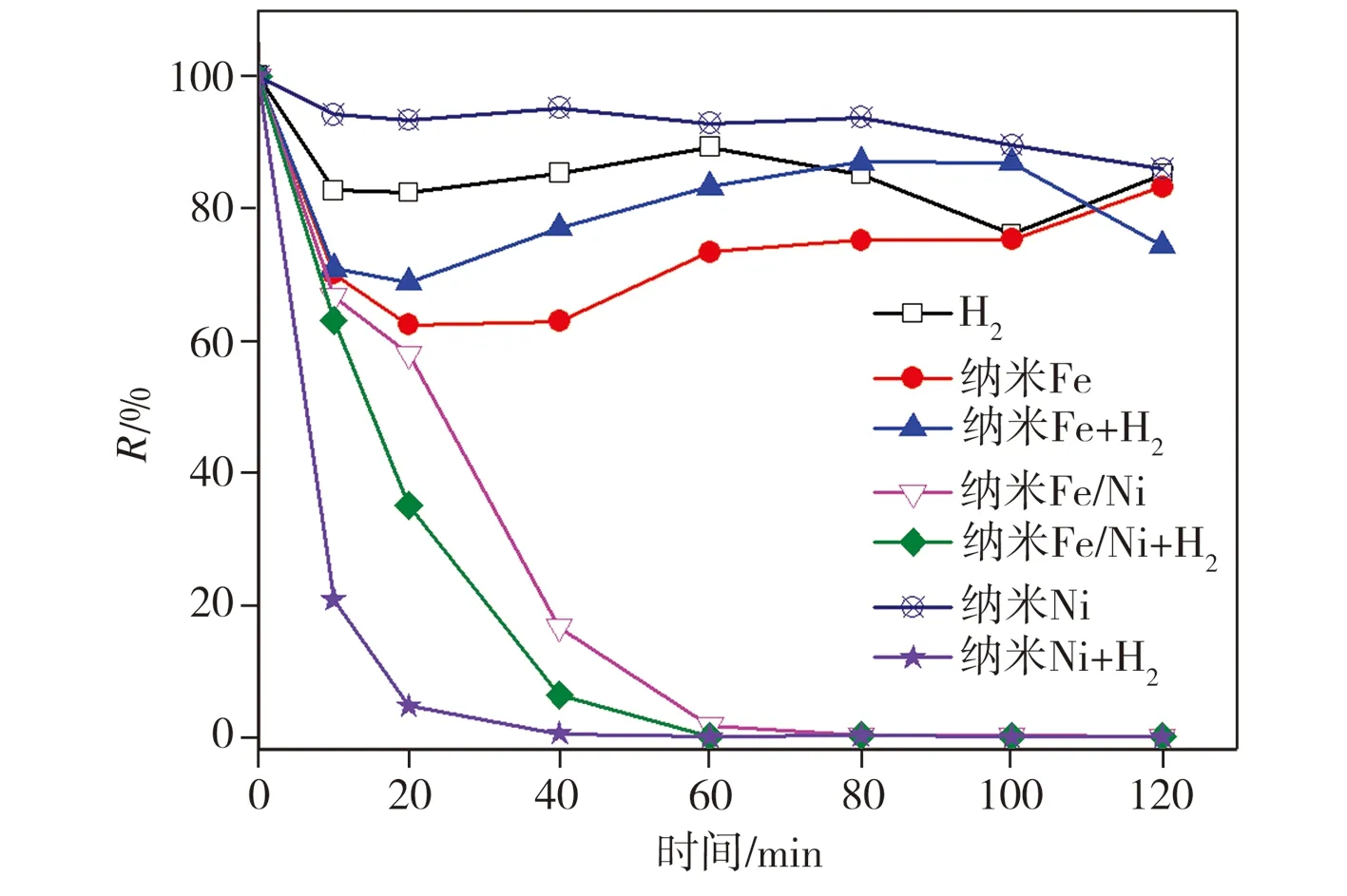
(a)2,4-二氯酚残存率
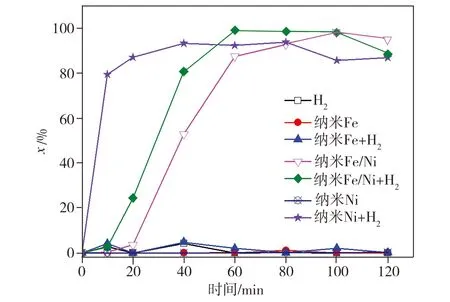
(b)苯酚生成率
图5 在通入/未通H2条件下对2,4-二氯酚的降解
Fig.5 Degradation of 2,4-dichlorophenol with/without H2
率已接近极值。综合来看,在通氢加纳米Ni条件下的2,4-二氯酚降解速率最快,降解反应40 min时2,4-二氯酚的降解率即达到极值,这应归因于在此条件下,催化剂中Ni含量最高。
为进一步考察H2与Ni在2,4-二氯酚脱氯降解过程中的协同作用,在不同通氢条件下加入纳米Ni对溶液中2,4-二氯酚进行脱氯降解,其中通氢状态下溶液溶解氢浓度分别为300、400、500、900 μg/L,测试结果如图6所示。由图6可以看出,在未通氢状态下,加入纳米Ni仅对2,4-二氯酚产生吸附作用,且吸附量较小,几乎无脱氯产物苯酚生成。当通入氢气且溶液溶解氢浓度为300 μg/L时,苯酚生成率在降解反应20 min时即可达42.3%,当溶液溶解氢浓度分别提升至400、500、900 μg/L时,降解反应40 min时苯酚生成率相应达到82.1%、85.8%和93.3%, 2,4-二氯酚的脱氯降解效率随溶解氢浓度的升高而升高。上述结果表明,当Ni与H2共存时才能对2,4-二氯酚实现有效脱氯降解,且溶解氢浓度越大,2,4-二氯酚的去除率越高,这从另一个侧面证明了Ni对H2具有催化转化作用,其转化产物对2,4-二氯酚加氢还原效果较好。
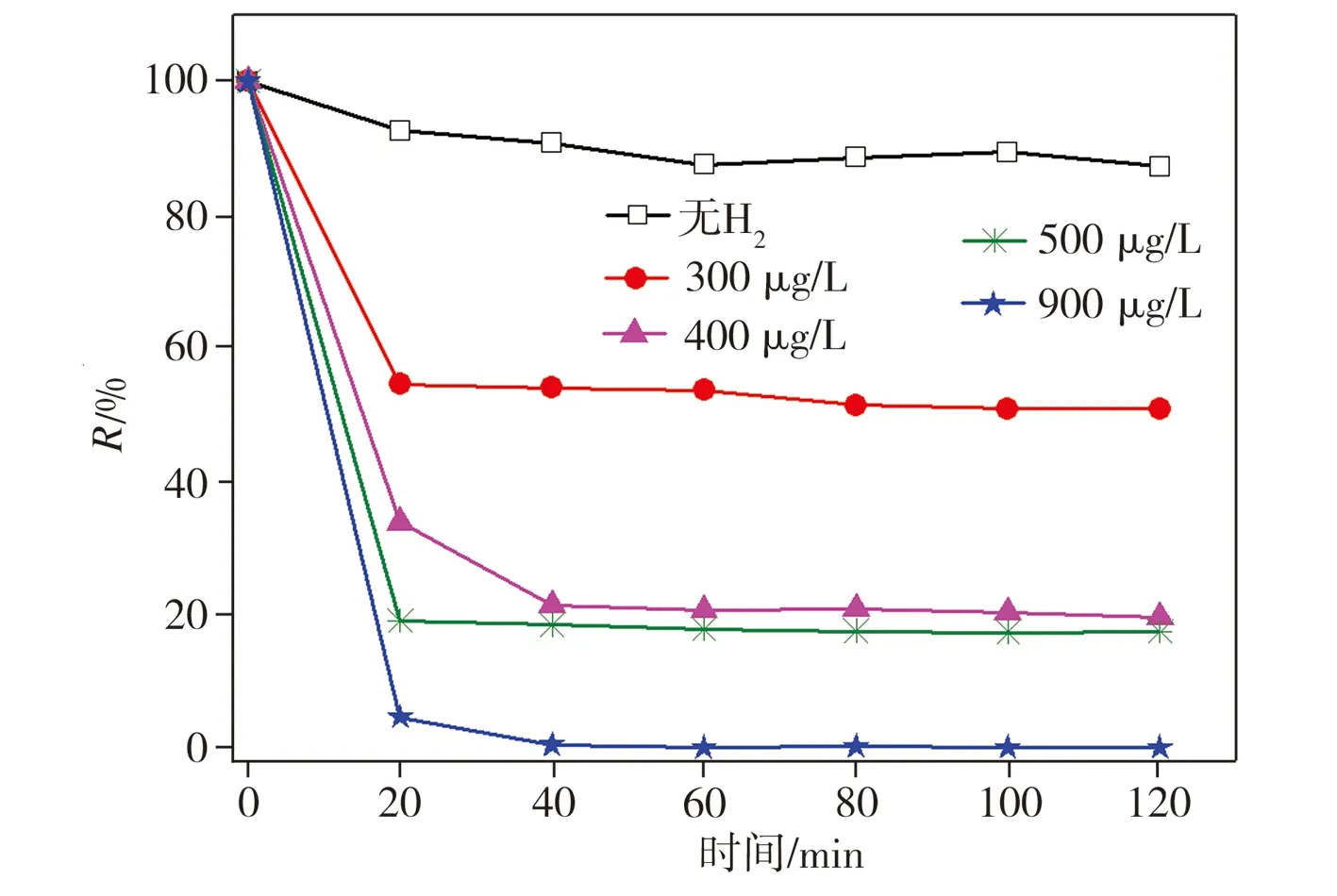
(a)2,4-二氯酚残存率
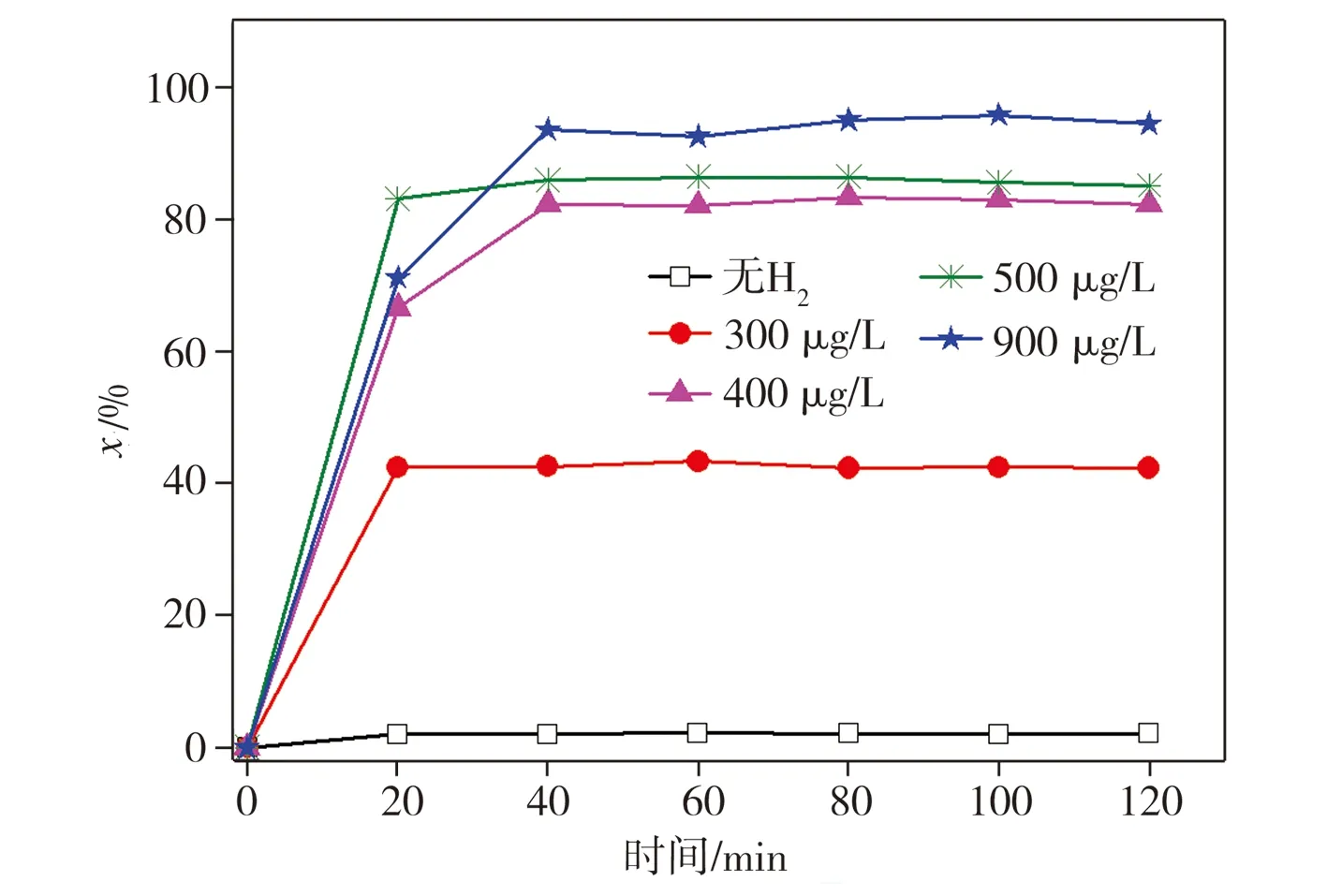
(b)苯酚生成率
图6 在不同溶解氢浓度条件下2,4-二氯酚的降解
Fig.6 Degradation of 2,4-dichlorophenol with different concentrations of dissolved hydrogen
2.2 2,4-二氯酚降解反应中的参数变化
向2,4-二氯酚溶液中分别加入纳米Fe及纳米Fe/Ni双金属复合材料后,溶液氧化还原电位的变化情况如图7所示。由图7可见,向2,4-二氯酚溶液中分别加入纳米Fe及Fe/Ni材料后,两组溶液氧化还原电位均在反应开始的5 min内由+0.2107 V急剧降至-0.6 V左右,此后,加入纳米Fe的溶液电位值在反应进行20 min后稳定在-0.6497 V左右,与初始2,4-二氯酚溶液之间的电位差ΔE1约为-0.8604 V,而加入纳米Fe/Ni的溶液电位值在反应30 min后略有下降,最终与初始2,4-二氯酚溶液之间的电位差ΔE2约为-0.9302 V。氧化还原电位测试结果表明,纳米Fe/Ni相比纳米Fe具有更强的还原性,这应归因于Ni能够与Fe构成Fe-Ni原电池[10],从而促进纳米Fe腐蚀产生更多的还原性物质如Fe2+、H2等。
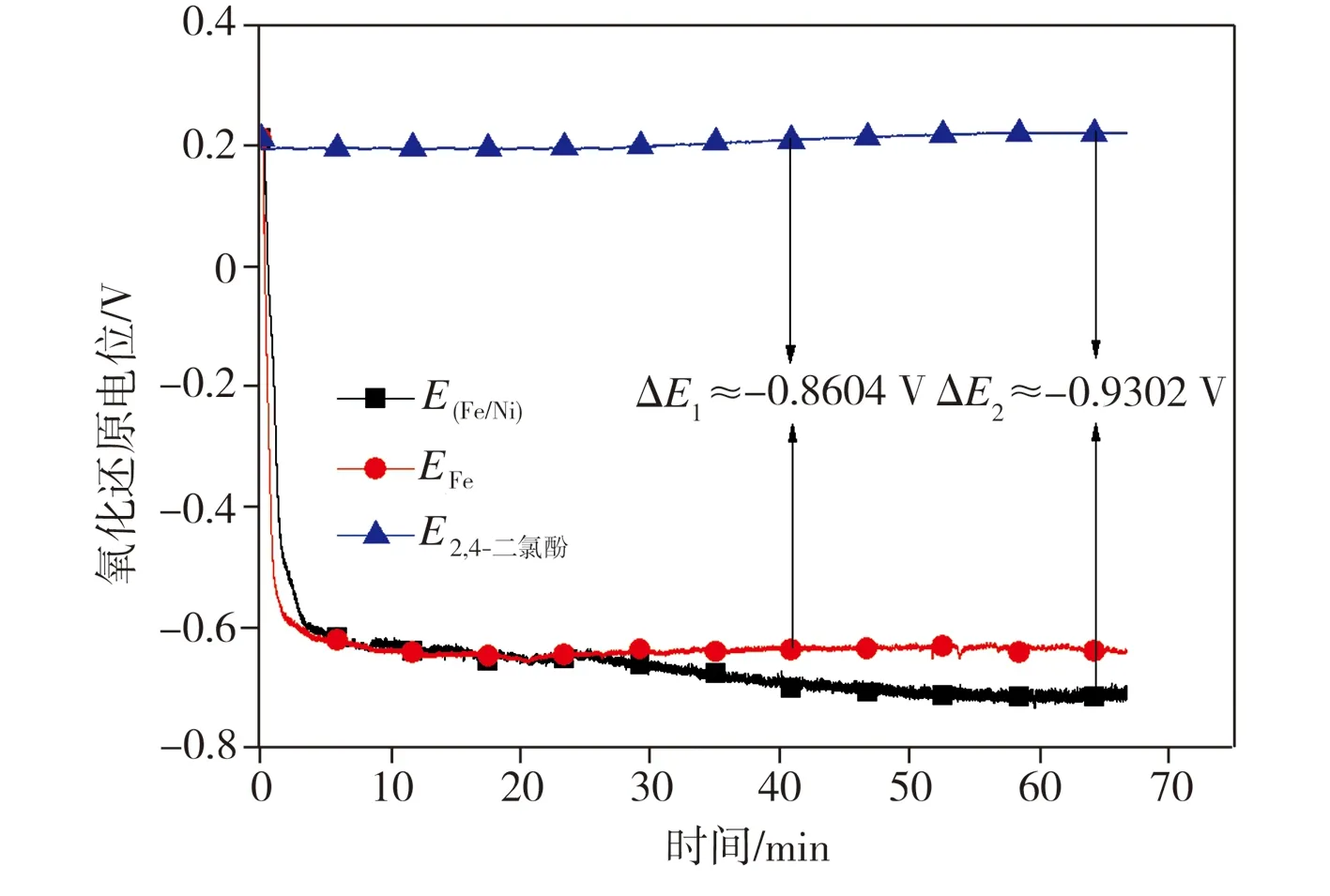
图7 氧化还原电位的变化
加入纳米Fe/Ni后的2,4-二氯酚溶液pH随反应时间变化的测试结果如图8所示。从图8中可看出,向2,4-二氯酚溶液中加入纳米Fe/Ni后,溶液pH在10 min内从初始值5.7迅速上升至8左右,这是因为纳米Fe/Ni中的Fe与水接触时发生腐蚀反应,产生大量OH-从而导致pH值升高,此外,反应所产生的氢气经金属Ni催化后转化为活性氢原子。该过程主要反应式为

(3)
室温下测得2,4-二氯酚溶液饱和状态下的溶解氧浓度为8.08 mg/L,当向其中加入纳米Fe/Ni后,溶解氧浓度随反应时间的变化如图9所示。由图9可见,当添加纳米Fe/Ni后,2,4-二氯酚溶液中的溶解氧浓度在反应开始后的5 min内由8.08 mg/L迅速降低至1.94 mg/L,该过程发生的反应为

(4)
随着反应继续进行,按理论上来说,溶解氧将持续被消耗,其浓度应逐渐趋近于0(见图9理论值曲线),但本研究取样时打开了锥形瓶盖造成空气进入,在饱和溶液溶解氧浓度与实际溶液溶解氧浓度之间的浓度差作用下,空气中的氧气溶入溶液使得溶解氧浓度在反应20 min后呈缓慢上升趋势,且最终稳定于5.5 mg/L。
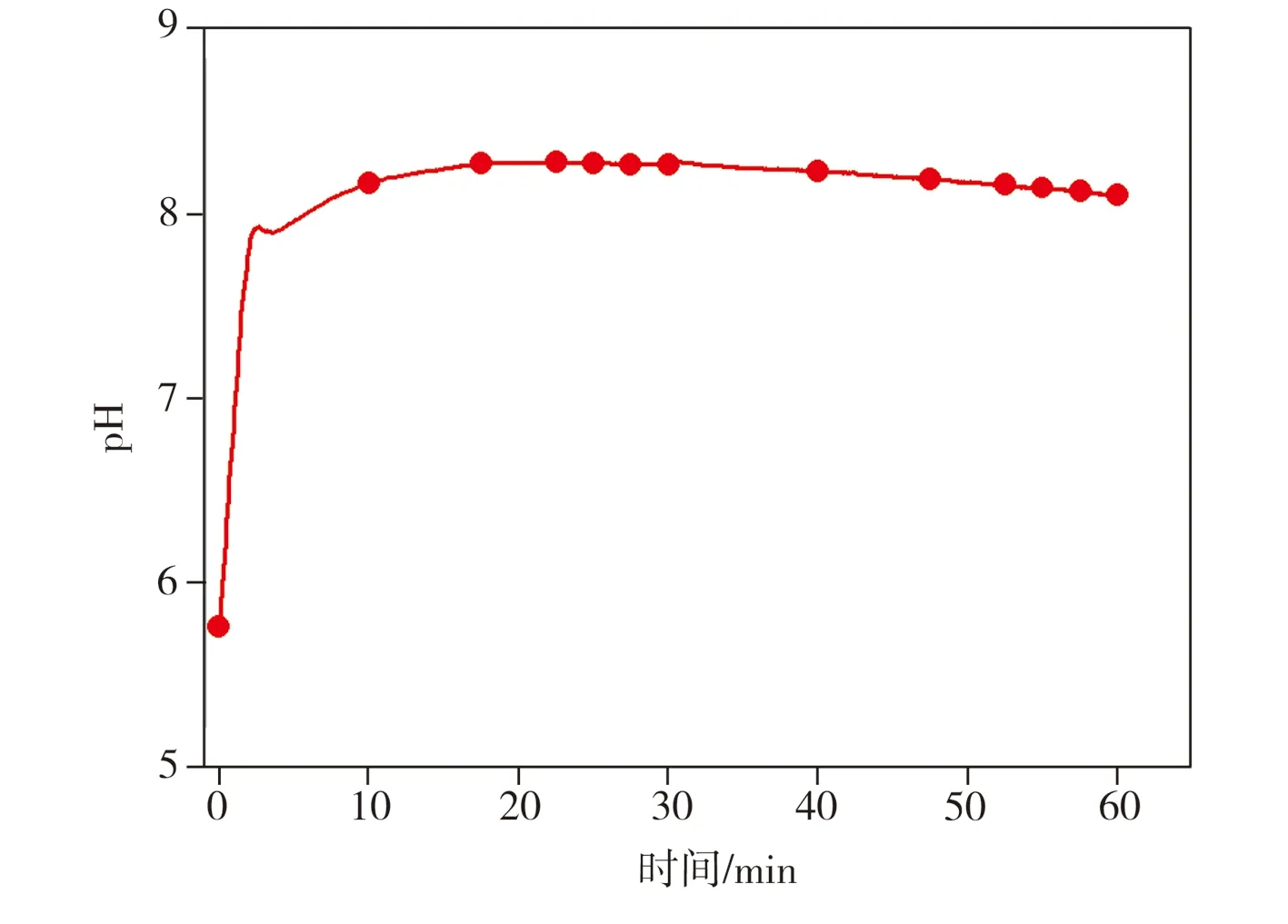
图8 pH值的变化
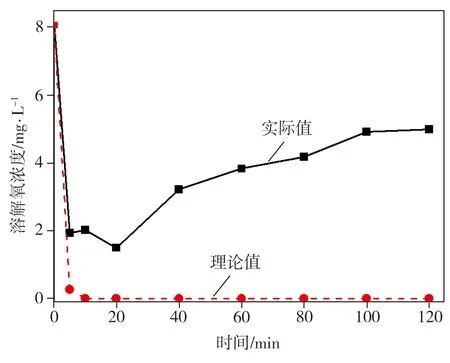
图9 溶解氧浓度的变化
在纳米Fe/Ni与2,4-二氯酚溶液反应过程中,溶液溶解铁的浓度变化如图10所示。从图10中可以看出,在反应开始后的20 min内,溶液中溶解铁浓度急剧增至8.89 mg/L,这是因为纳米Fe与水反应,生成了大量Fe2+(式(3)),结合溶液pH值与溶解氧测试结果可知,此时Fe2+处于pH为8~9的弱碱还原性环境中,将生成Fe(OH)2沉淀[11],随后Fe2+浓度升高速率减慢,当反应时间超过40 min后,由于打开锥形瓶盖取样,溶液中的溶解氧因空气进入而得到补充,Fe(OH)2及Fe2+通过反应生成Fe(OH)3或Fe3O4沉淀[12-13],最终溶解性铁含量稳定在9.6 mg/L左右。该过程中发生的主要化学反应为

(5)

(6)

(7)
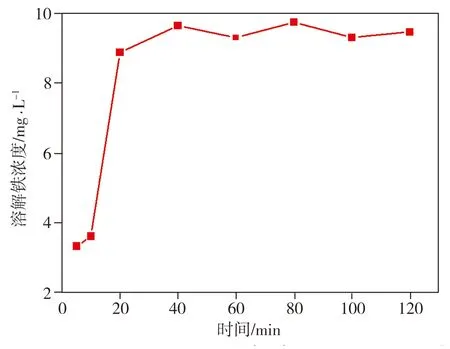
图10 溶解铁浓度的变化
3 结论
(1)纳米Fe/Ni降解2,4-二氯酚的主要方式为一次性脱除2个氯原子,将2,4-二氯酚直接还原降解为苯酚,还有部分2,4-二氯酚先被降解为中间产物2-氯酚和4-氯酚后再被降解为苯酚。
(2)Ni在纳米Fe/Ni降解2,4-二氯酚过程中的催化机制是将纳米Fe腐蚀产生的氢气催化转化为活性氢原子,活性氢原子再对2,4-二氯酚通过加氢还原完成其脱氯降解。
(3)在纳米Fe/Ni降解2,4-二氯酚反应初期,溶液氧化还原电位、溶解氧浓度快速下降,而pH与溶解铁浓度急剧升高,随着反应的进行,上述各参数值均趋于稳定。
