添加餐厨废油脂培养酵母进行γ-癸内酯生物转化
2019-11-14王荣霞朱廷恒汪琨
王荣霞,朱廷恒,汪琨
(浙江工业大学 生物工程学院,浙江 杭州,310014)
γ-癸内酯(γ-decalactone,GDL)是一种天然存在于草莓、桃子等水果中的内酯类香料,具有较低的香气阈值,是国际公认的安全的食品添加剂[1-2]。随着对美味食品、饮料等消费的不断增长,天然食品香料添加剂的需求不断增加。
生物法生产的GDL与天然植物成分更接近,得到了高度的重视[3-4]。GDL的生物转化是以脂肪酸和脂肪酸酯作为底物,利用微生物进行发酵转化生产。微生物有解脂耶氏酵母(Yarrowialipolytica)[5-7]、酿酒酵母(Saccharomycescerevisiae)[8]、Lindnerasaturnus等[9],这几株菌GDL产量分别为:0.168~1.597、0.954、0.512 g/L,其中解脂耶氏酵母是生产GDL的最主要菌株。
目前报道的解脂耶氏酵母生产GDL都是利用完全培养基[10-11],含酵母提取物(10 g/L)、葡萄糖(20 g/L)等,工业化生产的成本高。已报道的解脂耶氏酵母的不同菌株(又见解脂假丝酵母CandidalipolyticaCICC31223)[12-13],产酶活性和GDL差别很大,有的菌株能分泌大量的脂酶和酯酶,可以分解利用脂类物质进行生长,但是不能转化生产GDL。如果能够利用廉价的脂类物质替代完全培养基中部分营养成分,利用不同酵母菌株进行分解,再利用产GDL的解脂耶氏酵母进行GDL转化生产,则可以显著降低工业化生产成本。
我国餐厨废弃油脂的量十分巨大[14-15],开发利用这种废弃资源作为培养基成分进行酵母培养[16]并转化生产GDL,是一种既经济又环保的方法。利用不同菌株混菌发酵协同降解餐厨废油脂,获得一定生物量的解脂耶氏酵母再进行GDL的转化生产,是一条很有生产应用潜力的途径,迄今尚无相关报道。
GDL的生物转化法是对前体物蓖麻油酸经β-氧化生成[17-18]。解脂耶氏酵母中酰基辅酶A氧化酶家族(pox1-6分别编码Aox1-6)是催化GDL生成的限速酶。其中Aox2表现出长链特异性,Aox3是短链特异性[19],增加pox2拷贝比敲除pox3更有利于GDL产量提高[20]。
本研究探索添加餐厨废油脂替代培养基中部分葡萄糖和酵母提取物,利用不同菌株混合发酵协同降解油脂,获得较多解脂耶氏酵母生物量后再进行GDL转化。同时构建了过表达pox2基因的工程菌株并进行了转化研究。
1 材料与方法
1.1 菌株
解脂耶氏酵母(Y.lipolytica)G3菌株:本实验室选育保存的菌株;解脂假丝酵母(C.lipolytica)CICC31223:购自工业微生物菌种保藏中心;大肠杆菌(Escherichiacoli)DH 5α:本实验室保存。
1.2 培养基
YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10,固体添加20g琼脂。
转化培养基(g/L):蓖麻油酸60,吐温-80 5,KH2PO40.55,Na2HPO40.31,无水MgSO40.16,pH自然。
混菌发酵培养基(g/L):蓖麻油20,餐厨废弃油脂40,吐温-80 5,KH2PO40.55,Na2HPO40.31,无水MgSO40.16,pH自然。
以上所有培养基均121 ℃灭菌20 min。
扩大培养基M1~M6成分及含量如表1:

表1 培养基成分 单位:g/L
注:餐厨废弃油脂由学校食堂废弃油脂分离得到;“-”代表未添加。
1.3 酵母降解酯类及生物量测定
测定不同酵母菌株降解酯类的能力。酯和内酯在碱性条件下与羟胺反应生成异羟肟酸,在酸性条件下异羟肟酸又与Fe络合生成的紫红色络合物在OD506 nm有吸收[21]。挑取酵母单菌落于5 mL YPD液体培养基,28 ℃振荡(200 r/min)培养过夜;转接至30mL液体YPD培养基中,28 ℃振荡(200 r/min)培养12 h, 6 000 r/min,离心3 min,菌体沉淀用山梨醇缓冲液洗涤2次,将菌浓度调至OD600nm=1的菌悬液,以8%的接菌量接种至60 mL/500 mL的转化培养基中。28 ℃ 200 r/min振荡培养,每隔12 h取500 μL发酵液,6 000 r/min,离心3 min,上清液稀释至1.5 mL后测酯含量,菌体沉淀用于测生物量。将1 mL 0.5 mol/L的盐酸羟胺乙醇加入到试管中,再加300 μL 6 mol/L的NaOH,加入1.5 mL已稀释的发酵上清液;剧烈振荡100 s,加入500 μL 4 mol/L的HCl溶液;待溶液变澄清,继续加入150 μL 5 g/L的FeCl3溶液显色,酶标仪测定OD506 nm,每组3个平行样。
分光光度计法测生物量:用1 mL 50%(体积分数)的乙醇悬浮菌体沉淀,6 000 r/min,离心3 min,去上清,重复洗涤1次,去离子水重悬浮。测OD600 nm。
1.4 GDL测定方法
1.4.1 样品处理
取200 μL的发酵液,与200 μL 1 g/L的桃醛溶液和500 μL乙酸乙酯溶液混合,振荡混匀,8 000 r/min,离心1 min,将200 μL上清液转移至新的1.5 mL的离心管,精确地取1 μL进样测GDL含量。
1.4.2 高效气相色谱检测条件
HP-INNOWAX毛细管色谱柱(30 m×0.32 mm×0.25 μm);柱温180 ℃保持10 min,载气(N2)流速4.3 mL/min,进样1 μL;FID检测器温度280℃;分流比10∶1。
1.5 过表达pox2基因的解脂耶氏酵母工程菌构建
1.5.1 工程菌构建及分子鉴定
为了构建解脂耶氏酵母酰基辅酶A氧化酶基因pox2过表达菌株,合成由解脂耶氏酵母组成型启动子驱动的pox3U-P-hph-T-P-pox2-T-pox3D表达框。pox3U,pox3D分别位于pox3(Gen Bank accession AJ001301)上游1 840-2 261 bp和下游4 247-4 666 bp区域;P是解脂耶氏酵母胞外碱性蛋白酶基因组成型启动子XPR2(Gen Bank accession KF975902);hph是潮霉素抗性基因(Gen Bank accession MG680575);pox2(Gen Bank accession AJ001300)。上述各片段组成的重组表达框通过化学合成并克隆到pUC57空载质粒上(常州基宇生物公司),将质粒转入大肠杆菌中扩大培养,提取质粒经双酶切获得该重组表达框片段,用酵母转化试剂盒(Frozen-EZ Yeast Transformation ⅡTM)通过同源重组转入到解脂耶氏酵母G3中,涂布在含有400 μg/mL潮霉素的平板上进行初筛,待长出单菌落,转接至含有潮霉素的液体YPD中,28 ℃振荡(200 r/min)培养48 h,提取酵母基因组,进行PCR鉴定,通过分子鉴定的转化子,使用TAIL-PCR法[22-23]验证插入位点。分子鉴定引物如表2。
1.5.2 酵母菌株GDL产量的测定
挑取酵母单菌落于5 mL液体YPD培养基,28 ℃振荡(200 r/min)培养过夜;转接至30 mL液体YPD培养基中,28 ℃振荡(200 r/min)培养12 h, 6 000 r/min,3 min离心收集菌体,用山梨醇缓冲液洗涤2次菌体,将菌浓度调至OD600 nm=1的菌悬液,以8%的接菌量接种至30 mL/250 mL的含蓖麻油酸的转化培养基中。28 ℃振荡(200 r/min)培养72 h。利用高效气相色谱检测GDL的产量。

表2 引物列表Table 2 List of the primers
1.6 含餐厨废油脂培养基酵母培养及混菌发酵条件的探索
1.6.1 餐厨废油脂培养酵母菌株
挑取酵母单菌落,接种于5 mL的液体YPD培养基中,28 ℃振荡(200 r/min)培养过夜;转接至30 mL/250 mL扩大培养基中,培养12 h,培养条件同上,6 000 r/min,离心3 min,收集菌体,用山梨醇缓冲液洗涤菌体2次,将菌浓度调至OD600 nm=1的菌悬液,以1%的接菌量接种到30 mL/250 mL扩大培养基(M1~M6)中,28 ℃振荡(200 r/min)培养12 h后,将菌液转移到50 mL的离心管,6 000 r/min,3 min离心,弃上清,用无菌水洗涤3次菌体,使用分光光度法测生物量。以上每个试验设置3个平行试验,并重复3次。
1.6.2 混菌发酵转化适宜条件的探索
1.6.2.1 混菌发酵转化适宜的接种方式
将混菌发酵培养基以每瓶30 mL分装于250 mL的锥形瓶中。将适宜扩大培养基培养得到的菌液,调整其浓度,调至OD600 nm=1的菌悬液,以总接种量为8%,分别按以下3种接种方式接入适宜比例的菌悬液。以等量的无菌生理盐水代替菌悬液作空白对照,28 ℃振荡(200 r/min)培养72 h,检测GDL的产量。以上每个试验设置3个平行试验,并重复3次。
按种方式分为3种,分别为:A先接种解脂耶氏酵母菌株,12 h后再接种解脂假丝酵母菌株;B先接种解脂假丝酵母菌株,12 h后再接种解脂耶氏酵母菌株;C同时接种解脂耶氏酵母菌株,解脂假丝酵母菌株。
1.6.2.2 混菌发酵转化适宜的接种比例
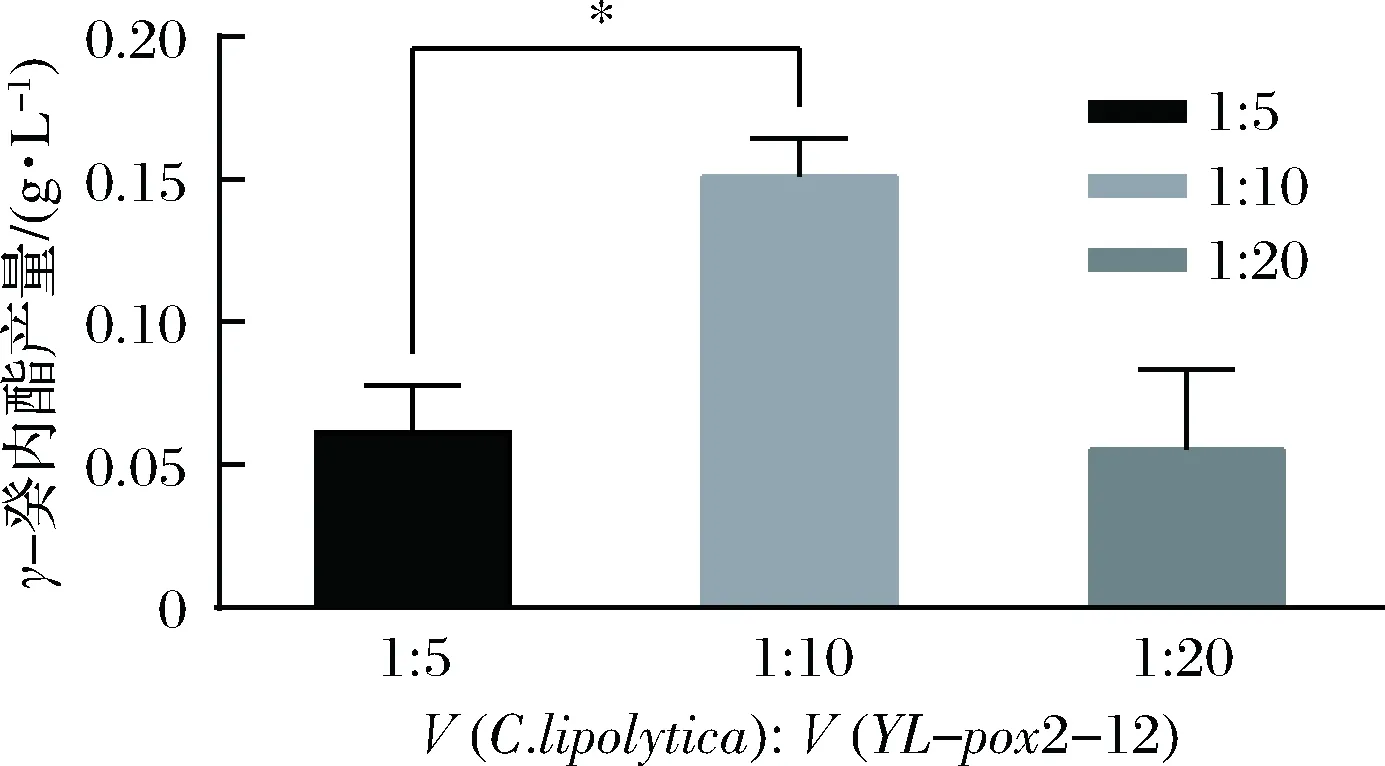
将混菌发酵培养基以每瓶30 mL分装于250 mL的锥形瓶中。将适宜扩大培养基培养得到的菌液,调整其浓度,调至OD600 nm=1的菌悬液,以总接种量为8%(分别以V(C.lipolytica)∶V(YL-pox2-12)=1∶10,1∶20、1∶30的比例接入菌液,以等量的无菌生理盐水代替菌悬液作空白对照,28℃振荡(200 r/min)培养72 h,检测GDL的产量。以上每个试验设置3个平行试验,并重复3次。
2 结果与分析
2.1 酵母降解酯类及生物量测定
为了观察解脂耶氏酵母G3与解脂假丝酵母CICC31223转化培养基中酯含量的变化,将2种菌株以相同浓度,接种到相同培养基中,每隔12 h取样测总酯含量。结果发现解脂假丝酵母处理后总酯含量呈下降趋势,而解脂耶氏酵母总酯含量基本不变,说明解脂假丝酵母能够更好地利用油脂(图1),但是该菌株GDL产量很低(结果见下文)。生物量测定结果表明,24 h之前,2株菌的生长速率相同,但是在24 h之后解脂耶氏酵母的生长速率较低(图2),可能是因为解脂耶氏酵母细胞生长受到发酵过程产生的内酯抑制。

图1 转化过程中总酯的变化Fig.1 Changes in total ester during conversion
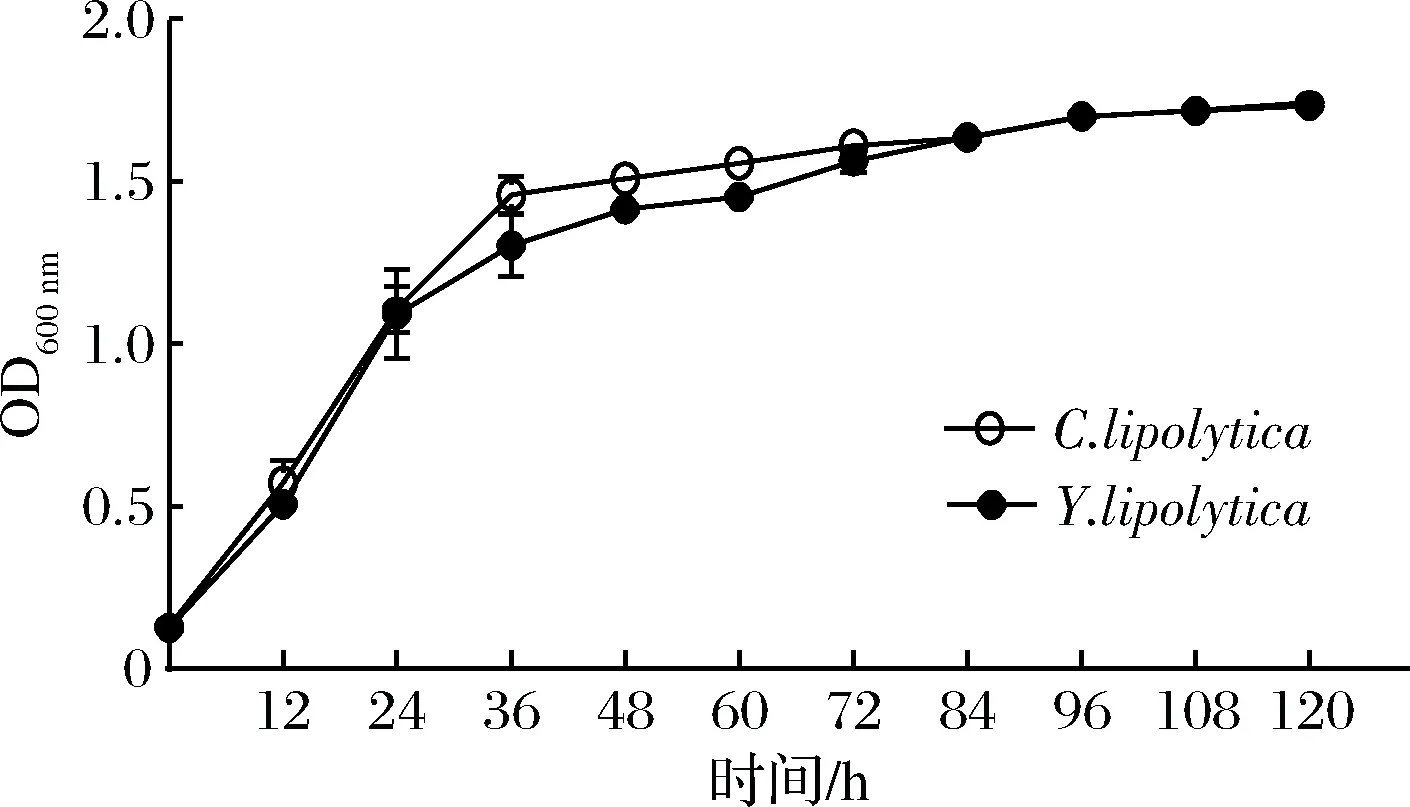
图2 转化培养基中酵母菌株生物量的变化Fig.2 Growth of yeast strain in the fermentation medium
2.2 基因工程菌株的构建
2.2.1 基因工程菌的分子鉴定
构建过表达GDL合成的限速酶酰基辅酶A氧化酶pox2基因的解脂耶氏酵母基因工程菌,获得259株转化子,提取转化子基因组,利用引物对F1/R1通过PCR扩增潮霉素基因片段,PCR产物经琼脂糖凝胶电泳,条带大小与预期相符图3-a。经分子鉴定获得5个解脂耶氏酵母基因工程菌株,编号YL-pox2-10、YL-pox2-11、YL-pox2-12、YL-pox2-13、YL-pox2-136。为了验证转化子同源重组片段的插入位点,利用TAIL-PCR进行鉴定。设计3个特异性嵌套引物与5个简并引物,引物序列(表2),进行3轮PCR,YL-pox2-12工程菌株的TAIL-PCR凝胶电泳结果图3-b,所得到的目的条带切胶回收、测序。结果表明成功构建了解脂耶氏酵母pox2基因过表达菌株。

a-F1/R1引物;b-YL-pox2-12 TAIL-PCR验证结果图3 转化子验证Fig.3 Transformants validation注:a图中:M-Marker;1、2-以野生型基因组为模板的阴性对照;3~7-转化子;b图中1、4、7、10、13-特异性引物SP1分别与简并引物LAD1-LAD5的扩增结果;2、5、8、11、14-特异性引物SP2分别与简并引物LAD1-LAD5的扩增结果;3、6、9、12、15-特异性引物SP3分别与简并引物LAD1-LAD5的扩增结果。
2.2.2 酵母菌株单菌发酵转化生产γ-癸内酯的结果
对Y.lipolyticaG3、C.lipolyticaCICC31223菌株以及获得的5株解脂耶氏酵母pox2基因过表达工程菌,以蓖麻油酸作为底物,进行单菌发酵转化生产GDL的研究。工程菌YL-pox2-10、YL-pox2-11、YL-pox2-12、YL-pox2-13、YL-pox2-136的GDL产量均比出发菌株高,其中YL-pox2-12产量最高,达1.5 g/L,较出发菌株GDL产量提高了2.2倍,差异显著(P<0.05)(图4),结果表明pox2基因的过表达能显著提高GDL转化,显示出该基因的应用潜力。
2.3 解脂耶氏酵母培养条件与混合菌株发酵的适宜条件
2.3.1 通过添加餐厨废弃油脂培养解脂耶氏酵母
为了降低工业化生产GDL的成本以及废物再利用,用餐厨废弃油脂代替完全培养基中的部分葡萄糖和酵母提取物,在不同营养物培养基中培养12 h后,观察酵母积累的变化情况。M6为完全培养基,M4中不含葡萄糖。将M6中的葡萄糖从20 g/L降到12.5 g/L,酵母提取物从10 g/L降到5 g/L得到培养基(M5),此时培养酵母生物量为1.02,比M6中略低。在M5的基础上,添加不同浓度的餐厨废弃油脂(餐厨废弃油脂含量M3 图4 酵母菌株转化蓖麻油酸生产γ-癸内酯Fig.4 Yeast strain transforming ricinoleic acid intoγ-decalactone注:WT-Y.lipolytica G3;CL-C.lipolytica;10-YL-pox2-10;11-YL-pox2-11;12-YL-pox2-12;13-YL-pox2-13;136-YL-pox2-136,是Y.lipolytica过表达pox2基因得到的基因工程菌。*代表差异显著(P<0.05),**代表差异极显著(P<0.05)。下同。 图5 不同培养基对酵母生长的影响Fig.5 Effect of different media on yeast growth 2.3.2 不同酵母菌株的最适接种方式 为了提高解脂耶氏酵母和解脂假丝酵母混菌发酵GDL产量,研究了2株酵母的接种方式。使用混菌发酵转化培养基,以餐厨废弃油脂代替部分葡萄糖、酵母提取物,蓖麻油作为底物,试验设计了A、B、C三种不同的接种方式,结果表明B为最适的接种方式,即先接种解脂假丝酵母,12 h后再接种解脂耶氏酵母YL-pox2-12,能将油脂降解成能被YL-pox2-12利用的脂肪酸,将其转化为GDL,B的GDL产量显著高于其他2种方式(P<0.05)。当同时接种或先接种YL-pox2-12时,转化生产GDL的产量基本相同(图6)。 图6 不同接种方式对混菌发酵生产γ-癸内酯的影响Fig.6 Effect of different inoculation methods on theproduction of γ-decalactone by mixed fermentation 2.3.3 混菌发酵转化蓖麻油生产GDL适宜接种比例的确定 研究表明不同解脂耶氏酵母菌株产生的脂肪酶活性不同,可应用于食品、油脂等工业化生产,但有的不能转化生产GDL[13]。为了充分利用2株酵母各自的优势,将高产GDL工程菌株YL-pox2-12和解脂假丝酵母CICC31223进行混菌培养,通过餐厨废油脂的高效利用,产生生物量较多的解脂耶氏酵母再进行GDL转化。在含餐厨废弃油脂和蓖麻油两种碳源的发酵培养基中,利用混合菌株发酵生产GDL。设置了2种菌3个不同比例的试验梯度,相同菌体浓度的解脂假丝酵母和解脂耶氏酵母菌液体积比为 1∶5、1∶10、1∶20,进行同时接种。结果发现当接菌比例为1∶10时,为最适接种比例,转化废油脂生成GDL的产量为0.15 g/L,而工程菌株YL-pox2-12单独在该发酵转化培养基中的生成GDL的产量为0.08 g/L。因此,混菌发酵效果比单菌好,对混菌比例进行差异显著性分析,1∶5与1∶10这两种比例在P值为0.05水平上,差异显著(图7)。结果表明解脂假丝酵母CICC31223能提高底物废弃油脂的分解效率,也获得了足够量的解脂耶氏酵母生物量进行GDL转化。 图7 不同接种比例对混菌发酵生产γ-癸内酯的影响Fig.7 Effect of different inoculation ratios on the productionof γ-decalactone by mixed fermentation 微生物转化法生产天然GDL面临的主要问题是工业化生产的成本高。这可以通过开发廉价的微生物发酵原料、菌种改造、改进发酵及转化工艺等方面进行改善。 本研究探索利用餐厨废弃油脂作为部分碳源,成功培养解脂耶氏酵母菌株并进行GDL转化生产。采用混合菌株发酵有效利用废弃油脂作为微生物生长的碳源,并转化生产GDL。初步发现混菌发酵的最适条件为:解脂假丝酵母G3∶解脂耶氏酵母CICC31223为1∶10,先接种解脂假丝酵母菌株培养12 h后再接种解脂耶氏酵母。本研究获得pox2基因过表达的解脂耶氏酵母工程菌株YL-pox2-12,摇瓶发酵转化生产GDL产量达 1.5 g/L,是原始菌株的2.2倍,显示出良好的应用前景。


3 结论
