SIRT1在肝癌中的表达及与耐药相关蛋白P-gp、Top-Ⅱα的关系
2019-11-12赫永金许迪锋林祖庆
周 书,许 勇,赫永金,许迪锋,方 良,林祖庆
(杭州市大江东医院 肝胆胃肠血管外科,浙江 杭州 311225)
肝细胞肝癌为世界范围内常见的恶性肿瘤之一,位居世界恶性肿瘤发病率的第5位[1]。多种癌症基因或抑癌基因的异常表达,在肝癌的发生、发展及耐药中起着关键作用[2-3]。沉默信号调节因子1(silent information regulator 1,SIRT1)为新近发现的一类依赖烟碱胺腺嘌呤二核苷酸的第Ⅲ类组蛋白去乙酰化酶[4]。在多种成熟组织中表达,胚胎早期即生殖细胞中含量丰富[5-6]。近年来,SIRT1与肿瘤的关系成为肿瘤学研究的热点问题之一,但在肝细胞肝癌中的作用的相关报道尚不多见。有报道显示[7-8],恶性肿瘤化疗耐药上SIRT1表现出促进、抑制两种现象,我们推测SIRT1的过表达在肝细胞肝癌中的耐药机制中发挥着重要的作用。基于此,本研究通过探讨SIRT1在肝癌组织、细胞中的表达情况,SIRT1过表达与耐药相关蛋白P-糖蛋白(P-gp)、拓扑异构酶Ⅱα(Top-Ⅱα)的相关性,为临床合理用药提供理论指导。
1 材料与方法
1.1 组织标本 40例新鲜肝癌组织及匹配的癌旁组织取自刚切除的手术标本,手术后即刻投入液氮保存。分别取部分新鲜组织分离组织蛋白、制作免疫组化切片。
1.2 主要试剂与仪器 本研究中使用的主要试剂与仪器见表1。

表1 主要试剂与仪器
1.3 实验方法
1.3.1 Western-blot 以研磨法匀浆肝癌组织,加400 μL单混有蛋白酶抑制剂的去污剂裂解液裂解组织,置于冰上操作。裂解30 min后,将裂解液转移至1.5 mL EP管中,4℃ 12 000 rpm/min离心5 min,取上清分装于0.5 mL离心管,-20℃保存。以BCA法检测蛋白浓度。将蛋白样品加10×上样缓冲液,水浴煮沸5 min。以每孔30 μg蛋白的上样量行聚丙烯酰胺凝胶电泳,恒压80 V,溴酚蓝进入分离胶后调整电压为120 V继续电泳,至溴酚蓝迁移至分离胶底部,终止电泳。以4℃,300 mA恒流,70 min,将蛋白转移至PVDF转膜上,丽春红染色观察转膜效果。5%BSA封闭PVDF膜2 h,洗涤后,滴加兔抗SIRT1、P-gp、Top-Ⅱα溶液,4℃过夜孵育。第二天加入TBST洗涤去除多余一抗,与HRP标记的二抗室温孵育2 h。TBST清洗后,加入ECL化学发光底物,在化学发光仪上显影,拍照保存。
1.3.2 免疫组化 (1)固定、脱水、包埋。取组织放入4%多聚甲醛里面固定3~4 h,取适当大小组织放入包埋盒中,进行脱水。打开包埋机,将脱水后的组织连同包埋盒依次放入机器组织槽中,进行包埋。(2)切片、制片。打开切片机,固定蜡块,用力均匀,右手摇动切片,左手用毛笔接片,制片。(3)组织化学染色。60℃干烤2 h脱蜡,二甲苯、梯度酒精、PBS冲洗净残余石蜡。以柠檬酸钠,微波抗原修复,温度控制在96 ℃~98 ℃。然后将切片放入热锅中15 min,最后自然冷却室温。以免疫组化笔圈围住组织,并将切片放入湿盒中,盒中加入少量蒸馏水,滴加3%过氧化氢室温孵育10 min。甩干水分,吸干水珠,加山羊血清封闭液,放入湿盒内,室温10 min。滴加一抗盖住组织,浓度为1∶200,然后放入湿盒内4 ℃过夜。第二天,4度冰箱取出湿盒,室温复温30 min,PBS冲洗,甩干水分,滴加二抗,室温孵育10 min。每张片子滴加50 μL链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min,PBS冲洗净后,100 μL DAB溶液,显微镜下观察3~10 min。染色合适即可终止染色,自来水冲洗。苏木素复染,1~2 min,细胞核变蓝色即可终止,0.5%氨水反蓝,1%盐酸酒精分化3 s,自来水冲洗3 min。梯度酒精脱水,凉干片子后滴加适量中性树胶封片,盖上盖玻片,封片,显微镜下拍照保存。
免疫组化判断标准:阳性显色为不均质棕色颗粒,随机选择5个高倍镜视野,肿瘤细胞染色阳性率≥25%为阳性,阳性染色率<25%为阴性。
1.3.3 细胞培养及蛋白提取 肝癌细胞系SMMC-7721、Bel-7402、MHCC97、HepG2、Huh7均购自中科院上海细胞库。根据中科院上海细胞库说明分别选择DMEM培养基、RPMI 1640培养基,在37℃、含5% CO2的细胞培养箱中培养。细胞密度为整瓶80%~90%时传代。以Western blot检测各细胞株中SIRT1相对表达量,选择相对表达量最高的肝癌细胞株加入使用浓度为98 nmol/L的SIRT1抑制剂,处理48 h后,以M-PER提取细胞总蛋白。
1.4 统计学分析 统计学软件为SAS9.3。计量资料的比较采用两独立样本t检验,计数资料的比较采用卡方检验。连续变量的相关分析采用Pearson相关分析。均以P<0.05为差异有统计学意义。
2 结果
2.1 SIRT1、P-gp、Top-Ⅱα在肝癌中表达情况 免疫组织化学结果显示,SIRT1在40例肿瘤组织中,35例呈阳性表达,阳性表达率87.50%。P-gp在40例肿瘤组织中,33例呈阳性表达,阳性表达率82.50%。Top-Ⅱα在40例肿瘤组织中,8例呈阳性表达,阳性表达率20.00%。肿瘤组织中SIRT1、P-gp阳性表达率显著高于Top-Ⅱα,差异有统计学意义(P<0.05)。见封三图1。
Western blot结果显示,肝癌组织、癌旁组织中SIRT1灰度值分别为1.25±0.24、0.18±0.05; P-gp灰度值分别为1.16±0.23、0.17±0.06;Top-Ⅱα灰度值分别为0.19±0.08、1.12±0.20。肝癌组织中SIRT1、P-gp相对表达量显著高于癌旁组织,肝癌组织中Top-Ⅱα相对表达量显著低于癌旁组织;差异均有统计学意义(P<0.05)。见图1。

图1 肝癌与癌旁组织中SIRT1、P-gp、Top-Ⅱα相对表达量
2.2 SIRT1与P-gp、Top-Ⅱα表达的相关性分析 以Western blot检测的相对表达量数据做相关性分析,SIRT1与P-gp表达量呈正相关(r=0.915,P<0.05),SIRT1与Top-Ⅱα呈负相关(r=-0.906,P<0.05)。见图2。
2.3 SIRT1在肝癌细胞系中表达情况 在肝癌细胞系中,SMMC-7721中SIRT1相对表达量显著高于其他肝癌细胞系,其次为Bel7402,再次为MHCC97,再次为HepG2,最后为Huh7;差异有统计学意义(P<0.05)。见图3。
2.4 SIRT1抑制后P-gp、Top-Ⅱα表达情况 在SMMC-7721细胞中, 加入使用浓度为98 nmol/L的SIRT1抑制剂Selisistat后,SIRT1、P-gp表达量显著下降,Top-Ⅱα表达量显著提高,差异均有统计学意义(P<0.05)。见图4。

图2 SIRT1与P-gp、Top-Ⅱα表达量的相关性
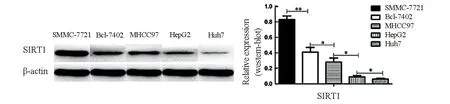
图3 肝癌细胞系中SIRT1相对表达量

图4 SMMC-7721细胞中给予Selisistat处理对P-gp、Top-Ⅱα表达的影响
3 讨论
SIRT1在多种肿瘤的发生、发展过程中有着重要的作用[10-11]。有报道显示[12-14],SIRT1基因在胃癌、前列腺癌、原发性结肠癌、急性髓细胞性白血病中均呈高表达,对多种正常生理性过程有着调节作用,如细胞增殖、炎症反应、ATP生成、胰岛素分泌、尿素循环等[15-16]。研究表明[17],SIRT1可通过去乙酰化修饰组蛋白,去乙酰化P53、FOXO等非组蛋白及DNA损伤修复蛋白等,参与细胞衰老、肿瘤发生。也有报道显示[18],SIRT1在多重耐药(multi-drug resistance, MDR)中具有重要的作用,在化疗耐药的肿瘤细胞中SIRT1表达显著升高。多重耐药为恶性肿瘤化疗中的难点之一,发生机制复杂,临床上逆转途径小,效果不甚理想。目前的研究发现[19],多重耐药主要通过P-gp蛋白/多重耐药-1基因介导的改变药物在细胞内聚集,引起细胞内药物浓度降低、特殊药物靶点缺失,如Top-Ⅱα表达缺失等。基于此,我们推测SIRT1在肝癌中的异常表达可能与多重耐药密切相关。
在肝癌组织中,我们以Western blot及免疫组织化学的方法观察SIRT1的表达量,结果显示,SIRT1在40例肿瘤组织中的阳性表达率显著高于Top-Ⅱα,为Top-Ⅱα阳性表达率的3.38倍。在肝细胞肝癌细胞系中,5株细胞均有不同程度阳性表达。故我们认为,在人肝癌组织中SIRT1总体表达量较正常组织升高,提示SIRT1可能为一种促癌因子。进一步观察肝癌组织中耐药相关蛋白P-gp、Top-Ⅱα的表达情况,结果显示,P-gp阳性表达率显著高于Top-Ⅱα,为Top-Ⅱα阳性表达率的3.13倍。Western blot结果也证实,P-gp相对表达量高于Top-Ⅱα。P-gp为ATP依赖的细胞膜转运体,有MDR1基因编码,可将细胞毒性物质、各种抗肿瘤药物排出细胞[19]。Top-Ⅱα为ATP依赖性酶,存在于各种正常分裂的细胞、肿瘤细胞中,在染色体形成、分离、DNA复制等过程中有着重要的作用[20]。既往的研究表明[21],肿瘤细胞内P-gp含量越高,肿瘤对化疗的敏感性越低,Top-Ⅱα含量越高对Top-Ⅱα抑制剂敏感性越高,Top-Ⅱα表达下降可导致肿瘤对化疗药物的耐受。这与我们检测肿瘤组织中P-gp、Top-Ⅱα的表达结论一致,说明肝癌的耐药机制可能与P-gp、Top-Ⅱα异常表达有关。SIRT1与P-gp、Top-Ⅱα表达量的相关性分析结果表明,SIRT1与P-gp表达量呈正相关,SIRT1与Top-Ⅱα呈负相关。提示SIRT1可能参与了P-gp、Top-Ⅱα的异常表达,影响多重耐药的发生。为验证相关性分析的结果,我们选择在SIRT1表达量最高的SMMC-7721细胞中,给予98 nmol/L的SIRT1特异性抑制剂Selisistat处理,结果显示,处理后SIRT1、P-gp表达量显著下降,Top-Ⅱα表达量显著升高,说明SIRT1可能通过促进P-gp蛋白,降低Top-Ⅱα蛋白表达来促进肝细胞肝癌的多重耐药[22]。
综上所述,SIRT1在肝癌组织中表达量高于癌旁组织,SIRT1高表达与耐药相关蛋白P-gp呈正相关,与Top-Ⅱα呈负相关。SIRT1可能参与肝癌多药耐药发生,可能与调控P-gp、Top-Ⅱα蛋白有关。
