Ag2O/TiO2微球对变异链球菌生物膜形成的影响
2019-11-02黄乔木
黄乔木,吕 中
武汉工程大学环境生态与生物工程学院,湖北 武汉 430205
龋齿是世界上最普遍的慢性传染病之一,它是引起口腔疼痛和牙齿脱落的主要原因[1]。据报道,世界上90%以上的人口一生中至少会患一次此 病[2]。 变 异 链 球 菌(Streptococcus mutans,S.mutans)被认为是主要的致龋细菌。S.mutans重要的毒力因子包括在牙齿表面形成生物膜、产胞外多糖(EPS)和酸[3]。生物膜中的 S.mutans被大量EPS包裹,使药物很难接触到细菌,使其对抗生素等药物的耐受性比浮游态提高1000倍[4]。S.mutans可通过糖酵解途径产生乳酸等有机酸造成牙齿脱矿化[5]。因此,能够抑制浮游细菌生长、生物膜形成和产酸的材料将是一种理想的治龋药物。
在抗生素疗法使细菌对传统抗生素产生抗药性后,具有结构稳定、能够长时间抗菌的无机金属氧化物为龋齿的预防和治疗提供新的策略[6]。同已被广泛应用于牙科临床的ZnO一样,近年TiO2也被嵌入玻璃离子水门汀或树脂中用于探究对口腔细菌的抗菌效果和对牙科材料的改性[7-8]。TiO2对人体的毒性很低,但是TiO2对许多口腔细菌生物膜形成的抑制效果不好[9]。当高浓度的TiO2嵌入牙科材料时,复合牙科材料的机械性能可能会受到影响。Ag2O对许多细菌具有良好的抗菌活性,包括S.mutans[10-12]。Ag2O通过释放Ag+抗菌,但是过多的Ag+对人体细胞具有毒性[13]。此外,单独的Ag2O易发生团聚而使粒径过大,而无机材料的抗菌活性与其尺寸有关,粒径越小,抗菌效果越好[14]。将Ag2O负载在TiO2上,可以有效地减少Ag2O的用量和TiO2的用量,并且在TiO2的影响下,可得到均匀分布在TiO2上的小尺寸Ag2O颗粒[15]。其中Ag2O/TiO2已被证实对金黄色葡萄球菌具有显著的抗菌活性[16]。然而,Ag2O/TiO2对S.mutans的抗菌作用未见报道。本研究采用沉积沉淀法合成Ag2O/TiO2微球,测定其对S.mutans的抗菌作用及对生物膜形成和产酸的影响,以期为在牙科临床上的应用提供理论基础。
1 实验部分
1.1 试剂与仪器
变异链球菌S.mutans UA 159(武汉大学口腔医学院);钛酸四丁酯(TBT)(天津百世有限公司);硝酸银(AgNO3)(阿拉丁试剂有限公司);脑心浸液肉汤培养基(BHI)(Oxoid有限公司);琼脂粉(Biofrox有限公司),厌氧产气袋(三菱瓦斯化学株式会社);2.5 L圆底立式厌氧培养袋(青岛海博生物技术有限公司);结晶紫(天津市天力化学试剂有限公司);其他试剂均为分析纯。
D8 ADVANCE型 X-射线衍射仪(X-ray diffraction,XRD),(德国Bruker公司);JEM-2100透射电子显微镜(transmission electron microscope,TEM),(日本电子株式会社);AGILENT 7700电感耦合等离子质谱仪(inductively coupled plasma mass spectrometry,ICP-MS)(安捷伦科技股份有限公司);722 N紫外可见分光光度计(上海仪电分析仪器有限公司)。
1.2 实验方法
1.2.1 Ag2O/TiO2微球的制备和表征 Ag2O/TiO2微球参照文献[15]的合成法。首先合成TiO2微球:取2mL的TBT溶液逐滴加进60mL的CH3COOH溶液中,超声分散15 min,将溶液转移到聚四氟乙烯反应釜中,150℃反应5h后,用无水乙醇洗涤3次,70℃烘干,研磨得到TiO2微球。Ag2O/TiO2微米复合物(Ag2O与TiO2理论摩尔比为1∶10)制备过程如下:称取0.2 g TiO2微球超声分散在25mL去离子水中,与25mL 20 mmol/L的AgNO3溶液混合搅拌30 min混匀,逐滴加入25mL 0.5mol/L的NaOH溶液,搅拌30 min,用去离子水洗涤5次,室温干燥研磨收集样品。在不添加TiO2微球的情况下,用相同的方法合成Ag2O。
所制得的TiO2,Ag2O和Ag2O/TiO2采用XRD表征,扫描范围为10~80°;利用TEM对TiO2和Ag2O/TiO2微球材料的形貌及粒径进行表征。Ag2O在Ag2O/TiO2中的占比通过ICP-MS确定。
1.2.2 抑菌圈测定 实验方法参见文献[17]。在BHI固体培养基上均匀涂布108CFU/mL S.mutans菌液,贴上无菌滤纸片,分别滴加10mL 1 g/L的TiO2、Ag2O/TiO2以及10mL248mg/LAg2O的磷酸缓冲溶液(PBS)分散溶液,培养皿放入放有厌氧产气袋的厌氧培养袋后,置于37℃恒温培养24h。滴加10mL磷酸缓冲盐溶液(phosphate buffer saline,PBS)的滤纸片设为对照。实验重复3次。
1.2.3 Ag2O/TiO2对浮游状S.mutans的最低抑菌浓度(MIC)测定 实验方法参见文献[18]。离心管中分别加入质量浓度为 16、32、64、125、256、512和1000 mg/L的 TiO2或 16、32和 64 mg/L Ag2O/TiO2以及8、16和32 mg/L的Ag2O分散液,与5×105CFU/mL的菌液混合均匀后在37℃的恒温摇床中培养24h。观察每管的浑浊度,培养液透明的试管所对应的最低样品浓度为最低抑菌浓度(minimum inhibitory concentration,MIC)。仅含菌液的试管设为对照。实验重复做3次。
1.2.4 Ag2O/TiO2对浮游状S.mutans形成生物膜的抑制作用 在24孔板中分别加入31.25、62.5和125 mg/L的Ag2O/TiO2[分散在含质量体积比1%蔗糖的脑心浸液肉汤培养基(brain heart infusion,BHI培养基)],与2×108CFU/mL的菌液混合均匀后在37℃培养24h。移除上层的悬浮培养液,然后向形成的生物膜孔中加入1mL甲醇,固定生物膜15 min后弃去,然后加入质量体积比0.1%结晶紫染色5 min,清洗多余染料后加入二甲基亚砜(dimethyl sulfoxide,DMSO)将生物膜溶解,最后用分光光度计检测570 nm处的吸光度。仅含菌液的孔道设为对照。实验重复3次。
1.2.5 Ag2O/TiO2对浮游状S.mutans形成生物膜过程中产酸的检测 参照实验方法1.2.4作用和培养S.mutans。在培养过程中,用pH计每隔2h测定培养液的pH值。仅含菌液的孔道设为对照。实验重复3次。
1.2.6 Ag2O/TiO2对浮游状S.mutans形成生物膜过程中产EPS的检测 参照实验方法1.2.4作用和培养S.mutans。培养作用完成后,参照文献[19]提取EPS:刮取形成的生物膜在4℃、12000r/m条件下离心10min。所得上清液包含可溶性EPS。沉淀重旋在1mol/L NaOH中,离心,此时的上清液包含不可溶性EPS。使用体积分数95%乙醇沉淀EPS,最后用苯酚-硫酸显色反应对提取的EPS进行定量。仅含菌液的孔道设为对照。实验重复3次。
1.2.7 数据统计分析 采用SPSS 19.0软件对Ag2O/TiO2生物膜形成的结晶紫定量、EPS的产量数据进行单因素方差(One-Way ANOVA)分析,选择Tukey进行事后检验分析。所有试验的显著性水平为0.05。
2 结果与讨论
2.1 Ag2O/TiO2微球的表征
图1是所合成TiO2、Ag2O及Ag2O/TiO2样品的XRD图。其中TiO2样品的衍射峰与锐钛矿型TiO2的标准卡片图谱(JCPDS 4-477)相一致。合成的Ag2O样品的衍射峰也与Ag2O标准卡片图谱(JCPDS 1-1041)的衍射峰相一致,说明成功合成了纯净的Ag2O。Ag2O/TiO2的衍射峰除了能观察到TiO2的衍射峰之外,还能观察到与Ag2O标准卡片图谱(JCPDS 1-1041)相一致的衍射峰,衍射峰没有杂峰,且衍射峰均有较高强度,说明合成的样品为结晶度较高的Ag2O/TiO2。

图1 TiO2,Ag2O和Ag2O/TiO2的XRD图Fig.1 XRD patterns of TiO2,Ag2O and Ag2O/TiO2
图2分别是样品TiO2及Ag2O/TiO2的TEM图。由图2(a)可知,纯的TiO2是由一维纳米棒组成的直径为2~3 mm的微球。从图2(d)中可以看到,在Ag2O/TiO2中,TiO2表面变得粗糙,粒径为 5~10 nm的Ag2O纳米颗粒沿着微球上的纳米棒均匀负载。由ICP-MS数据可知,Ag2O在Ag2O/TiO2中所占质量分数为24.80%。

图 2 TEM 图:(a)TiO2,(c)Ag2O/TiO2,(b)和(d)分别为(a)和(c)中矩形的放大图片Fig.2 TEM images:(a)TiO2,(c)Ag2O/TiO2,(b)and(d)are magnified images of rectangles in(a)and(c)respectively
2.2 Ag2O/TiO2对S.mutans的抗菌活性
图3(a)显示,TiO2和空白组的滤纸片周围没有看到抑菌圈,而Ag2O/TiO2和与Ag2O/TiO2相当量的Ag2O的滤纸片周围有明显的抑菌圈,说明Ag2O和Ag2O/TiO2对S.mutans有抑菌效果,而TiO2对S.mutans没有明显抑菌效果。其中Ag2O/TiO2的抑菌圈大于Ag2O的抑菌圈,说明Ag2O/TiO2的抑菌效果强于Ag2O。由图3(b)可见,TiO2作用的每根离心管培养液浑浊度基本与空白组一致,说明TiO2在质量浓度为1000 mg/L及以下时对S.mutans没有明显抑菌活性;Ag2O/TiO2作用的离心管培养液在质量浓度为64 mg/L时,试管中培养液呈澄清状态,说明 Ag2O/TiO2对S.mutans的MIC为 64 mg/L。Ag2O对S.mutans的MIC为32 mg/L。根据ICP-MS结果可计算,64 mg/L Ag2O/TiO2中的Ag2O质量浓度为15.87 mg/L,而Ag2O的MIC大于这个浓度,说明Ag2O/TiO2对S.mutans的抗菌作用强于相同浓度下的Ag2O。

图3 Ag2O/TiO2对浮游状S.mutans的抗菌活性:(a)抑菌圈,(b)MIC图Fig.3 Antibacterial activity of Ag2O/TiO2against planktonic S.mutans:(a)inhibition zone,(b)MIC images
2.3 Ag2O/TiO2对S.mutans生物膜形成的抑制
图4显示,随着Ag2O/TiO2浓度的升高,生物膜形成量越少。当Ag2O/TiO2质量浓度为125 mg/L时,相比于空白组,生物膜形成量下降61.8%,结果表明Ag2O/TiO2能显著抑制S.mutans生物膜的形成。
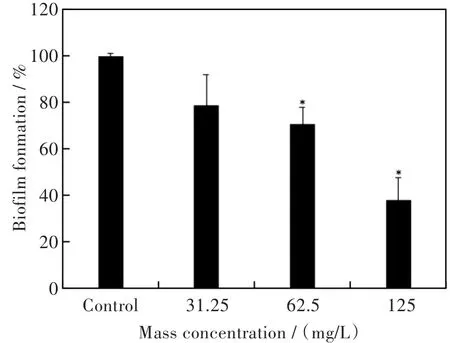
图4 Ag2O/TiO2对S.mutans生物膜形成的抑制Fig.4 Inhibition of Ag2O/TiO2on biofilm formation of S.mutans
2.4 Ag2O/TiO2对S.mutans生物膜形成过程产酸的抑制
图5显示,S.mutans在不受药物作用情况下,培养8h后培养液的pH值会降到4.5;而在Ag2O/TiO2的作用下,培养液中的pH值几乎没有变化,说明Ag2O/TiO2能够显著抑制细菌在生物膜形成过程中的产酸。
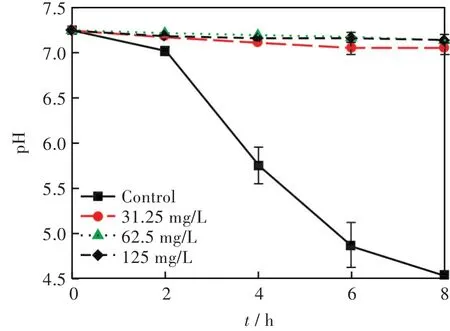
图5 Ag2O/TiO2对S.mutans产酸影响Fig.5 Effects of Ag2O/TiO2on acid production of S.mutans
2.5 Ag2O/TiO2对S.mutans生物膜形成过程产EPS的抑制
图6显示,在Ag2O/TiO2作用下,水可溶性和水不可溶性EPS的产量都显著下降。当Ag2O/TiO2质量浓度为125 mg/L时,水可溶性和水不可溶性EPS产量相比于空白组分别下降了56.14%和69.95%,结果表明Ag2O/TiO2能显著地抑制细菌EPS的产生。

图6 Ag2O/TiO2对S.mutans生物膜形成过程产EPS影响Fig.6 Effects of Ag2O/TiO2on production of EPS during the biofilm formation of S.mutans
3 结 语
通过沉积沉淀法合成的Ag2O/TiO2微球对口腔致龋细菌S.mutans有显著的抗菌活性,并能够抑制其生物膜的形成及该过程中的产酸和EPS。由于Ag2O/TiO2具有较好稳定性,未来可将Ag2O/TiO2掺杂进牙科材料中探索其在牙科临床实际应用可行性。
