瑞舒伐他汀钙固体分散颗粒溶出度测定方法的建立
2019-10-30黄河倩徐俊陈欢曹丹婧肖李钱
黄河倩 徐俊 陈欢 曹丹婧 肖李钱
[摘要] 目的 建立瑞舒伐他汀钙固体分散体颗粒溶出度的测定方法。 方法 运用固体分散体技术制备瑞舒伐他汀钙固体分散体颗粒,采用紫外分光光度法测定其溶出度,紫外检测波长为241 nm,并进行方法学考察,主要包括考察精密度、稳定性以及重现性、回收率。 结果 在6.0~22.0 mg/L,瑞舒伐他汀钙浓度与吸光度的线性关系良好,线性回归方程为Y=0.032X+0.0292(r = 0.999 95),平均回收率为99.77%,RSD为0.94%,重现性的RSD为0.33%,溶出度达到90%以上。 结论 本方法可用于瑞舒伐他汀钙固体分散颗粒溶出度的测定。
[关键词] 瑞托伐他汀钙;溶出度;固体分散体;颗粒;紫外分光光度法
[中图分类号] R927.2 [文献标识码] A [文章编号] 1673-7210(2019)08(a)-0038-04
[Abstract] Objective To establish a method for the determination of dissolution rate of Rosuvastatin Calcium Solid Dispersion Granules. Methods Rosuvastatin Calcium Solid Dispersion Granules were prepared by solid dispersion technology. The dissolution rate was determined by ultraviolet spectrophotometry. The ultraviolet detection wavelength was 241 nm. Methodological investigation was carried out, including precision, stability, reproducibility and recovery. Results At 6.0-22.0 mg/L, the linear relationship between the concentration of Rosuvastatin Calcium and absorbance was good. The linear regression equation was Y=0.032X+0.0292 (r = 0.999 95). The average recovery rate was 99.77%, RSD was 0.94%, RSD was 0.33% and the dissolution rate was over 90%. Conclusion This method can be used to determine the dissolution of Rosuvastatin Calcium Solid Dispersion Granules.
[Key words] Rosuvastatin calcium; Dissolution; Solid dispersion; Granule; Ultraviolet spectrophotometry
高脂血癥又称为高脂蛋白血症,作为目前常患的全身性疾病,其是由于脂肪代谢异常造成脂质高于正常水平而导致的,长期发展可加速患者的全身动脉粥样硬化病变[1],他汀类药物是高脂血症调节的首选药物。而瑞舒伐他汀作为第三代他汀类代表药物,由英国阿斯利康Astra Zeneca公司原研,2003年在加拿大批准上市,商品名定为可定;该年8月经美国食品和药物管理局(AFDA)审核批准上市[2]。瑞舒伐他汀作为还原酶抑制剂,被称为3-羟基-3-甲基戊二酰辅酶A(HMG-CoA),和其他他汀类药物相比,其调节血脂能力更佳,逆转动脉粥样硬化能力更好,还可消减或减退斑块,降低心血管病发率等[3-5]。瑞舒伐他汀钙作为目前较新的他汀类药物,其国内制剂产品的市场规模突破60亿元。而药物制剂的种类除了常用的片剂、胶囊剂以及液体制剂外,各种新剂型层出不穷,如微囊剂[6-7]、透皮给药控释剂[8-9]、脂质体[10-11]以及磁性给药剂[12-13]等,固体分散体作为药物制剂技术中的新剂型之一,这类速效制剂可以使药物高度分散在载体中,增加难溶药物的溶解度和溶出速率,提高生物利用度[14-21]。因此,瑞舒伐他汀钙固体分散体溶出度的质量控制尤为重要,在既往研究[22-25]的基础上,本研究建立了紫外分光光度法测定瑞舒伐他汀钙固体分散体颗粒的溶出度,为质量控制提供参考。
1 仪器与试药
1.1 仪器
UV-1800PC-DS2型紫外分光光度计(上海美谱达仪器有限公司);RC-8DS型溶出度测试仪(天津市拓普仪器有限公司);BSA224S型电子天平[规格210 g×0.1 mg,赛多利斯科学仪器(北京)有限公司];BSA124S-CW型电子天平(规格120 g×0.01 mg,德国赛多利斯公司);RE5299型水浴型旋转蒸发仪(上海亚荣生化仪器厂);GHG9240A型电热恒温鼓风干燥箱(太仓精密仪器设备有限公司);KQ-50E型超声波仪(昆山市仪器有限公司);13 mm×0.45 μm型水系针式样品过滤器(上海楚定分析仪器有限公司);BKH-C型玻璃仪器快速烘干器(郑州长城科工贸有限公司)。
1.2 试药
瑞舒伐他汀钙对照品(批号:101028-201202,含量>97%,中国食品药品检定研究院);羟丙甲纤维素(批号:170212,I型,粘度30 mPa·s,安徽山河药用辅料有限公司);共聚维酮(批号:20150901,S630,上海昌为医药辅料技术有限公司);乳糖(批号:20170101,BR,含量≥99%,上海晶纳试剂有限公司);麦芽糖醇(批号:20160513,含量为95%;上海沃凯化学试剂有限公司);淀粉(批号:161209,含量≥99%,上海沪试试剂有限公司);聚乙烯吡咯烷酮(批号:20160101,含量≥99%,上海润捷化学试剂有限公司);十八酸镁(批号:20170301,含量≥95%,上海沪试试剂有限公司);滑石粉(批号:170916,含量≥99%,商丘市亮峰卫生用品有限公司);纯化水:自制。
瑞舒伐他汀钙固体分散颗粒:自制。制备方法:称取1.0 g瑞舒伐他汀钙,溶解于二氯甲烷液,另称取共聚维酮2.0 g、羟丙甲纤维素4.0 g,边搅拌边加入含有瑞舒伐他汀钙的二氯甲烷溶液中;转入水浴型旋转蒸发仪中,设置30℃温度进行旋蒸,去除溶剂二氯甲烷,取出瑞舒伐他汀钙固体分散体。称取辅料乳糖0.5 g、麦芽糖醇1.0 g、淀粉12 g,于研钵中分别研细,称取瑞舒伐他汀钙固体分散体1.0 g,用等量递增法进行混合。另取聚乙烯吡咯烷酮0.3 g、十八酸镁0.02 g、滑石粉0.02 g,加入混合好的原辅料,边混合边加入少量纯化水,制成软材后以40目筛筛过,所得湿颗粒产物均匀平铺在不锈钢盘中,50℃温度下于恒温干燥箱中保温干燥20 min,过筛整粒,得到瑞舒伐他汀钙固体分散体颗粒。
2 方法与结果
2.1 溶液制备
2.1.1 对照品溶液配制 取瑞舒伐他汀钙对照品1.0 mg,置于100 mL量瓶,加入80 mL纯化水,超声波仪超声15 min溶解,定容,摇匀,备用。
2.1.2 供试品溶液配制 称取一定量自制的瑞舒伐他汀钙固体分散体颗粒,按对照品溶液配制方法配制供试品溶液。
2.1.3 空白辅料溶液配制 另取按处方比例配制的不含瑞舒伐他汀钙的瑞舒伐他汀钙固体分散体颗粒的空白辅料0.5 mg,置于50 mL量瓶,加纯化水适量,超声15 min溶解,0.45 μm水相滤膜过滤,取少量滤液,加纯化水稀释定容于10 mL容量瓶中,摇匀,即得空白辅料溶液。
2.2 检测波长
在200~400 nm波长范围内,依据紫外分光光度计操作流程对对照品溶液进行全波长扫描,发现最大吸收波长在241 nm处;辅料在241 nm波长处测定无影响。故确定瑞舒伐他汀钙固体分散体颗粒的检测波长为241 nm。
2.3 标准曲线绘制
取瑞舒伐他汀钙对照品10.0 mg,精密称定,置100 mL容量瓶,其余按“2.1.2”项下制备方法制备对照品储备液。依次精密量取对照品储备液0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2 mL,分别置于10 mL容量瓶,以纯化水定容,摇匀,于241 nm波长下测定其吸光度,以瑞舒伐他汀钙浓度为横坐标(X),以其对应吸光度为纵坐标(Y)绘制标准曲线,得到线性回归方程Y=0.032X+0.0292(r = 0.99 995)。瑞舒伐他汀钙浓度在6.0~22.0 mg/L与吸光度线性关系良好。见图1。
2.4 精密度和稳定性试验
2.4.1 精密度试验 根据2015年版《中华人民共和国药典》(三部)(以下简称“《中国药典》”)中的技术指南(9101药品质量标准分析方法验证指导原则)可以得知,精密度和稳定性试验的RSD可接受范围为≤6.0%。
分别取低、中、高3种不同浓度的对照品溶液,测定溶液日内和日间的吸光度,重复测定每个溶液3次,计算日内精密度和日间精密度。低、中、高3种不同浓度的日内和日间精密度RSD均<1.0%,均符合相关要求。见表1。
2.4.2 稳定性试验 取瑞舒伐他汀钙固体分散体颗粒适量,按“2.1.2”供试品溶液的制备项下方法处理,分别制成浓度为12 mg/L的供试品溶液A和浓度为18 mg/L的供试品溶液B,分别在0、1、2、4、6 h于241 nm波长处测定其吸光度。其中A供试品溶液的RSD为0.36%,B供试品溶液的RSD为0.31%,两种不同浓度瑞舒伐他汀钙溶液测得吸光度数值的RSD均<1%,。表明瑞舒伐他汀钙溶液在6 h内稳定性良好。
2.5 重现性试验
称取一定量瑞舒伐他汀钙固体分散体颗粒,共6份,分别按“2.1.2”供试品溶液的制备项下方法处理,制成10.0 mg/L浓度的供试品溶液,于241 nm波长处测定吸光度,其RSD为0.33%。表明该方法的重现性良好。见表2。
2.6 回收率试验
取已知含量的瑞舒伐他汀钙固体分散体颗粒约1 g共9份,分别精密称定,再分别加入高、中、低浓度的瑞舒伐他汀钙对照品,按“2.1.2”供试品溶液的制备项下方法处理,于241 nm波长处测定,平均加样回收率为99.77%,RSD为0.94%。表明该方法测定瑞舒伐他汀钙的含量回收率高,准确性好。见表3。
2.7 溶出度的测定
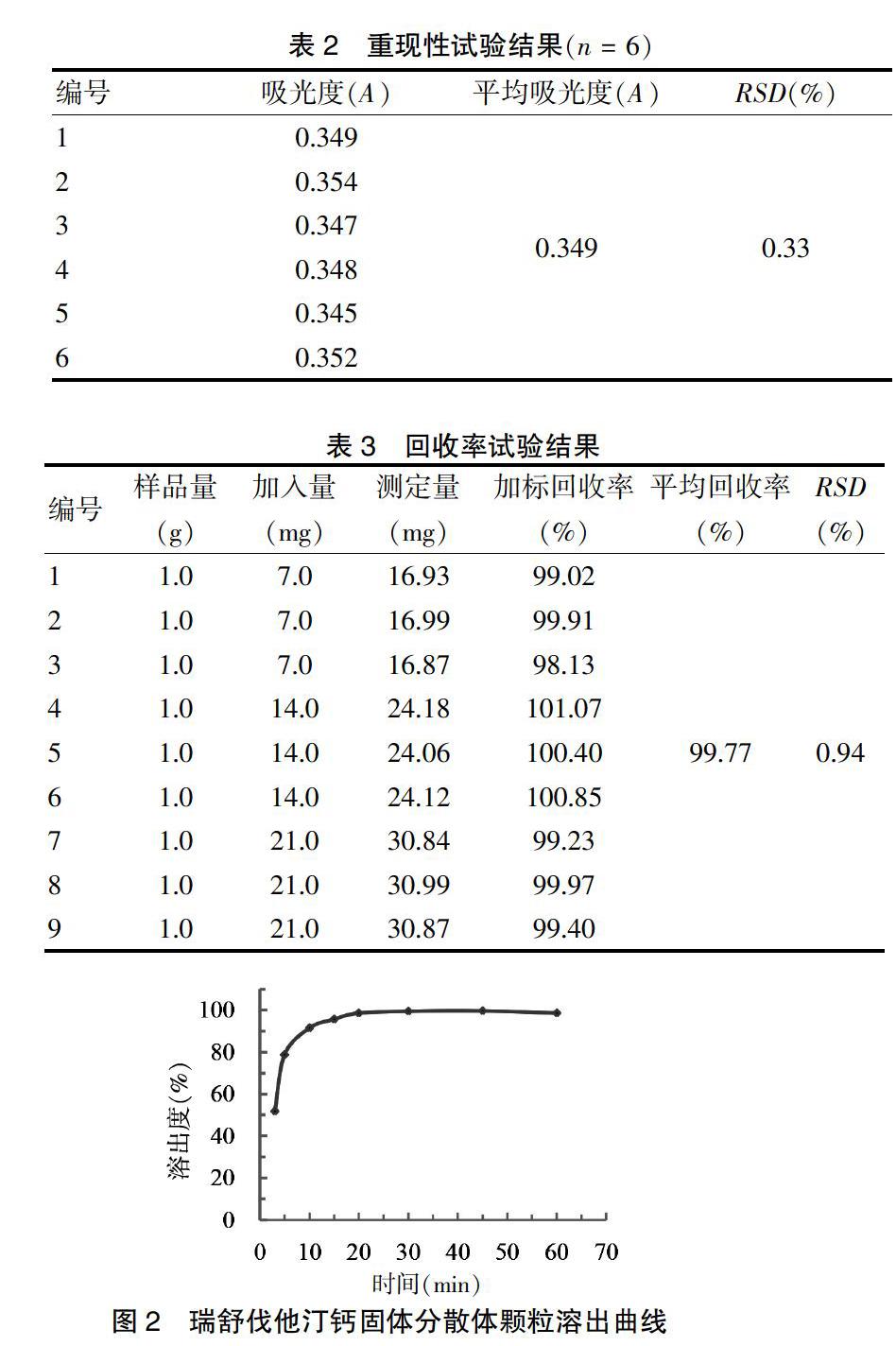
精密称取瑞舒伐他汀钙固体分散体颗粒适量(相当于瑞舒伐他汀钙20 mg),参照2015年版《中国药典》(四部)中的方法(通则0931第二法),溶出测试仪参数设定:溶出液温度为(37.0±0.5)℃,桨法转动速度为50 r/min,依法操作。于3、5、10、15、20、30、45、60 min分别抽取溶出液5 mL(同时在溶出杯中补充5 mL同溫空白介质保持体积不变),用水系针式样品过滤器(0.45 μm)过滤,其续滤液,于241 nm波长处测定吸光度,计算并绘制溶出曲线。
选择以纯化水为溶出介质,瑞舒伐他汀钙的溶出度效果良好,其溶出度随时间的变化曲线见图2。取6袋瑞舒伐他汀钙固体分散体颗粒,依据上述溶出度测定方法重复测定6次,测定结果显示,各平行点测试的RSD均<2.0%。采用紫外分光光度法测定瑞舒伐他汀钙固体分散颗粒溶出度时,溶出10 min后的溶出量均>90%,即较短的时间内即可达到较高溶出量,提示瑞舒伐他汀钙固体分散颗粒溶出效果好。
3 讨论
溶出度作为制剂药物最重要的检测项目之一,根据溶出度试验判断、筛选处方、验证结果是药物制剂工艺设计、改进常用的方法。本研究制备了瑞舒伐他汀钙固体分散颗粒,考察了采用紫外分光光度法进行瑞舒伐他汀钙固体分散体颗粒溶出度的检测方法,并对检测波长、标准曲线、回收率、精密度和稳定性以及重现性进行了考察。此外,本研究还考察了以0.1 mol/L盐酸溶液和一定pH值的醋酸缓冲溶液为溶出介质,瑞舒伐他汀钙溶出情况均不太理想,最终优化确定以纯化水作为溶出介质。选择纯化水作为溶出介质,成本低廉,溶出效果佳,重现性好,体外溶出的试验显示瑞舒伐他汀钙固体分散体颗粒溶出效果好,固体分散体技术能够改进药物的溶解性,提高药物的治疗效果。
作为先进的制剂技术之一,固体分散技术从1961年由日本科学家Sekiguchi和Obi提出用尿素为载体运用热熔法制备固体分散体以来,至今已经发展到以表面活性剂为载体材料的第三代新技术。传统的溶剂法、熔融法等在速释、缓(控)释以及肠溶等固体分散体制备上已经成熟,药物溶出性大大提高。而各种新技术技术如超临界流体技术、喷雾冷冻干燥技术以及高速静电纺丝技术也越来越多应用于固体分散体的制备中。运用静电纺丝技术制备固体分散体,固体分散体的粒径可以达到纳米级,比表面积增大,増溶效果佳。将超临界流体技术和喷雾冷冻干燥技术等用于制备固体分散体,如联苯双酯、非诺贝特和丹参酮等目标药物,都呈现出不同的特点。应用固体分散体技术制备固体分散体,除了关注提高药物的溶出度外,应从源头上关注瑞舒伐他汀钙固体分散体的体内动力学及生物利用度,关注保持固体分散体长期稳定性、在胃肠道的溶解度、对胃肠道的刺激性等不良反应以及固体分散体老化问题等,为固体分散体技术制备提供更好的参考。
[参考文献]
[1] 樊国兵.瑞舒伐他汀钙与阿托伐他汀钙治疗高脂血症合并高血压的临床疗效观察[J].医学理论与实践,2016,29(10):1311-1312.
[2] 潘启娇.瑞舒伐他汀钙的合成研究[D].杭州:浙江大学,2017.
[3] 郭涛,孙莹,张辉,等.比较瑞舒伐他汀钙与阿托伐他汀钙治疗高脂血症合并高血压的疗效[J].中国现代药物应用,2016,10(10):121-122.
[4] 王万民.瑞舒伐他汀钙片联合蒲参胶囊治疗高脂血症的临床效果[J].中国医药科学,2015,5(13):67-69.
[5] 刘建军.瑞舒伐他汀钙片的制备与质量考察评价[J].哈尔滨商业大学学报:自然科学版,2017,33(4):399-402.
[6] 邢向英,李玉宽,董庆霖,等.虾青素微胶囊制备工艺的研究[J].化学工程,2018,46(1):7-11.
[7] 杨辉,高红芳.反溶剂法制备肉桂醛/乙基纤维素微胶囊及其表征[J].高分子材料科学与工程,2017,33(7):121-125.
[8] 吴素香,闫冉,石森林,等.桂枝茯苓透皮贴剂的制备[J].中成药,2018,40(3):571-577.
[9] 牟健,陈艳.罗格列酮透皮贴剂的制备及处方优化[J].中国医药工业杂志,2017,48(1):60-62.
[10] 李洋,王秀丽.新乌头碱脂质体制备工艺的研究[J].北京中医药大学学报,2018,41(3):216-221.
[11] 余荧蓝,郑智元,伊宸辰,等.青蒿素长循环脂质体的制备及体外性质评价[J].药学学报,2018,53(6):1002-1008.
[12] 桂铮,于耀宇,汪子文,等.纳米磁性药物载体的制备及其物理性能[J].中华实验外科杂志,2018,35(4):687-688.
[13] 李珍珍,张其翼,黄华莹,等.近红外荧光磁性复合载药脂质体的制备及应用[J].材料导报,2017,31(1):1-7.
[14] 曾佳,普天磊,黄婷,等.孕二烯酮固体分散体微丸的工艺研究[J].生殖与避孕,2017,37(1):39-45.
[15] 鄢寒,黄月英,沈一唯,等.无定型固体分散体载体及制备技术研究进展[J].中国新药杂志,2017,26(4):427-432.
[16] 赵玲.甲氧苄啶固体分散体及其片剂制备与性质研究[D].开封:河南大学,2016.
[17] 洪子越,施沈一,郭玉申,等.伊曲康唑无定型固体分散体的制备及体外评价[J].中国药科大学学报,2018,49(2):187-194.
[18] 谭佳威,孙如煜,曾滟棱,等.固体分散技术在制剂领域的研究进展[J].药物评价研究,2017,40(8):1182-1188.
[19] 赵志全,吴奎伟,王震.一种瑞舒伐他汀钙分散片:中国,CN104434826B[P].2018-03-20.
[20] 王翼,王华,徐伟,等.卡马西平固体分散体及其片剂的制备[J].中国新药杂志,2017,26(3):318-322.
[21] 徐俊,闫启东.佐米曲坦缓释及速释固体分散体的制备工艺研究[J].中国医药导报,2017,14(1):16-19.
[22] 侯娟,徐琪琳,张瑞杰.不同厂家瑞舒伐他汀钙片溶出度比较[J].河北医药,2015,37(20):3180-3182.
[23] 梅梅,张淼,李煜.辛伐他汀片溶出曲线相似性评价及有区分力溶出度检测方法的研究[J].中国现代应用药学,2018,35(6):816-819.
[24] 王权,徐俊,高菲勒,等.阿托伐他汀钙固体分散体颗粒溶出度的测定[J].现代医药卫生,2013,29(8):1164-1165.
[25] 徐俊,闫启东,石雷.琥珀酸舒马曲坦固体分散体颗粒溶出度的测定[J].应用化工,2016,45(5):972-974.
(收稿日期:2019-01-18 本文編辑:王 蕾)
