茂原链霉菌谷氨酰胺转氨酶合成与菌体形态分化的关系
2019-10-29李洪波王淑梅张莉丽
薛 慧,付 玲,李洪波,王淑梅,刘 宁,张莉丽,*
(1.黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007;2.东北农业大学食品学院,黑龙江 哈尔滨 150030;3.天津科技大学食品工程与生物技术学院,天津 300457;4.哈尔滨学院食品工程学院,黑龙江 哈尔滨 150086)
链霉菌是革兰氏阳性、多细胞、丝状土壤细菌[1]。具有复杂的形态分化周期,包括孢子萌发产生分枝状的基质菌丝,基质菌丝再发育成气生菌丝和孢子[2]。除独特的形态分化外,链霉菌另一个显著特征是能够产生广泛的、具有重要价值的次级代谢产物。目前,国内外许多研究都已证实,链霉菌复杂的形态分化与丰富的次级代谢产物和某些酶的合成之间有着密切的联系[3-4]。
谷氨酰胺转氨酶(transglutaminase,TGase,EC 2.3.2.13)是茂原链霉菌(Streptomyces mobaraensis)生长分化过程中分泌的一种重要酶,它能催化蛋白质分子内和分子间发生交联,也可以使蛋白质和氨基酸连接,还可以水解蛋白质分子内的谷氨酰胺基,从而改变蛋白质本身及其所附着的细胞和组织等的结构和功能,提高蛋白质的营养价值[5]。基于上述特性TGase在食品工业[6]、生物医药[7]和纺织业[8]等领域发挥着重要作用。TGase广泛存在于人类、动植物和微生物[9-13]机体组织中,是生物体进行生命活动所需的一类非常重要的酶。其中关于人体内TGase的生理功能研究最为深入,其作用包括凝血、伤口愈合、细胞凋亡、细胞分化和细胞间通信等[14]。
目前商品化的TGase主要来源于链霉菌发酵生产,有关研究多集中于发酵条件优化、筛选高产菌株以及利用基因工程技术对菌体进行改造以提高TGase产量,但效果不尽理想。而有关链霉菌合成TGase的生理功能研究却鲜有报道,因此没有建立起有效提高TGase产量的诱导策略。基于此,本研究以S. mobaraensis为出发菌株,借助激光共聚焦显微镜和扫描电镜观察TGase合成与菌体生存活力和形态分化的关系,进而揭示链霉菌TGase的生理功能,为提高TGase发酵生产水平提供新思路。
1 材料与方法
1.1 材料与试剂
茂原链霉菌DSM40587 日本NBRC公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、CBZ-Gln-Gly、L-谷氨酸-γ-单氧肟酸 美国Sigma公司;LIVE/DEAD Bac-Light bacterial viability kit试剂盒L-13152美国Invitrogen公司;其他试剂为国产分析纯。
斜面培养基:高氏一号培养基;种子培养基:聚蛋白胨20 g/L,可溶性淀粉20 g/L,磷酸氢二钾2 g/L,磷酸二氢钾2 g/L,酵母粉2 g/L,无水硫酸镁2 g/L,pH 7.0;发酵培养基:聚蛋白胨30 g/L,可溶性淀粉10 g/L,果糖10 g/L,磷酸氢二钾2 g/L,酵母粉2 g/L,无水硫酸镁1 g/L,氯化镁25 g/L,pH 7.0。
1.2 仪器与设备
激光共聚焦显微镜 德国徕卡公司;扫描电镜日本日立公司;恒温振荡培养箱 上海智城公司;高压灭菌锅 厦门致微公司。
1.3 方法
1.3.1 菌体培养
用5 mL无菌生理盐水将培养7 d的斜面孢子洗下,接种于100 mL种子培养基中,30 ℃、200 r/min培养48 h后,按15%的接种量添加到发酵培养基中,30 ℃、200 r/min培养。
空白组按上述操作培养发酵120 h。实验组分别在发酵0、24、48 h和72 h时,向培养瓶内加入0.5 mol/L经膜过滤的金属蛋白酶抑制剂EDTA溶液,使EDTA的终浓度为1 mmol/L,继续培养发酵至120 h。分别以0 h-EDTA、24 h-EDTA、48 h-EDTA和72 h-EDTA代表0、24、48 h和72 h添加EDTA实验组。
1.3.2 菌体细胞生长量测定
将50 mL发酵液过滤后,用蒸馏水洗滤纸上菌体3 次,105 ℃干燥至质量恒定后称量[15]。
1.3.3 TGase活力测定
采用分光光度法[16]进行测定。
1.3.4 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
SDS-PAGE采用5%的浓缩胶,电泳条件为80 V,30 min;12.5%的分离胶,电泳条件为120 V,1 h。
1.3.5 激光共聚焦显微镜观察链霉菌菌体生存活力变化
菌体生存活力分析参照Fernandez等[17-18]方法。1 mL培养物12 000×g离心15 min,用水洗菌体2 次后,将菌体悬浮于水中。样品与等体积LIVE/DEAD Bac-Light bacterial viability kit染色液混合,旋涡振荡,室温避光放置5~10 min。将20 μL混合液涂在载玻片上,用激光共聚焦显微镜观察。发射波长为488 nm和568 nm,吸收波长为530 nm和630 nm。得到的两个图像用Leica Confocal Software重叠得到菌体在发酵过程中激光共聚焦显微图像。
参照Gavet等[19]的方法,利用Image J软件将红、绿荧光强度转化为灰度值,从而对菌体的生存活力进行定量分析,计算公式如下:

1.3.6 扫描电镜观察链霉菌形态学变化
参照Yuan等[20]的方法制备待观察菌体样本后,利用导电胶带将冻干菌粉粘在样品台上,然后采用离子溅射的方法在样品表面镀上一层厚度约100~150 Å的金膜,最后借助扫描电镜对菌体形态进行观察。
1.4 数据处理与统计分析
所有实验均重复3 次,每次2 个平行。计算菌体生存活力时,每个时间点选取15 个单独的菌球体进行分析测定。实验结果表示为。采用SPSS 15.0软件对实验数据进行统计学分析。2 组数据间的比较采用独立样本t检验进行分析,3 组或多于3 组数据间的比较采用单因素方差分析的Duncan法进行两两比较分析,P<0.05,差异显著。
2 结果与分析
2.1 S. mobaraensis菌体生长周期和产酶变化
按照1.3.1节方法培养S. mobaraensis,每24 h取一次样,测定菌体干质量,绘制菌体生长曲线。如图1所示,对照组中S. mobaraensis经过24 h的适应期后,菌体迅速生长进入对数期,96 h后生长缓慢进入稳定期。各实验组的生长趋势与对照组相似,EDTA没有影响菌体正常生长。

图1 对照组和实验组生物量变化曲线Fig. 1 Changes in biomass in the control and experimental groups

图2 对照组和实验组TGase活力变化曲线Fig. 2 Changes in TGase activity in the control and experimental groups
从图2可以看出,对照组在适应期时,发酵液中TGase活力处于较低水平;之后随着生物量的增加,TGase活力也逐渐升高;发酵到96 h TGase活力达到最大为3.14 U/mL;随着菌体生长进入稳定期,TGase产量也开始下降。对照组不同时间点的发酵上清液SDS-PAGE分析表明(图3a),发酵初期S. mobaraensis主要以无活性的酶原(Pro-TGase)的形式分泌到胞外;随着发酵的进行,Pro-TGase逐渐转化为成熟的TGase;发酵到120 h,Pro-TGase几乎全部转化为TGase。实验组自添加EDTA,发酵上清液中的TGase活力就不再升高或升高缓慢(图2)。各实验组的SDS-PAGE分析与酶活力测定结果一致(图3),EDTA添加时间越早,对TGase产量的影响越大;即使72 h添加EDTA,直至发酵结束Pro-TGase也没有完全转化为TGase。上述实验结果表明,添加EDTA不影响S. mobaraensis菌体生长,但能够显著抑制TGase活性。
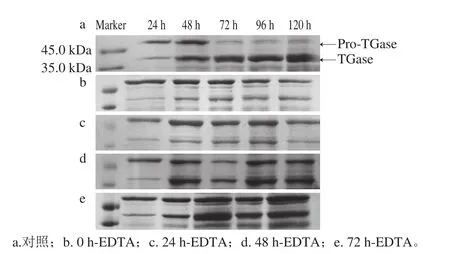
图3 对照组和实验组发酵上清液SDS-PAGE分析图Fig. 3 SDS-PAGE analysis of centrifugal culture supernatant in the control and experimental groups
2.2 发酵过程中S. mobaraensis菌体生存活力变化


图4 对照组S. mobaraensis菌体在发酵过程中激光共聚焦显微图像Fig. 4 CLSM analysis of the development-linked cell death process of S. mobaraensis in the control group
图4 表明对照组菌体在发酵过程中的生存活力变化,可以观察到发酵过程中菌体呈放射状菌球体生长。发酵到第24小时,菌球体中心出现死亡现象,外部围绕的活力菌丝中夹杂着红色的死亡菌丝(图4b);随着发酵时间的延长,菌球体中心红色区域逐渐扩散(图4d、e),而外部菌丝逐渐恢复活力(图4c、f),发酵到第72小时的菌球体局部放大图片(图4f)显示,菌球体外部几乎全部由活力菌丝构成,只在边缘观察到少数死亡菌丝;随后菌球体活力再次下降(图4g、j),第96小时和第120小时菌球体局部放大图片也显 示红色菌丝数量逐渐增加。

图5 0 h-EDTA实验组S. mobaraensis菌体在发酵过程中激光共聚焦显微图像Fig. 5 CLSM analysis of the development-linked cell death process of S. mobaraensis in the 0 h-EDTA group
0 h-EDTA实验组S. mobaraensis的菌体活力变化见图5。与对照组中菌体生长状态相同,发酵开始时菌体呈现出放射状的小球体。第24小时菌球体中心的菌丝也开始死亡(图5a),外部菌丝具有较高的活力(图5b),只能观察到少数死亡菌丝;但是与对照组不同的是,随着发酵时间的延长,菌球体并没有出现活力恢复的现象(图5d、e、g、j),发酵至第120小时,菌体内部和外部几乎全部死亡,局部放大图片也显示红色菌丝数量逐渐增多(图5c、f、h、i)。其余3 组EDTA实验组也出现随着发酵的进行菌体逐渐死亡现象(数据未给出)。
参照1.3.5节方法定量分析菌体生存活力,结果如图6所示。对照组随着生物量和TGase产量的升高,菌体生存活力也逐渐升高,发酵至第72小时菌体生存活力达到最大;随后生物量和TGase产量继续升高,菌体生存活力呈下降趋势。实验组菌体生存活力与TGase产量变化趋势相一致,从加入EDTA时,菌体生存活力不再升高。结果表明,TGase有助于保持S. mobaraensis菌体生存活力,抑制TGase活性导致S. mobaraensis菌体生存活力下降。

图6 对照组和实验组中S. mobaraensis菌体生存活力变化曲线Fig. 6 Changes in viability of S. mobaraensis in the and experimental groups
2.3 发酵过程中S. mobaraensis菌体形态变化
扫描电镜图像(图7)表明对照组菌体在发酵过程中的菌体形态变化。发酵至第24小时,菌体呈现弯曲状态,菌丝表面能观察到细小的淀粉样颗粒(图7a);第48小时芽突开始大量萌发,淀粉样颗粒增多(图7b);第72小时芽突进一步生长成小的分枝菌丝(图7c);第96小时菌丝体表面淀粉样加剧,颗粒间相互连接形成疏松的网状结构(图7d);第120小时更多的淀粉样颗粒附着于菌体表面,形成较为致密的呈褶皱状的膜(图7e)。
与对照组复杂的形态分化相比,0 h-EDTA实验组的扫描电镜图(图8)显示该实验组的菌体形态分化单一。发酵第24小时菌丝平直且表面光滑(图8a);第72小时才萌发出少量芽突(图8c);直至发酵结束也未观察到有淀粉样(图8e)。其余3 组EDTA实验组也都出现了菌体形态分化滞后的现象(数据未给出)。

图7 对照组S. mobaraensis菌丝在发酵过程中变化的扫描电镜图Fig. 7 SEM analysis of mycelial differentiation of S. mobaraensis in the control group

图8 0 h-EDTA实验组中S. mobaraensis菌丝在发酵过程中变化的扫描电镜图Fig. 8 SEM analysis of mycelial differentiation of S. mobaraensis in the experimental group with EDTA addition at 0 h of culture
上述实验结果表明TGase合成能够促进S. mobaraensis形态分化,抑制TGase合成后S. mobaraensis形态单一,分化滞后。
3 讨 论
S. mobaraensis合成TGase的过程复杂而严谨,Zotzel等[21-22]就S. mobaraensis产TGase的活化机制进行一系列研究,结果发现S. mobaraensis为避免TGase在胞内发生不可控制的交联作用,以Pro-TGase形式分泌到胞外,先经金属蛋白酶(transglutaminase-activating metalloprotease;TAMEP)水解作用去掉41 个氨基酸形成中间体FRAP-TGase,然后再通过丝氨酸蛋白酶(tripeptidyl aminopeptidase;TAP)作用生成最终产物TGase。TAMEP是一种Zn金属蛋白酶,本研究向含有MgCl2的发酵培养基中添加EDTA,在中性pH值发酵条件下,EDTA不与Mg2+螯合,而与蛋白酶上的Zn2+螯合[23]。结果发现,EDTA的添加没有显著影响菌体的生物量,但TGase的活力由添加EDTA时起不再升高。这表明,EDTA的添加抑制了TAMEP活性,阻止Pro-TGase向成熟的TGase转化;激光共聚焦显微镜和扫描电镜分析均表明,EDTA添加后,菌体形态分化延滞。结合激光共聚焦显微镜和扫描电镜观察证明TGase参与维持S. mobaraensis的活力,保护菌体进行正常的形态分化。
链霉菌来源于土壤,由于生长环境复杂使其进化出独特的形态分化模式[24]和代谢调控机制[25]。链霉菌在固态培养过程中,基内菌丝可分化为气生菌丝,在分化前期,基内菌丝会通过分解胞内蛋白质、核酸等为气生菌丝的生长供给营养物质,该过程即为程序性死亡[3]。目前已经在真核生物和酵母、芽孢杆菌中证实了TGase的合成与程序性死亡相关。链霉菌TGase的合成伴随着程序性死亡开始进行[26],并参与链霉菌气生菌丝的形成[27-28]、构成孢子表面复合蛋白膜[29-30]、改变菌丝细胞壁结构[31],而这些功能均与其交联作用密切相关。因此推测在高浓度Mg2+条件下,胁迫菌体进入程序性死亡[26],刺激菌体启动保护机制,大量合成TGase,交联蛋白在菌体表面形成“防护层”(如对照组从发酵初期的淀粉样,到发酵后期致密的膜状物),以减弱外界环境的破坏,维持细胞完整结构避免营养物质外溢,保证菌体的正常分化。添加EDTA后,抑制了能使Pro-TGase转化成活性TGase的关键金属蛋白的活力,从而活性TGase合成受阻。由于TGase的活力降低,抑制了细胞表面蛋白的共价交联,因而形态变得单一,不再有淀粉样和膜状物出现。
基于TGase合成与链霉菌菌体分化间的关系,在实际发酵生产过程中,可以通过环境胁迫作用,来诱导S. mobaraensis提高TGase的产量;另外还可以通过调控TGase合成的关键蛋白酶活力,进一步提高TGase产量。本研究只是从细胞水平观察了TGase与S. mobaraensis的形态分化之间的关系,而TGase的合成机理尚不明确,还需要更深入的研究。
