环境因素对Bacillus amyloliquefaciens TF28在土壤中定殖的影响
2019-10-29孟利强陈靖宇胡基华张淑梅
姜 威,孟利强,陈靖宇,曹 旭,胡基华,李 晶,张淑梅
(1.黑龙江省科学院 微生物研究所,哈尔滨 150010;2.黑龙江省科学院 高技术研究院,哈尔滨 150010)
芽孢杆菌广泛存在于自然界中,是重要的生防资源菌。近年来,以芽孢杆菌为活性成分的微生物菌剂产品逐年递增,在植病生防方面的作用日益凸显。然而,这些活体菌剂在实际应用中会受到土壤中生物和非生物因素影响,存在应用效果不稳定的共性问题[1]。活体菌剂的生防效果与生防菌在土壤中的定殖能力相关[2],生防菌株在土壤中定殖能力的下降会降低其田间防治效果[3-4]。研究表明,生防菌株在土壤中的定殖能力受到菌株自身特性和土壤环境因素的影响,Chen等[5]报道枯草芽孢杆菌生物膜的形成影响其根际定殖能力,缺失生物膜形成关键基因的突变株其定殖能力下降,对番茄细菌性枯萎病的防控效果也下降。韩腾[6]研究发现,Tpb55菌株在pH 6和pH 7的土壤中的定殖密度显著高于其他pH土壤,并且Tpb55菌株不能在pH 3的土壤中定殖。王素芳等[7]发现,环境温度30 ℃,土壤湿度为20%~25%时更利于生防菌S506的定殖。近年来,关于土壤的微生态环境对定殖影响的报道逐渐增多,但结果不尽相同。刘健等[8]发现,巨大芽孢杆菌在灭菌土壤中的定殖数量高于未灭菌土壤中的定殖数量。曹璞[9]研究发现,辣椒疫霉菌在一定程度上促进了S.plymuthicaA21-4在辣椒和黄瓜根际土壤中的定殖。
芽孢杆菌在土壤中的丰度较大,如何区分引入的生防菌与土著菌是研究生防菌在土壤中定殖的关键技术。目前,抗生素标记的选择性平板计数法和基因标记法是研究菌株根围定殖常用方法[10]。然而,标记后的菌株与野生菌株的生长特性存在很大差别,不能客观反映野生菌的生长定殖动态。
解淀粉芽孢杆菌BacillusamyloliquefaciensTF28是黑龙江省基因工程重点实验室前期从大豆根部分离的内生细菌,具有广谱抗真菌活性,应用前景广阔[11-12]。本试验采用菌落形态鉴别活菌计数及菌株特异PCR验证相结合方法研究温度、土壤类型、含水量、pH、病原菌及接种量对菌株TF28在土壤中定殖的影响,探讨菌株定殖量与防效相关性,为菌株的田间应用提供理论依据和技术支持。
1 材料与方法
1.1 材 料
1.1.1 供试菌株 生防菌株BacillusamyloliquefaciensTF28和大豆根腐病菌Fusariumoxysporum为黑龙江省科学院微生物研究所自行分离获得,保存于黑龙江省科学院微生物研究所菌种保藏中心。
1.1.2 培养基 种子培养基(LB):胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,水1 L,pH 7.0;发酵培养基:可溶性淀粉20 g,KNO31 g,K2HPO40.5 g,NaCl 0.5 g,Fe2SO40.01 g,MgSO40.5 g,水1 L,pH 7.2~7.4;菌数测定培养基(NYD):牛肉膏8 g,蛋白胨5 g,葡萄糖10 g,水 1 L,pH 7.2;马铃薯琼脂培养基(PDA):马铃薯200 g,琼脂15 g,水1 L,pH 7.0。
1.1.3 土壤来源 土壤采自黑龙江加格达奇、同江和集贤健康大豆植株根围土壤。
1.2 方 法
1.2.1 生防菌液制备 用接种环挑取-80 ℃下保存的TF28菌体划线接种至LB平板,30 ℃过夜培养。次日取单菌落转接于5 mL LB培养液中,30 ℃、160 r/min振荡培养18 h,按体积分数为2%接种量转接到100 mL发酵培养液中, 30 ℃、160 r/min振荡培养30 h,测菌数后用无菌水稀释至2×108cfu/mL,备用。
1.2.2 病原菌孢子悬浮液的制备 用PDA固体平板培养病原菌,28 ℃培养8~10 d后用无菌水洗涤孢子,用血球计数板计算孢子数量,用无菌水稀释成浓度为107cfu/mL的孢子悬浮液, 备用。
1.2.3 土壤样品处理 供试土壤样品自然风干,研磨后室温放置,备用。每个处理取10 g 土样放至无菌培养皿中,按下述处理加入适量菌液,混拌均匀,用Parafilm膜封口后静置。
1.2.4 土样中生防菌数测定 采用平板菌落计数及菌株特异PCR验证相结合方法进行菌数测定。取1 g土样加到装有10 mL无菌水的灭菌离心管中,振荡1 min,制成土壤悬浮液,10倍浓度倍比稀释至10-5。分别取10-2、10-3、10-4、10-5稀释液100 μL,涂布NYD平板,28 ℃倒置培养24 h。根据菌株TF28在NYD上的特殊菌落形态计数并用菌株特异PCR进行验证,按下述公式计算菌数。土壤含菌数量(cfu/g)=菌落数× 10×稀释倍数。
1.2.5 温度对菌株TF28在土壤中定殖的影响 取10 g同江(pH 5.2)土样加入2 mL的TF28菌液(2×108cfu/mL),分别置于15 ℃、20 ℃、 25 ℃、30 ℃和35 ℃培养。每处理3个重复,以不加菌土样为对照,分别于7 d、14 d、21 d和28 d取样测定菌数。
1.2.6 土壤含水量对菌株TF28在土壤中定殖的影响 将 2 mL菌液离心收集菌体,用无菌水适当稀释后加到10 g同江土样中,使土壤含水量分别为5%、8%、15%、25%和35%。每处理3个重复,以不加菌土样做对照,置于25 ℃培养,分别于7 d、14 d、21 d和28 d取样测定菌数。
1.2.7 土壤pH对菌株TF28在土壤中定殖的影响 取10 g同江土样用NaOH或HCI溶液调土样pH分别为4.5、5.4、6.2、7.0、7.8、8.6,取 2 mL菌液的菌体用无菌水稀释后加入土壤中,使土壤含水量为15%。每处理置3个重复,以不加菌土样做对照,25 ℃培养,分别于7 d、14 d、 21 d和28 d取样测定菌数。
1.2.8 接种量对菌株TF28在土壤中定殖的影响 取10 g同江土样,调土壤的pH为6.2,接种浓缩菌体,使接种量分别为5%、15%、20%和25%,调土壤含水量为15%。每处理3个重复,以不加菌土样做对照,25 ℃培养,分别于7 d、 14 d、21 d、28 d和35 d取样测定菌数。
1.2.9 土壤类型对菌株TF28在土壤中定殖的影响 取来源于加格达奇、同江和集贤大豆田的黑土,黑钙土和草甸土,使土壤含水量为15%,接菌量为20%。每处理3个重复,以不加菌土样做对照,置25 ℃培养,分别于7 d、14 d、21 d和 28 d取样测定菌数。
1.2.10 病原菌对菌株TF28在土壤中定殖的影响 取10 g加格达奇土样,先加病原菌悬浮液使土壤病菌质量分数为105cfu/g,再加TF28菌液,调土壤含水量为15%,接菌量为20%,土壤pH为6.2,以不加病菌为对照,每个处理3个重复。分别于7 d、14 d、21 d和28 d取样测定菌数。
1.3 数据统计与分析
采用Microsoft Excel 2007 软件处理分析数据,用SAS 8.2软件对数据进行统计学分析。
2 结果与分析
2.1 温度对菌株TF28在土壤中定殖的影响
菌株TF28在5个温度的土壤中均能定殖,定殖动态趋势相似,均为先降低后升高再降低,但定殖速度和定殖数量差异较大(图1)。20 ℃、 25 ℃、30 ℃和35 ℃定殖速度与定殖数量均较高,说明菌株TF28在土壤中有效定殖的温度范围较广,35 ℃定殖速度最快,接种14 d菌数最高(3.6×107cfu/g),25 ℃定殖数量最高,接种21 d菌数最大(3.8×107cfu/g),接近初始接种量(4.0×107cfu/g);低温15 ℃定殖速度最慢且定殖数量最低,接种21 d菌数最大为2.2×107cfu/g。该结果表明温度影响菌株TF28在土壤中的定殖速度与定殖数量, 菌株TF28在20~35 ℃均能在土壤中有效定殖,25 ℃、30 ℃、35 ℃这3个温度处理之间差异不显著,综合4个时期菌株总体定殖数量,25 ℃更利于菌株定殖。

图柱上不同小写字母代表同一处理不同时期之间差异显著(P<0.05),下同。
Different lowercase letters indicate significant difference of the same treatmentof the same process(P<0.05), the same as below.
图1 不同温度时菌株TF28在土壤中定殖数量
Fig.1 Colonization quantity of strain TF28
in soil in different temperature
2.2 含水量对菌株TF28在土壤中定殖的影响
含水量影响菌株TF28在土壤中的定殖,定殖速度随含水量增加而加快。由图2可见,35%含水量在接种后14 d定殖数量最大(3.0×107cfu/g),另外4个处理均在接种后21 d定殖数量最大, 5%、8%、15%和25%含水量的最大定殖数量分别为2.8×107cfu/g、3.0×107cfu/g、3.8×107cfu/g和 3.1×107cfu/g,15%含水量定殖数量最高(图2)。该结果表明菌株TF28在比较宽泛的土壤湿度范围内均能有效定殖,综合4个时期菌株总体定殖数量,含水量为15%更利于菌株TF28在土壤中定殖,低于或高于15%定殖数量降低,但各处理之间差异不显著。
2.3 pH对菌株TF28在土壤中定殖的影响
pH影响菌株TF28在土壤中的定殖。菌株TF28在pH 4.5~8.6时能够在土壤中定殖,但定殖速度和定殖数量存在差异,在pH 4.5的土壤中定殖能力最低,在微酸性和中性土壤(pH 5.4、6.2、7.0)中定殖能力较强,定殖数量无显著差别,接种21 d菌数均达到最大值,pH 7.0的菌数最高,为4.1×107cfu/g;在碱性土壤(pH 7.8和8.6)中定殖能力低于弱酸性与中性土壤,高于pH 4.5的酸性土壤(图3)。

图2 不同含水量下菌株TF28在土壤中定殖数量的变化Fig.2 Changes of soil moisture on colonization quantity of strain TF28 in soil
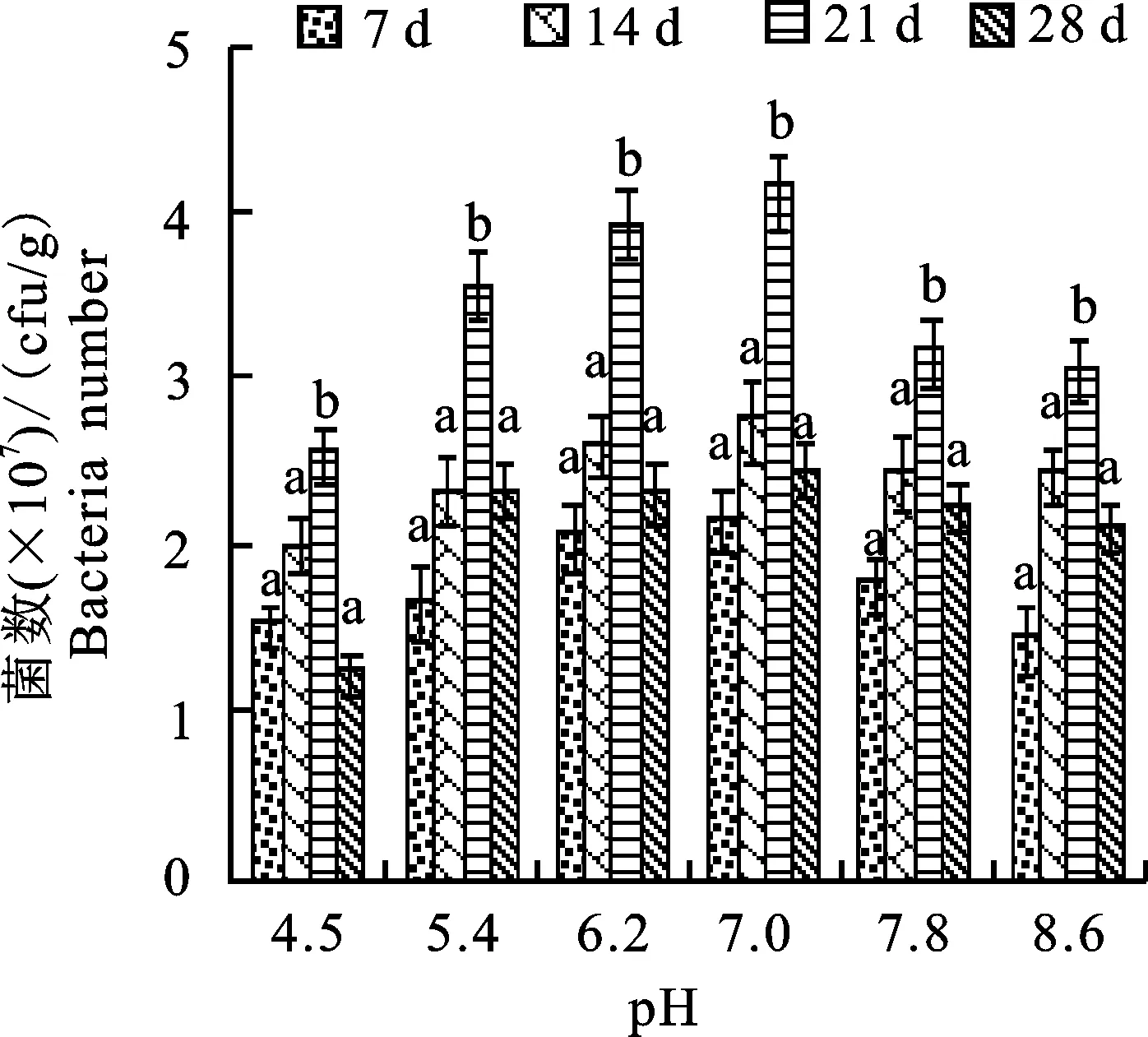
图3 不同pH下菌株TF28在土壤中定殖数量的变化Fig.3 Changes of pH on colonization quantity of strain TF28 in soil
2.4 接菌量对菌株TF28在土壤中定殖的影响
接种量显著影响菌株TF28在土壤中的定殖,5%接种量定殖速度最慢,定殖数量最低;15%接种量次之,20%和25%接种量定殖能力相当,均在21 d时定殖数量最高,分别为3.8×107和4.4×107cfu/g,两者之间差异不显著(图4)。
2.5 土壤类型对TF28菌株在土壤中定殖的影响
选取同江、集贤和加格达奇大豆田土壤进行试验(图5),3个地区土壤类型分别为黑钙土、草甸土和黑土。pH均为弱酸性,分别为5.2、5.4 和5.8。土壤性质不同,加格达奇土壤偏黑,土壤结构好,养分丰富,有机质较高,质量分数为 40.56 g/kg,同江和集贤土壤偏黄,土壤粘重,通气透水性稍差,有机质质量分数略低,分别为 35.24 g/kg和32.44 g/kg。菌株TF28在3个地区土壤中均能有效定殖,在加格达奇土壤中定殖能力最强,其次是同江和集贤,三者之间差别不显著,说明菌株TF28可在不同土壤类型中定殖。

图4 不同接种量下菌株TF28在土壤中定殖数量的变化Fig.4 Changes of inoculation amount on colonization quantity of strain TF28 in soil
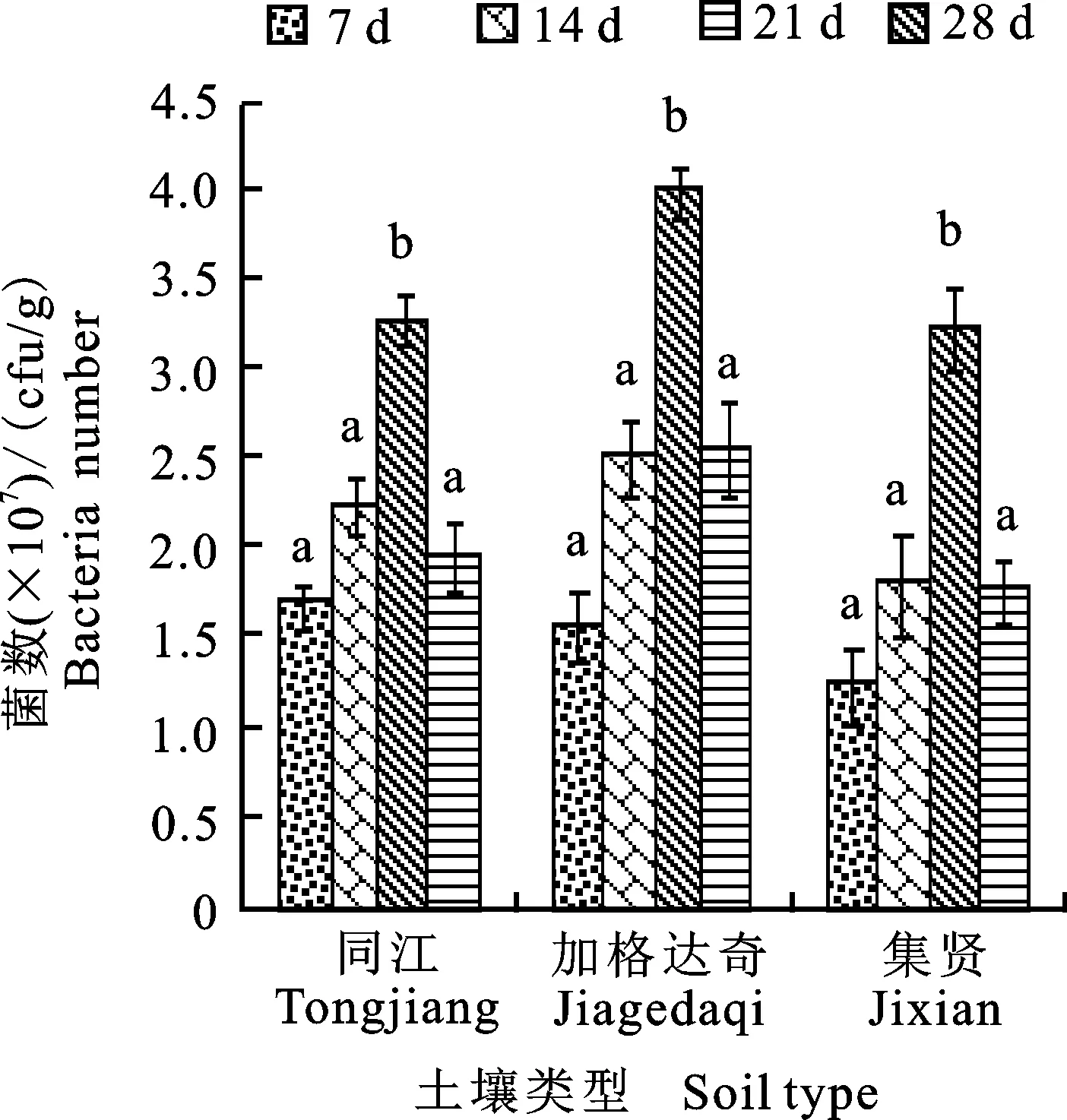
图5 不同地区土壤菌株TF28在土壤中定殖的变化Fig.5 Changes of soil from different areas on colonization quantity of strain TF28 in soil
2.6 病原菌对菌株TF28在土壤中定殖的影响
病原菌显著影响菌株TF28在土壤中的定殖。由图6可见,接种病原菌14 d内显著促进菌株TF28在土壤中的定殖,接种7 d,定殖数量最高,为3.5×107cfu/g,是对照的2倍,之后逐渐降低,接种28 d菌数与对照相比降低1倍。
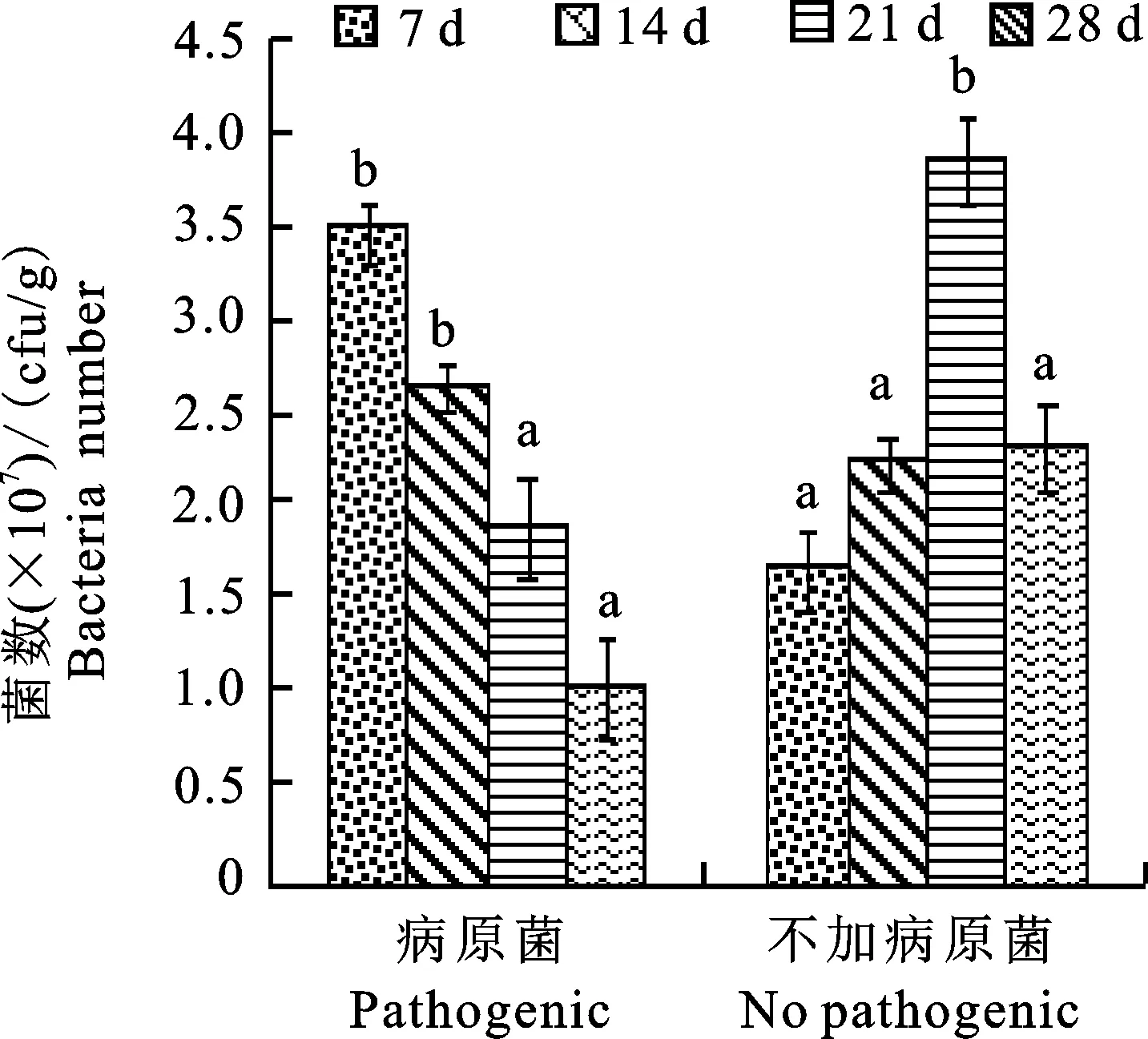
图6 病原菌处理下TF28在土壤中数量的变化Fig.6 Changes of pathogenic fungi on colonization quantity of strain TF28
3 结论与讨论
生防菌的定殖能力是影响其生防效果的重要因素,受自身特性与土壤环境等因素影响,研究生防菌的定殖能力是评价其是否具有应用前景的重要指标之一[2]。本试验利用大豆田根际自然土壤研究离体条件下温度、含水量、pH、土壤类型、接种量及病原菌对解淀粉芽孢杆菌TF28定殖能力的影响(今后尚需进行田间定殖试验研究),以揭示植物、生防菌、土壤微生物环境三者之间的互作关系,为菌株的应用提供理论和技术支撑。
土壤温度、pH及含水量是影响生防菌定殖能力的主要环境因素,温度是一个最重要因素,研究发现,生防菌Pseudomonasfluorescens和Serratiaplymuthica适于在较低温度下定殖,其原因是土著微生物低温时生物活性降低,与外来生防菌的竞争力下降,利于生防菌的定殖[9,13-15]。王淑芳等[16]研究发现温度显著影响海洋多粘芽孢杆菌L1-9在黄瓜根际土壤中的定殖,较高温度其定殖速度加快,较低温度其定殖数量较大, 25 ℃最适于其定殖。刘庆丰等[17]研究发现枯草芽孢杆菌XF1在16~28 ℃能够在白菜根围土壤中很好地定殖,本试验发现菌株TF28在低温 15 ℃条件下定殖能力较低,在20~35 ℃其定殖能力均较强,说明菌株TF28对温度的适应能力较强,能够应对复杂多变的农田温度,提高其应用稳定性。
土壤酸碱度是另一个重要因素,土壤pH影响土壤养分转化及有效性,pH降低会减少可溶性有机质,导致土壤碳、氮源减少[6]。研究发现,土壤酸碱度对生防菌定殖的影响因菌株而异,生防菌Pseudomonadfluorescens2-79[18]和SerratiaplymuthicaA21-4[9]适于在弱酸性土壤中定殖,海洋多粘芽孢杆菌L1-9在中性土壤中定殖能力最强[19],本试验发现菌株TF28在宽泛的酸碱度范围(pH 4.5~8.6)内都能很好地定殖,弱酸性和中性更利于其定殖。目前,中国农田土壤因长期施用氮肥,土壤酸化严重,菌株在TF28在酸性土壤中具有很好的定殖能力,说明该菌株还有效缓解因土壤酸化造成的土壤板结和地力下降 问题。
土壤湿度对生防菌的定殖也有一定的影响,较低湿度利于SerratiaplymuthicaA21-4的定殖,其原因是土壤孔隙多,含氧量高利于菌株生长[10],本研究发现菌株TF28 在5%~35%土壤湿度范围内均能有效定殖,最适湿度为15%含水量, 说明该菌株在农田土壤水分变化较大情况下能够很好地定殖,更具有应用价值。土壤类型对菌株TF28定殖也有一定影响,在有机质相对高的土壤中定殖能力较强,与已有报道一致[20]。
连作大豆由Fusariumoxysporum引起的根腐病日趋严重,前期研究发现菌株TF28能够有效抑制该病菌生长,本试验发现接种Fusariumoxysporum病菌对菌株TF28的定殖有促进作用,可能是接种病原菌后,激活了生防菌对病原菌生存位点及营养物质的竞争能力,促进生防菌在短期内快速生长以抵御病原菌入侵。另外,引入土壤中生防菌数量显著影响其定殖能力,较高接种量其定殖能力增强,其原因是较高接种量激活其群体感应系统,促进了生防菌的生长。
