膀胱癌组织中色素上皮衍生因子与雄激素受体的表达及其相关性
2019-10-25蒋华卜强吴爱斌曾明辉秦锁炳夏东东
蒋华,卜强,吴爱斌,曾明辉,秦锁炳,夏东东
0 引言
膀胱癌是泌尿系统最常见的恶性肿瘤,中国膀胱癌的发病率虽然低于欧美国家,但是呈逐年增长的趋势[1]。目前膀胱癌的治疗以手术切除为主,辅以化疗和免疫治疗等措施,但膀胱癌治疗后易复发,有报道复发率高达80%,其中大约16%~25%复发的肿瘤其恶性程度增加,有10%发展为浸润性或转移性癌,预后较差[2]。膀胱癌的发病率呈现明显性别差异,男性发病率是女性的3倍以上[3]。研究发现,性激素可能与这种性别差异有关,雄激素介导的信号通路可能参与了膀胱癌的发生、发展,然而具体的作用机制还不清楚[4]。
雄激素受体(androgen receptor,AR)作为雄激素发挥作用的重要靶点,一直受到人们的关注。在没有激素作用下,AR存在于胞质中;而在与雄激素结合后,AR构象发生转变,被激活后转移到细胞核内,进而促进靶基因的转录翻译[5-6]。有研究表明,在大多数膀胱癌患者中AR表达增高,而且相比于AR阴性患者,AR阳性患者有更高的复发率、转移率,这说明AR可能作为膀胱癌的预后因素[7-8]。Izumi等[9]研究表明雄激素剥夺治疗可以显著降低膀胱癌复发的风险,但是对于AR信号调节膀胱癌发生、发展的作用机制现在还不清楚。
色素上皮衍生因子(pigment epithelium derived factor,PEDF)是一种重要的内源性血管形成抑制因子,对肿瘤有抑制作用[10]。研究表明,PEDF可在正常组织中表达,抑制内源性血管形成,而在多种肿瘤组织中PEDF表达下调,导致肿瘤组织中血管生成增加,促进了肿瘤发生发展[11-12]。研究表明在前列腺癌中PEDF表达受到雄激素的抑制[13],这说明AR可能会调控PEDF表达。
本文通过研究膀胱癌中PEDF与AR的表达变化及其之间的调控关系,为阐明性激素和膀胱癌的关系提供依据,同时也为膀胱癌的预防和治疗开辟新的途径。
1 资料与方法
1.1 临床资料
收集2016年2月—2018年12月江苏省丹阳市人民医院膀胱癌手术取得的石蜡包埋标本30例,病理证实均为膀胱尿路上皮癌。患者年龄51~78岁,平均年龄65岁。其中男19例,女11例。Ta~T1:12例,T2~T3:18例。病例纳入标准:依据WHO肿瘤分类诊断明确,且病历及随访资料完整者。排除标准:无明确病理诊断及病历及随访资料不完全者。所有入选者事前均告知并签署知情同意书,研究方案获得江苏省丹阳市人民医院伦理委员会的批准(批准号:20160841)。
1.2 材料及主要试剂
人膀胱癌细胞TCCSUP购自中国科学院细胞库,RPMI 1640培养基购自美国Hyclone公司,胎牛血清购自美国Gibco公司,PEDF抗体、AR抗体和GAPDH抗体均购自英国Abcam公司,免疫组织化学试剂盒购自南京建成公司,反转录酶购自美国Promega公司,LipofectamineTM2000和定量PCR试剂盒购自美国ThermoFisher公司,雄激素二氢睾酮(dihydrotestosterone,DHT)购自美国Sigma公司,AR干扰慢病毒载体(Lv-AR shRNA)和对照载体(Lv-NC) 购自美国Santa Cruz公司。
1.3 实验方法
1.3.1 细胞培养 人膀胱癌细胞TCCSUP培养于含10%胎牛血清(FBS)和1%双抗(青-链霉素)的MEM-EBSS培养液中,并置于37℃、5%CO2的恒温培养箱中培养24 h。然后用不同浓度的DHT(0、1、10、100 nmol/L)处理细胞,参照LipofectamineTM2000转染试剂说明书对细胞进行转染:空白对照组:不做任何转染(Control)、阴性对照组:转染Lv-NC慢病毒载体(Lv-NC),转染组:转染Lv-AR shRNA慢病毒载体(AR shRNA)。
1.3.2 免疫组织化学和评分 免疫组织化学染色严格按照试剂盒操作说明进行,PEDF抗体稀释比例为1:100,AR抗体稀释比例为1:50。染色结果由2位经验丰富的病理医师进行双盲阅片。PEDF阳性表达为细胞质呈现棕黄色颗粒,AR阳性表达为细胞核呈现棕黄色颗粒;采用半定量结果判断,分别对镜下阳性细胞的百分比和染色强度给予评分。阳性着色细胞数:每张切片上观察5个高倍视野(×200),计数阳性细胞百分比,阳性细胞数<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%~100%为4分。阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者计分相乘即为最终评分。
1.3.3 Real-time PCR检测PEDF和AR的mRNA表达 收集转染后48 h的细胞,利用TRIzol试剂从不同实验组细胞系中提取总RNA,根据反转录试剂盒说明书将RNA(1 μg)反转录成cDNA。根据NCBI数据库设计基因PEDF和AR的定量引物,引物序列见表1。以GAPDH基因作为内参,利用SYBR Green实时定量PCR染料法对相关基因的表达进行分析。按照2-ΔΔCT法计算和分析各基因的表达水平。反应体积为25 μl,反应条件:94℃ 2 min;94℃ 1 min,56℃ 1 min,72℃ 1 min,40个循环;72℃ 5 min延伸。每个样品取样3次,每次设置3个重复。实验重复3次。
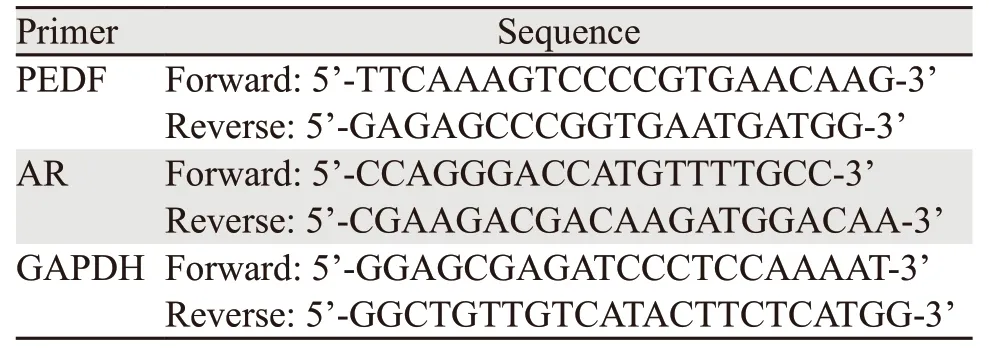
表1 PCR引物序列Table 1 PCR primer sequence
1.3.4 Western blot法检测PEDF和AR的表达水平 RIPA蛋白裂解液(含1×蛋白酶抑制剂和磷酸酶抑制剂)冰上裂解细胞10 min,然后12 000 r/min、4℃离心10 min,将上清液转移至新的EP管中,用BCA法检测蛋白浓度,加入等体积的上样缓冲液,100℃煮沸10 min,取等量蛋白(40 µg)上样,SDS-PAGE进行蛋白电泳。待蛋白完全分离后,将蛋白转移至PVDF膜,将PVDF膜置于含5%脱脂奶粉的TBST(20 mmol/L Tris-HCl,150 mmol/L NaCl和0.1% Tween 20)中室温封闭1 h,然后在封闭液稀释的PEDF和AR一抗(1:1 000)、GAPDH一抗(1:5 000)中4℃孵育过夜,之后用TBST清洗10 min×3次,在封闭液稀释的二抗(1:5 000)中室温孵育1 h,TBST清洗15 min×3次后与ECL反应1 min,用Bio-Rad公司的ChemiDocTMXRX+成像系统获取图像。实验重复3次。
1.3.5 慢病毒转染 将(3~5)×104个/毫升细胞种在12孔板,加入1 ml培养液,培养24 h,病毒感染时50%汇合。然后弃去12孔板中的培养基,每孔加入1 ml凝聚胺溶液(5 μg/ml),每孔加入20 μl病毒液(目的病毒及GFP对照病毒各5孔);孵育过夜;弃去含病毒的培养基,加入1 ml常规培养液,利用Olympus荧光显微镜检测荧光表达来评价转染效率。
1.4 统计学方法
所有数据采用SPSS19.0统计软件进行处理。两样本相关性分析采用Pearson相关分析,两组间数据比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 膀胱癌组织中PEDF和AR表达呈负相关
利用免疫组织化学检测膀胱癌组织中PEDF和AR的表达,见图1,统计30例膀胱癌组织PEDF和AR表达评分,Pearson相关性分析表明膀胱癌组织中PEDF表达与AR表达呈负相关(r=-0.6569;P=0.003),见图2。
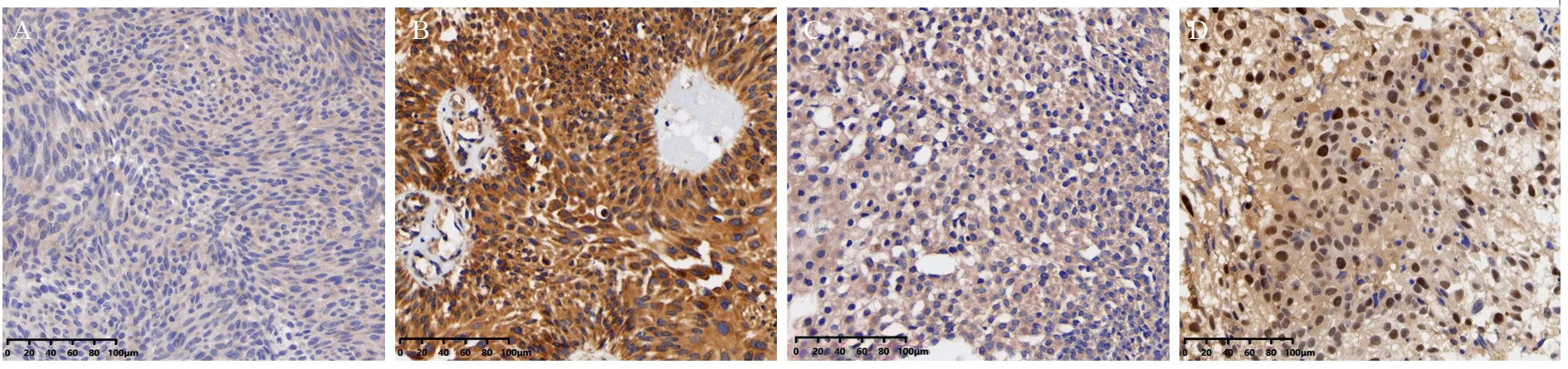
图1 免疫组织化学检测膀胱癌组织中PEDF和AR的表达(比例尺:50 µm)Figure 1 Expression of PEDF and AR in bladder cancer tissues detected by immunohistochemistry (scale:50 µm)
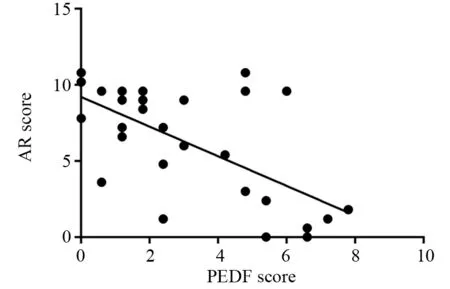
图2 膀胱癌组织中PEDF和AR表达的相关性Figure 2 Correlation between PEDF and AR expression in bladder cancer tissues
2.2 DHT处理对人膀胱癌细胞中PEDF表达的影响
不同浓度的DHT处理人膀胱癌细胞TCCSUP,Real-time PCR结果显示AR mRNA表达水平随着DHT处理浓度的增加而增加,见图3A,同时Western blot结果也显示AR蛋白水平与基因表达水平变化趋势一致,随着DHT处理浓度的增加,AR蛋白水平也增加,见图3B。上述结果表明DTH处理细胞后可上调AR的表达。同时,Real-time PCR结果显示PEDF mRNA表达水平随着DHT处理浓度的增加而减少,见图3C,Western blot结果表明随着DHT处理浓度增加,PEDF蛋白水平减少,见图3D,这表明DTH处理细胞后下调了PEDF的表达。同时相关性分析表明经过DTH处理后的膀胱癌TCCSUP细胞中PEDF和AR表达水平也呈负相关(r=-0.958,P=0.042)。
2.3 建立稳定沉默AR的膀胱癌细胞株
Real-time PCR结果显示:与Control组相比,转染组(AR shRNA)中AR mRNA表达量下降了63.1%,见图4A;Western blot结果显示,与Control组相比,转染组(AR shRNA)中AR蛋白水平下降了81.5%,见图4B。以上结果表明,AR沉默的膀胱癌细胞株构建成功,可用于下一步实验研究。
2.4 沉默人膀胱癌细胞中AR表达可以上调PEDF表达
结果发现:转染组(AR shRNA)中PEDF mRNA表达量是Control组的2倍,见图5A,Western blot结果表明转染组(AR shRNA)中PEDF蛋白水平是Control组的2.4倍,见图5B。以上结果表明膀胱癌细胞系中PEDF表达受到AR信号的抑制。
3 讨论
膀胱癌发病率呈现明显性别差异,男性发病率显著高于女性[2]。雄激素参与了膀胱癌的发生、发展,有研究报道雄激素可能是男性膀胱癌发病率高于女性的原因[4],但是对于雄激素如何调控膀胱癌的发生发展还需要进一步研究,清楚阐述调控机制,将为膀胱癌的预防和治疗开辟新的途径。
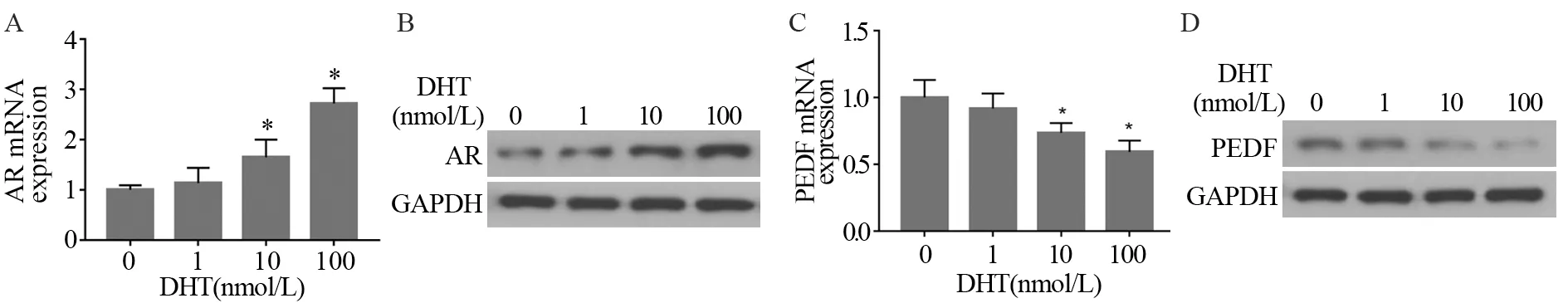
图3 不同浓度DHT处理后AR和PEDF的表达情况Figure 3 Expression of AR(A,B) and PEDF(C,D) after different concentration of DHT treatment detected by Real-time PCR and Western blot
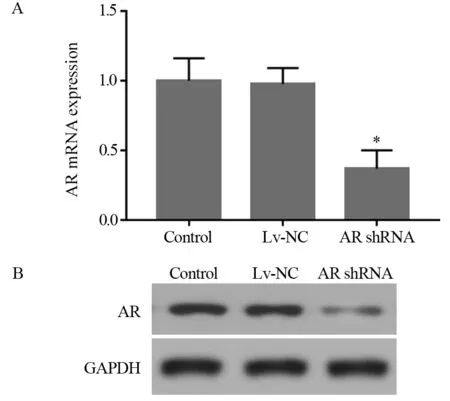
图4 转染AR shRNA后膀胱癌细胞株中AR的表达情况Figure 4 AR expression in TCCSUP cells transfected with AR shRNA detected by Real-time PCR(A) and Western blot (B)
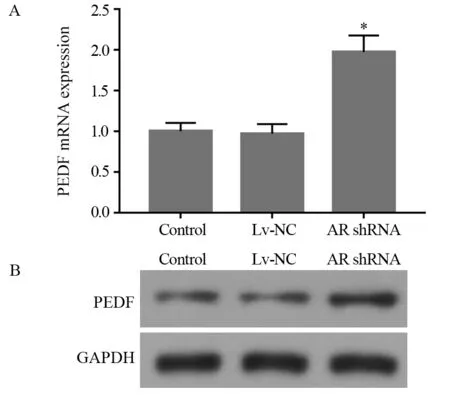
图5 沉默AR后对PEDF表达的影响Figure 5 PEDF expression after AR shRNA treatment detected by Real-time PCR(A) and Western blot(B)
PEDF作为丝氨酸蛋白酶抑制因子超基因家族serpin成员,属于分泌型糖蛋白,具有高度保守的序列,相对分子质量为50 kDa,是一种重要的内源性血管形成抑制因子[14],在胰腺癌[13]、前列腺癌[15]等的研究中表明过表达PEDF可以抑制肿瘤新生血管生成,抑制肿瘤生长。这些结果显示其在抗肿瘤方面有十分重要的作用。Ek等[16]研究也发现PEDF可以减少骨肉瘤细胞UMR 106-01和SAOS-2的侵袭,抑制骨肉瘤的肺转移,抑制肿瘤发展。尽管PEDF在多种肿瘤中的作用已被揭示,但是PEDF与膀胱癌的关系鲜有报道。Doll等[17]在前列腺癌中的研究表明雄激素可以抑制PEDF的表达,而雄激素剥夺则恢复了PEDF的水平,抑制肿瘤生长和转移,因此PEDF表达可能受到雄激素的影响。为了分析PEDF表达与AR表达之间关系,我们利用免疫组织化学检测膀胱癌组织中PEDF和AR的表达,统计30例膀胱癌组织PEDF和AR表达评分,结果表明膀胱癌组织中PEDF表达与AR表达呈负相关。
有诸多研究表明,雄激素阻断可以降低AR水平,减少化学药物诱导的膀胱癌发生,并且抑制肿瘤细胞生长和转移[18-20],同时Izumi等[9]的研究也表明雄激素剥夺治疗可以显著降低膀胱癌复发,提高膀胱癌患者的生存期。但是雄激素是否影响PEDF参与膀胱癌发生发展过程,还不清楚。为了研究雄激素与PEDF之间关系,本实验用不同浓度的DHT处理人膀胱癌细胞TCCSUP后,发现随DHT处理浓度增加,AR表达增加,PEDF表达减少,相关性分析表明PEDF和AR的表达水平呈负相关,结果表明DHT处理人膀胱癌细胞后会显著上调AR表达,下调PEDF表达。进一步利用慢病毒介导干扰AR表达,结果发现PEDF表达水平上调,这表明膀胱癌中PEDF表达可能受到AR信号的抑制。但是在膀胱癌中AR信号如何调控PEDF表达还需要进一步研究。
总之,本文通过研究PEDF与AR的表达变化及其关系,为阐明性激素和膀胱癌的关系提供依据,改善患者的治疗方案,同时也为膀胱肿瘤的预防和治疗开辟新途径。
