金纳米棒介导近红外光热疗杀伤胃癌SGC-7901细胞及诱导凋亡的实验
2019-10-25陈志奎杨菁谢丽红
陈志奎,杨菁,谢丽红
0 引言
胃癌是最常见的消化道肿瘤之一,我国胃癌的发病率位于癌症第二位。早期胃癌的5年生存率可达到90%以上,而晚期胃癌失去手术机会,目前临床采用化疗、靶向治疗等综合治疗[1-3],5年生存率低于20%。肿瘤的消融治疗包括射频、微波、激光、冷冻等多种方法,已经广泛应用于临床[4-6]。近红外光热疗(near-infrared photothermal therapy,NIPT)是近年发展起来的肿瘤局部热消融方法[7-9],通过局部注射或靶向结合等方法,将金纳米棒(gold nanorods,GNRs)递送到肿瘤组织,再通过局部近红外光照射,使肿瘤局部温度升高,可达到有效靶向热消融治疗的效果。本研究初步探讨金纳米棒介导近红外光热疗对胃癌SGC-7901细胞的杀伤作用及细胞凋亡诱导作用,为其体内抗肿瘤研究提供实验依据。
1 材料与方法
1.1 主要试剂及仪器
人胃癌细胞SGC-7901购自中国医学科学院北京细胞库,于RPMI1640培养液(含10%胎牛血清、1%青霉素、链霉素),37℃、5% CO2的恒温恒湿培养箱中培养。氯金酸、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,HTAB)、抗坏血酸均为分析纯,购自国药集团上海试剂公司;巯基聚乙二醇购自美国Nanocs公司;胎牛血清、RPMI 1640培养液、胰蛋白酶购自美国Gibco公司;CCK-8购自东仁化学科技(上海)有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物技术公司;Caspase-3/-9活性检测试剂盒购自碧云天生物技术试剂公司;激光器LR-MFJ-808/5000mW,购自长春镭锐光电科技有限公司;TE2000-U倒置相差荧光显微镜购自日本尼康公司;透射电子显微镜(TECNAI G2F20)购自美国FEI公司;多功能酶标仪SpectraMax i3x购自奥地利美谷分子公司。
1.2 实验方法
1.2.1 金纳米棒的合成 取5 ml浓度0.2 mol/L的HTAB溶液与5 ml浓度5×10-4mol/L的氯金酸溶液,混合后加入0.6 ml浓度0.1 mol/L的硼氢化钠,搅拌2 min,形成晶种溶液。将5 ml浓度为0.2 mol/L的HTAB溶液加入到0.2 ml浓度4×10-3mol/L的硝酸银溶液,再加入5 ml浓度1×10-3的氯金酸溶液,混合后加入70 μl浓度0.0778 mol/L的抗坏血酸溶液,作为生长液。取12 μl晶种溶液加入到生长液中,形成金纳米棒。取100 μl浓度5×10-4mol/L的巯基聚乙二醇加入到1 ml金纳米棒溶液,搅拌30 s,放入4℃冰箱备用。
1.2.2 金纳米棒的表征 取1 ml合成的金纳米棒水溶液,超声分散,取适量样品溶液,滴加到电子显微镜专用铜网上,静置2 min后,用滤纸小心吸去多余溶液,待铜网自然干燥后,透射电子显微镜观察金纳米棒粒径和形貌。采用多功能酶标仪SpectraMax i3x检测金纳米棒溶液的紫外-可见吸收峰。
1.2.3 金纳米棒细胞毒性试验 胃癌细胞SGC-7901接种于96孔板,每孔100 μl,含1×104细胞,12 h细胞完全贴壁后,加入不同浓度(0、15、30、60、120 μg/ml)金纳米棒,作用不同时间(1、3、6、12和24 h)后,采用CCK-8法检测金纳米棒对体外培养胃癌细胞增殖的抑制作用。每孔加入10 μl CCK-8溶液,孵育1 h,采用酶标仪在450 nm波长处测定各孔的光密度值,根据公式计算肿瘤细胞生长抑制率(%)=(1-实验组吸光度平均值/空白对照吸光度平均值)×100%。每组设3个重复孔。
1.2.4 金纳米棒介导近红外光热疗杀伤胃癌细胞 胃癌细胞SGC-7901接种于96孔板,每孔100 μl,含1×104细胞,12 h后,加入不同浓度(0、5、10、20和40 μg/ml)金纳米棒,不同功率(1.0、2.0和3.0 W/cm2)近红外光照射2 min后,于不同时间(1、3和6 h后),采用CCK-8法检测金纳米棒对体外培养胃癌细胞增殖的抑制作用,方法同上。
1.2.5 金纳米棒介导近红外光热疗诱导胃癌细胞凋亡 采用Annexin V-FITC/PI双染法检测金纳米棒介导近红外光热疗对体外培养胃癌细胞SCG-7901凋亡的诱导作用。SCG-7901细胞接种于96孔板,每孔100 μl(含1×104个细胞),12 h后加入金纳米棒溶液(终浓度20 μg/ml),采用功率为2.0 W/cm2近红外光照射2 min,在照射后1、3 h两个时间点采用PBS洗涤2次,加入100 μl 1×Binding Buffer、5 μl Annexin V-FITC和5 μl PI Staining Solution,轻轻混匀,避光、室温反应10~15 min,荧光显微镜下观察。
1.2.6 凋亡相关酶活性的检测 以胰酶消化,收集体外培养的SCG-7901细胞,取1 ml细胞悬液(含1×106细胞),置于EP管,加入金纳米棒溶液(终浓度20 μg/ml),采用功率为2.0 W/cm2近红外光垂直照射细胞悬液2 min,600g离心5 min,去除上清液,加入1 ml培养液重悬细胞,静置培养箱3 h后,按照试剂盒说明书检测Caspase-3、Caspase-9酶活性,以酶标仪于波长405 nm处的吸光度表示活性变化。设置阴性对照组,实验重复3次。
1.3 统计学方法
2 结果
2.1 金纳米棒的表征
采用透射电子显微镜观察合成金纳米棒的粒径及形貌。金纳米棒呈长棒状,分散良好,大小分布尚均匀,长径约(53.3±9.3)nm,短径约(15±3.2)nm,长短径比值约为(3.5±0.6),见图1。金纳米棒具有一个横向等离子共振吸收峰和一个纵向等离子共振吸收峰,分别对应其横轴和纵轴两个特征尺寸,其中纵向等离子共振吸收峰位于790 nm左右,见图2。

图1 金纳米棒的透射电子显微镜图 (×80 000)Figure 1 Photo of gold nanorods (GNRs) by Transmission electron microscope (×80 000)
2.2 金纳米棒的细胞毒性检测
采用不同浓度的金纳米棒作用于体外培养的胃癌SGC-7901细胞,在不同时间点,采用CCK-8法检测细胞增殖抑制率。较低剂量的金纳米棒对SGC-7901细胞无明显毒性,当GNR浓度达120 μg/ml,孵育24 h时,细胞增殖抑制率达到最高值37.5%,见图3。
2.3 金纳米棒介导近红外光热疗对SGC-7901细胞杀伤作用
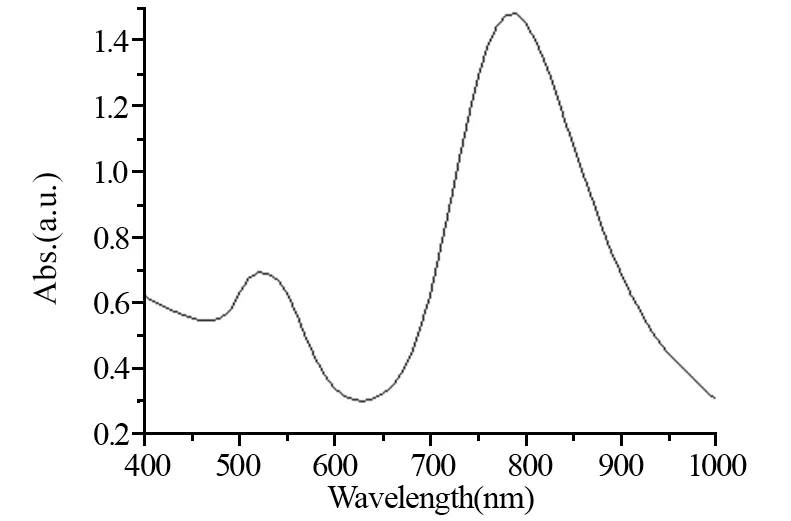
图2 金纳米棒的紫外-可见吸收光谱图Figure 2 UV-VIS absorption spectra of GNRs
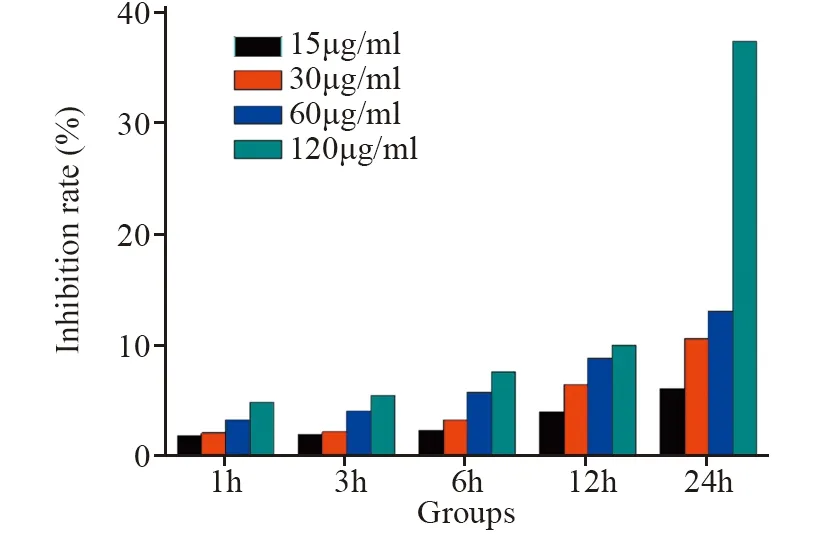
图3 金纳米棒对SGC-7901的细胞毒作用Figure 3 Cytotoxicity of GNRs on SGC-7901 cells
体外培养胃癌SGC-7901细胞生长良好,约3天传代1次。采用CCK-8法检测细胞增殖抑制率,结果显示,单纯近红外光照射,对胃癌细胞生长无明显抑制作用,即使加大近红外光功率到3.0 W/cm2,细胞生长抑制率亦无明显变化。但金纳米棒介导近红外光热疗具有明显的抑制肿瘤细胞增殖的作用,随着金纳米棒浓度增加、近红外光功率升高、处理时间延长,细胞生长抑制率明显升高,呈现出明显的时间-剂量依赖效应,见表1。
2.4 金纳米棒介导近红外光热疗对SGC-7901细胞凋亡的诱导作用
体外培养的SGC-7901细胞经金纳米棒介导近红外光热疗,Annexin V-FITC/PI双染法可见细胞发生凋亡,处理1 h后,可见部分细胞表面发出绿色荧光,处于早期凋亡状态;3 h后,细胞发出红色荧光,进入中晚期凋亡或死亡状态,见图4。
2.5 凋亡相关酶活性的检测
采用分光光度法检测Caspase-3、Caspase-9酶活性。阴性对照的胃癌SGC-7901细胞Caspase-3、Caspase-9的酶活性分别为(0.21±0.05)、(0.19±0.04),经金纳米棒介导近红外光热疗处理后3 h,Caspase-3、Caspase-9酶活性均升高,分别为(0.40±0.07)、(0.45±0.10),与阴性对照组比较差异均有统计学意义(P=0.026、0.018)。
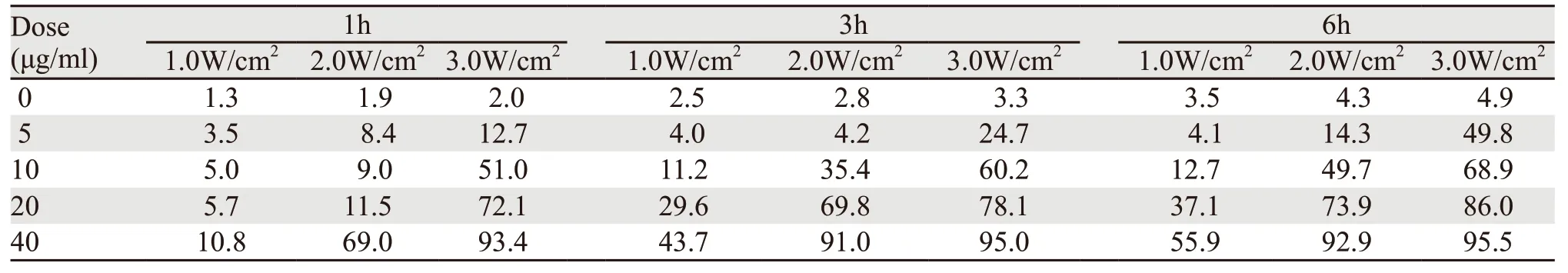
表1 金纳米棒介导近红外光热疗对胃癌SGC-7901细胞增殖的抑制作用 (细胞生长抑制率,%)Table 1 Inhibition effects of GNRs-mediated near-infrared photothermal therapy (NIPT) on proliferation of gastric cancer SGC-7901 cells (IR,%)
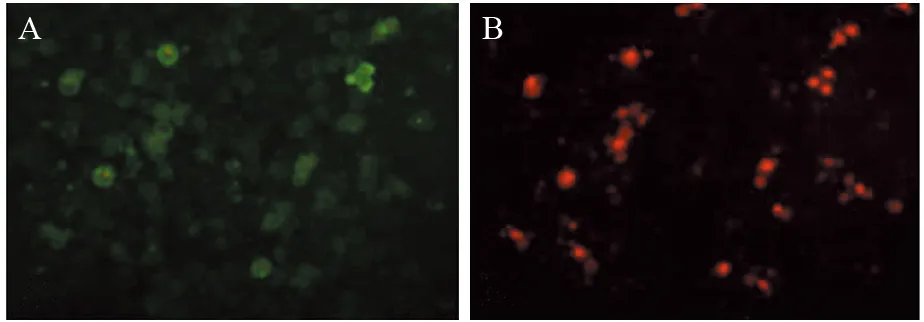
图4 金纳米棒介导近红外光热疗1h和3h的SGC-7901细胞凋亡图Figure 4 Apoptosis photo of SGC-7901 cells treated with GNRs-mediated NIPT for 1h and 3h
3 讨论
近年来研究表明,光热疗法是一种具有巨大应用前景的肿瘤微创治疗方法,其疗效明显,且不良反应小,已受到了医药卫生领域的广泛重视[10-12]。随着纳米技术的不断发展,金纳米棒等在近红外区域具有特征吸收的无机纳米材料在肿瘤光热治疗、药物递送、分子影像中显示出很高的应用价值[13-14]。
金纳米棒的局部表面等离子体共振带包括高能的横向吸收带和低能的纵向吸收带。随着纳米棒纵横比增加,其光学性质发生改变,纵向表面等离子体共振最大峰偏移到近红外区。本研究采用晶种生长法成功合成了金纳米棒,透射电子显微镜测得长短径比值为3.5,其纵向等离子共振吸收峰位于790 nm近红外区域,并且采用波长808 nm的近红外光照射,可见溶液温度明显升高,进一步证明合成的近纳米棒具有明显吸光发热作用。
金元素属于惰性化学元素,因此金纳米粒子被认为是一种比较稳定的生物相容性材料之一。然而,研究表明,金纳米粒子具有一定的细胞毒性[15]。100 nm以下的金纳米粒能自由进出细胞,并且进入细胞器,并可能干扰其功能[16]。金纳米粒子的细胞毒性与其浓度、粒径和形状等密切相关。采用晶种生长法合成的金纳米棒,其表面存留大量HTAB,具有明显细胞毒活性。通过对金纳米棒进行修饰,采用巯基聚乙二醇置换其表面的HTAB,可明显降低金纳米棒的细胞毒性。本研究采用CCK-8法检测晶种生长法合成并经巯基聚乙二醇修饰的金纳米棒对体外培养的胃癌SGC-7901细胞的毒性。CCK-8法操作简便,检测敏感度和准确性均很高,重复性好。实验结果显示,低浓度金纳米棒对细胞无明显毒性作用,当提高药物浓度和孵育时间,120 μg/ml的金纳米棒孵育24 h,细胞生长抑制率亦仅为37.5%,表明巯基聚乙二醇修饰的金纳米棒毒性明显降低。
为减少高浓度金纳米棒细胞毒性对金纳米棒介导近红外光热疗效果的影响,本研究采用5、10、20、40 μg/ml浓度的金纳米棒进行光热治疗实验,治疗后孵育时间设置为1、3、6 h。单纯近红外光照射对细胞生长抑制不明显,并且与照射功率亦无明显相关,可能本研究采用近红外光直接照射96孔板,溶液温度上升速度较慢,幅度较低,而其散热相对较快,故不足于产生明显的杀伤胃癌细胞作用。当加入金纳米棒,近红外光照射后,溶液温度上升速度快,幅度大,细胞生长抑制率明显下降,当金纳米棒浓度为40 μg/ml,3.0 W/cm2近红外光照射2 min,继续孵育1 h后,细胞生长抑制率达到93.4%。比较近红外光热疗作用1、3、6 h后的细胞生长抑制可以发现,随着孵育时间延长,细胞生长抑制率变化逐渐升高,具有一定的时间依赖效应。
文献报道,高温可破坏癌细胞膜,抑制细胞核酸和蛋白质合成,破坏细胞核支架,诱导凋亡基因表达,导致细胞死亡[17-18]。本研究采用Annexin V/PI双染法检测近红外光热疗对胃癌SGC-7901细胞凋亡的诱导作用。Annexin V-FITC可与早期凋亡的细胞脂膜的磷酯酰丝氨酸结合,发出绿色荧光;中晚期凋亡及死亡的细胞膜通透性受损,碘化丙啶能透过细胞膜,与核酸结合,发出红色荧光。实验结果显示,近红外光热疗可明显诱导胃癌细胞凋亡,在1 h时可见早期凋亡细胞,而3 h后大部分细胞处于中晚期凋亡或死亡状态。由此可见,金纳米棒介导近红外光热疗主要通过热损伤作用抑制胃癌细胞增殖,诱导细胞凋亡。
Caspase半胱氨酸蛋白酶家族在细胞凋亡过程中起着重要作用。Caspase-3处于级联反应的下游,被认为是细胞凋亡的关键执行者,其活化代表细胞凋亡进入不可逆阶段[19]。本研究通过分光光度法检测金纳米棒介导近红外光热疗对胃癌SGC-7901细胞凋亡相关酶活性的影响。实验结果显示,与阴性对照组比较,Caspase-3、Caspase-9酶活性均升高约1倍,进一步表明金纳米棒介导近红外光热疗可通过活化Caspase诱导胃癌细胞凋亡。
综上所述,采用晶种生长法合成并经巯基聚乙二醇修饰的金纳米棒具有明显的吸光发热作用,并且细胞毒性低。金纳米棒介导近红外光热疗具有显著的抑制胃癌细胞增殖作用,并且该疗效具有明显的剂量依赖效应。金纳米棒介导近红外光热疗可通过活化Caspase诱导胃癌细胞凋亡,这可能是其抑制胃癌细胞增殖的主要作用机制之一。
