LC-MS/MS法测定血塞通注射液中五种皂苷成分的含量
2019-10-23杨崇仪吴凡张红宇王莉王玮
杨崇仪 吴凡 张红宇 王莉 王玮
【摘 要】 目的:研究建立运用高效液相色谱-串联质谱法(LC-MS/MS)同时测定血塞通注射液中人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re、人参皂苷R、三七皂苷R1的定性定量方法,用于血塞通注射液的质量控制。方法:采用CAPCELL CORE C18色谱柱(2.1mm×150mm, 2.7μm),柱温30℃,流动相:A(超纯水)和 B(乙腈),使用梯度洗脱如下:0.01~3.00min,95%A;3.00~4.00min,95%A~30%A;4.00min~10.00min,30%A;10.00min~12.00min,30%A~95%A; 12.00min~15.00min,95%A。流速设定为 0.300mL/min。总运行时间为15.0min。采用多重反应监测(MRM)的扫描方式下正负离子同时监测,离子源为 ESI 源。结果:标准曲线的相关系数均高于 0.9988;日内精密度和日间精密度(RSD)分别小于 4.14%和 4.87%;回收率在 94.3%~106.9%之间。被分析成分48h内稳定性良好。结论:建立并验证了运用高效液相色谱-串联质谱法同时测定血塞通注射液中人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re、人参皂苷R、三七皂苷R1的定性定量方法,该方法已成功地应用于云南地产的9批次的血塞通注射液中人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、人参皂苷Re、三七皂苷R1的定性和定量分析。
【关键词】 血塞通注射液;高效液相色谱-串联质谱法;人参皂苷;三七皂苷
【中图分类号】R284.1 【文献标志码】 A【文章编号】1007-8517(2019)13-0034-10
三七(Panax notoginseng (Burk.)F. H. Chen)为五加科人参属植物,是我国名贵中药材,是云南道地中药材资源。血塞通注射液为三七提取物制剂,主要成份为三七总皂苷,有活血祛瘀、通脉活络等功效,主要用于中风偏瘫、瘀血阻络证,动脉粥状硬化性血栓性脑梗塞、视网膜中央静脉阻塞见瘀血阻络证者,临床应用广泛并且疗效确切,是一种具有重要应用前景的中药品种。血塞通注射液的现行质量标准为国家食品药品监督管理局国家药品标准WS3-B-3590-2001(Z)-2011,标准规定的含量测定所用方法为HPLC法[1],检测时间为60min,耗时较长而且灵敏度低。其主要成分三七总皂苷和三七三醇皂苷的含量测定的标准方法收载于《中国药典》2015版[2、3],三七三醇皂苷的测定也采用HPLC法,测定时长为90分钟。LC-MS/MS技术是近年最新发展起来的重要的分离和分析方法,拥有液相色谱的优越分离性能,串联质谱(MS/MS)相较于单质谱(MS)具有更高选择性、更高灵敏度和更高准确度,LC-MS/MS具有分析范围广,分离能力强,定性分析结果可靠,自动化程度高等优点[4]。运用LC-MS/MS技术能够避免繁瑣和复杂的衍生化前处理,同时能够得到化合物保留时间、分子量及特征离子对等丰富的信息。在对未知成分的研究中,通过质谱检测器给出的大量结构信息,结合同类已知结构化合物的裂解规律,即可对未知成分进行分析;在已知成分的测定中,相较于传统色谱法具有更高准确度和灵敏度[5]。检索现有的研究文献,对血塞通注射液进行有效成分测定的方法多为液相色谱法[6-13],检测时长最短为24min[7],应用LC-MS/MS测定三七总皂苷中一个或几个皂苷成分的研究文献也有报道,但研究对象为三七原料[14-15]或其他品种的注射液[16],应用LC-MS/MS对血塞通注射液中三七总皂苷进行测定的文献未见报道。研究建立一种运用LC-MS/MS法对血塞通注射液中人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、人参皂苷Re、三七皂苷R1快速准确定量的方法,相对于血塞通注射液的现行质量标准,大大提高了检测效率。并成功运用该方法对来自云南不同生产企业的血塞通注射液进行了含量测定,为云南血塞通注射液的生产企业提供了提升药品标准、提高药品质量的依据。
1 仪器与材料
1.1 仪器 LC-30A高效液相色谱仪(含在线脱气机、二元泵、自动进样器,日本岛津公司)、TRIPLE QUAD 5500型质谱仪(美国 AB Sciex公司)、CPA225D 型分析天平(北京赛多利斯仪器有限公司)、UPH-IV-90Z优普超纯水机(成都超纯科技有限公司)。
1.2 材料 人参皂苷Rg1(Ginsenoside Rg1,批号:110703-201529,纯度95.0%)、人参皂苷Rb1(Ginsenoside Rb1,批号:110704-201424,纯度93.7%)、人参皂苷Re(Ginsenoside Re,批号:110754-201525)、人参皂苷Rd(Ginsenoside Rd,1批号:10704-201424)、三七皂苷R1(Notoginsenoside R1,批号:110745-201318)和三七总皂苷(Notoginseng Total Saponins,批号:110870-201002,含量以三七皂苷R1 6.9%、人参皂苷Rg1 28.0%、人参皂苷Rb1 29.7%、人参皂苷Re 3.8%、人参皂苷Rd 7.3%计)以上对照品购于中国食品药品检定研究院。甲醇(色谱级,德国默克公司),乙腈(色谱级,德国默克公司),超纯水。血塞通注射液收集于云南省不同企业,具体见表1。各待测物的化学结构图见图1。
2 方法
2.1 分析条件
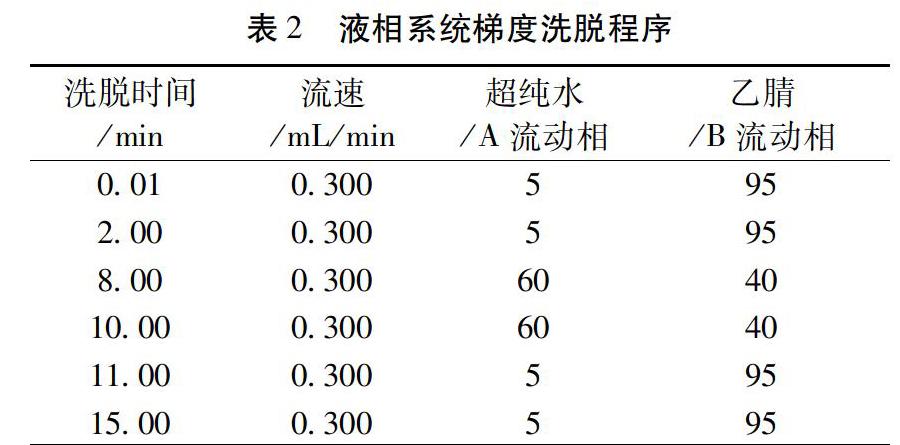
2.1.1 色谱条件 色谱柱:CAPCELL CORE C18柱(2.1mm I.D.×150mm, 2.7μm,SHISEIDO);柱温:30℃;流动相: A-B(水-乙腈)梯度洗脱,梯度洗脱程序如下,见表2;分析时间为 15.0min;流速:0.300mL/min;进样量:1.00μL。对照品的提取 MRM 色谱图和样品的MRM色谱图比对见图2。
2.1.2 质谱条件 采用多重反应监测(MRM)的扫描方式下正负离子同时监测,离子源为 ESI 源,源喷射电压设置为 5500 和-4500 V,源温度(TEM)550℃,雾化气压力为55 psi,接口持续加热,碰撞反应气使用氮气,气帘气压力为 35 psi,Q1 和 Q3 分辨率均为 0.1Da,驻留时间(dwell time)为 80 ms。
将每个皂苷成分的人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、人参皂苷Re、三七皂苷R1对照品溶液(浓度约1μg/mL)分别打入质谱中,用MRM模式正负离子同时扫描,对前体离子(Q1)、产物离子(Q3)、去簇电压(DP)和碰撞能量(CE)进行优化,经过优化后发现在正离子模式下,五种皂苷成分的响应强度均优于负离子的响应强度。本实验采用正离子对定量、负离子对定性的方式对五种皂苷成分进行测定。由于负离子对不用于定量检测,所以未对负离子对进行质谱条件的优化。正离子模式下的监测离子对、去簇电压(DP)及碰撞能量(CE)见表3。数据处理采用 AB Sciex公司提供的 Analyst软件,1.6版本。五种皂苷成分的一级质谱及二级质谱产生的主要裂解碎片见表3和图3。
2.2 对照品溶液的制备 分别称取人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、人参皂苷Re、三七皂苷R1对照品适量,使用甲醇溶解并配制成一定浓度的贮备液,供质谱条件优化用。取三七总皂苷对照品适量,精密称定,用甲醇溶解并定容,制得三七总皂苷储备液,浓度为含三七总皂苷1.0775mg/mL。于-20℃下保存。
2.3 供试品溶液的制备 取血塞通注射液适量,按照一定比例,用甲醇稀释定容后,用0.45μm滤膜过滤后制得供试品溶液,于4℃下保存。
2.4 方法学验证
2.4.1 标准曲线、检测限和定量限 取三七总皂苷储备液,采用梯度稀释法,用甲醇由高到低分别稀释成8个浓度(4310ng/mL,2155ng/mL,1077.5ng/mL,538.75ng/mL,269.38ng/mL,134.69ng/mL,67.34ng/mL),0.45μm滤膜过滤后,取1.0μL进样,记录峰面积。以对照品进样浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得标准曲线方程。将三七总皂苷储备液用甲醇逐步稀释并进行测定,以信噪比S/N=10和S/N=3时各对照品溶液的浓度为定量限和检测限。
2.4.2 精密度、回收率和稳定性 取血塞通注射液,按照适当比例稀释,得到中间液,再将中间液用两倍的稀释梯度稀释为高、中、低三个不同浓度的供试液,用0.45μm滤膜过滤后,取1μl进样,每个浓度的供试液平行测定6份,按“2.1”项下的分析条件对供试液中的人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、人参皂苷Re、三七皂苷R1进行定量分析记录峰面积,带入当日制作的标准曲线中计算出5个皂苷的浓度,并计算RSD值。供试液于4℃下保存,于24h后同法再次測定,计算出5个皂苷的浓度,并计算RSD值。
取供试品溶液,于4℃下保存,分别于0h、24h、48h 测定五种皂苷的浓度,平行测定6份,考察供试品溶液的稳定性。
精密量取供试品溶液1.0mL,加入甲醇1.0mL旋涡混匀后,取1.0μL进样,测定五种皂苷的峰面积,带入标准曲线中计算浓度(记录为A浓度)。精密量取高、中、低(4156ng/mL、2078ng/mL、1039ng/mL)三个浓度水平的对照品溶液1.0mL,分别加入到1.0mL的供试品溶液中,旋涡混匀后,制得含有高、中、低浓度的三七总皂苷的供试品加样回收溶液(外加对照品的浓度值为2078ng/mL、1039ng/mL、519ng/mL),每个浓度平行制备 6 份进行测定,测定供试品加样回收溶液中五种皂苷的峰面积,带入标准曲线分别计算出五种皂苷在加样回收溶液中的含量(记录为B浓度),B浓度与A浓度的差值即为实测的对照品浓度值。带入按回收率公式:实测的对照品浓度值/外加对照品的浓度值×100%。计算五种皂苷的回收率。
2.5 样品中五种皂苷成分含量测定 分别取“表1”中9个批次的血塞通注射液作为样品,按“2.3”项下方法制备供试品溶液,按上述方法进行检测,记录五种皂苷的色谱峰面积,代入标准曲线,计算样品中五种皂苷的成分的含量。
3 结果
3.1 方法学验证
3.1.1 标准曲线、检测限和定量限标准曲线的制备 以对照品进样浓度为横坐标,峰面积为纵坐标,绘制曲线并进行线性回归,得回归方程。相关系数为 r>0.9988 ,线性关系良好,所得回归方程、线性范围、LOD 和 LOQ 见表4。
3.1.2 精密度、回收率和稳定性 5 种皂苷的日内精密度及日间精密度的 RSD 值分别小于 4.14%和 4.87%,说明方法精密度良好,详见表5和表6。供试品溶液于4℃下保存,分别于0h、24h、48h 测定五种皂苷的浓度,结果显示供试品溶液稳定性较好,RSD≤7.32%,具体数据详见表7。5 种皂苷低、中、高 3 种浓度的加样回收率范围为 94.02%~106.20%,表明方法回收率良好。
3.2 血塞通注射液样品中的五种皂苷成分的含量测定9批血塞通注射液中的的五种皂苷成分的含量测定结果见表8。其中人参皂苷Rg1的含量范围为28.39%~37.48%、人参皂苷Rb1的含量范围为28.75%~43.01%、人参皂苷Rd的含量范围为6.11%~11.53%、人参皂苷Re的含量范围为2.945~6.10%、三七皂苷R1的含量范围为5.82%~9.29%。由此可看出云南地产的,不同企业、不同批次的血塞通注射液中的五种皂苷成分的含量范围跨度不大,且都符合现行血塞通注射液药品质量标准“国家食品药品监督管理局国家药品标准WS3-B-3590-2001(Z)-2011”的要求。来自同一生产企业的不同生产批号的血塞通注射液的五种皂苷成分的含量范围差异较小,可见生产工艺都较为成熟稳定。
[9]李华丽,王小龙,李梅荣,等.HPLC法测定三七中人参皂苷Rg1和三七皂苷R1的含量[J].海峡药学,2018,30(5):86-88.
[10]刘嘉柳,苏草茵,郑艾妮,等.整体柱液相色谱法分离三七及其制剂中8种皂苷的研究[J].广东药科大学学报,2017,33(6):743-747.
[11]靳慧娟.高效液相法测定血塞通注射液中皂苷含量[J].黑龙江科技信息,2017(6):170.
[12]王时云,罗春阳,周建军,等.全自动二维液相色谱系统测定注射用血塞通中人参皂苷Rb1含量[J].湘南学院学报(医学版),2017,19(2):16-20.
[13]李兰杰. 血塞通注射液中皂苷类药效物质基础研究[D].长春:吉林大学,2016.
[14]Chen W, Dang Y, Zhu C. Simultaneous determination of three major bioactive saponins of Panax notoginseng using liquid chromatography-tandem mass spectrometry and a pharmacokinetic study[J]. Chinese Medicine,2010(5):12
[15]郭枫,刘焕焕,王彩艳,等.阴离子交换树脂纯化三七总皂苷的液质联用分析[J].科学技术与工程,2017,17(31):199-203.
[16]Yang L, Xu SJ, Wu ZF, et al. Determination of Ginsenoside-Rg1 in Human Plasma and its Application to Pharmacokinetic Studies Following Intravenous Administration of‘Shenmai Injection[J]. Phytother. Res, 2009,1(23):65-71.
[17]杨逸,杨丽瑛,戴景峰,等.人参皂苷Rg1药理活性的研究进展[J]. 时珍国医国药, 2012,23(12):3121-3123.
[18]杨秋娅,李晓宇,刘皋林.人参皂苷Rb1的药理作用研究进展[J]. 中国药学杂志,2013,48 (15) :1233-1237.
[19]马增春,肖勇,赵佳伟,等.人参皂苷Re对 H9c2 心肌细胞 CYP450 酶的影响[J].中国药理學通报,2016(4):494-498.
[20]张琛,赵钢.人参皂苷Rd的药理作用研究进展[J].中国新药杂志,2011,20(11):953-958.
[21]杨晶晶,刘英,王承潇,等. 三七皂苷R1的现代研究进展.中国医院药学杂志,2015,35(5):463-467.
(收稿日期:2019-04-20 编辑:刘斌)
