钼酸铁的制备及应用
2019-10-22
(沈阳化工大学 辽宁 沈阳 110142)
一、光催化[1]
H.Y.He等人在钼酸铁 Fe(II)的合成中,使用0.01mol 的FeSO4·7H2O和0.01mol的 Na2MoO4·2H2O分别溶于50 mL去离子水中。将溶液放入两个玻璃烧杯中,在用磁力搅拌方式的基础上,将两种溶液分别逐滴混合后,迅速形成褐色沉淀。将沉淀进行过滤后,用去离子水反复洗涤,在80℃下干燥24h,经x射线衍射分析,所得沉淀是非晶态。随后在空气中500℃煅烧形成Fe2(MoO4)3相,在N2条件下500℃煅烧1h,生成纯FeMoO4相,所制得的样品粉末为深棕色。
通过对所得样品进行XRD和FESEM固相表征发现所得样品是纳米粒子结构的结晶态钼酸铁 Fe(II),通过紫外-可见吸收光谱显示钼酸铁 Fe(II)具有窄的带隙能量,且在紫外可见光区有良好的光吸收性能。
光催化实验选用甲基橙水溶液,通过研究在不同的pH(5-7)条件下氧化还原电位的变化,以及ORP测试仪分析纳米粒子在甲基橙水溶液的光降解速率。实验结果表明在高于pH=7时,在可见光下可以快速降解甲基橙;在低于pH=5时,在紫外光下有利于快速降解甲基橙。
二、磁特性[2]
Zhiyi Zhang等人选择1 mmol FeCl2·4H2O和1 mmol Na2MoO4·2H2O作为原料,将其溶于17 mL盐酸溶液中,混合溶液pH为2。采用高压反应釜装置置于180℃电热炉中4h。4h后取出高压釜使其冷却至室温。用去离子水和无水乙醇对反应釜产物进行多次洗涤后得到样品。
对于在酸性条件溶液中制备单斜晶结构的纳米棒。采用XRD、SEM、TEM、DSC等方式用于表征样品的形貌结构以及组成成分。研究了纳米棒在室温下的磁性能,晶体的电子态密度(DOSS)和电子部分态密度(PDOS)用VASP计算程序研究了在室温下的磁性。磁性研究显示其矫顽力为31.1 Oe,残余磁化强度分别为4.09×10-3 emu / g。钼酸铁 Fe(II)由于O空位的存在,Fe-O八面体的变形减小了配位电子形成的晶场,导致Fe 3d轨道能级分裂成t2g和eg 的简并轨道,形成自旋向上和自旋向下的不平等状态。Fe 3d轨道电子的这种高自旋排列有助于钼酸铁Fe(II)的磁性。
三、电学材料
使用钼酸铁Fe(II)作为LiB阳极材料[3-6]而N.N.Leyzerovich等人则是选择以MoO3和FeO为原料进行固相反应,将反应与丙酮充分混合,密封在铂坩埚中并在700℃下加热72h。然后以120℃/ h的速率冷却至室温。获得实验所需样品。
在实验研究中对于电化学机理进行了探究,发现Li的插入既不会导致XRD图中新相的形成,也不会导致峰位置的移动。另一方面,Li的插入没有引起原始化合物的任何变化。给出结论是,在氧化还原反应过程中锂离子没有被插入阳极材料的结构中。
Zhicheng Ju等人采用一步水热合成法以FeSO4·7H2O和 Na2MoO4·2H2O作为原料。
研究中基于纽扣电池研究了在0.01-3.0V(相对于Li+/ Li)的电压范围内,在室温下恒定电流100mA g-1。合成材料的Li存储和循环特性。在经过3次充放电循环测试,库伦效率大于97%,达到预期的锂储存性能和良好的循环稳定性。随后又探究了不同电流密度下表现出高可逆容量和良好的速率性能,这表明钼酸铁Fe(II)是用于高功率锂离子电池应用的有前途的材料。其优异的电化学性能可能是由于特殊几何形状立方体的特定表面,可以提高材料的导电能力。
为了进一步的深入了解钼酸铁Fe(II)半导体材料用作LIB阳极材料的电化学反应机理。
Zhenyu Zhang等人则是采用一步水热法,实验是使用0.08M FeCl2·4H2O溶解在三甘醇(TEG)中滴加到0.08M Na2MoO4·2H2O水溶液中,对溶液进行磁搅拌。然后将红褐色混合溶液转移到聚四氟乙烯内衬的不锈钢高压釜中,并在电热炉中120℃温度下持续反应24h,自然冷却至室温后,通过离心收集沉淀物,用去离子水和乙醇洗涤数次,在60°C下真空干燥12h。
研究中用恒电流充放电法测试了钼酸铁Fe(II)纳米棒作为LiB阳极的循环性能,测试了在第50、500和1000次循环中的临界电容点,在1C时,电池容量在第1~50次循环中迅速下降到400 mAhg-1,到第500次循环时逐渐上升到1200 mAhg-1,第1000次循环一直保持在1100 mAhg-1。又对相应不同阶段的电池进行了循环伏安(CV)和电化学阻抗谱(EIS)测试。随后利用拉曼和XPS研究了不同循环后的电极材料,以此来识别充放电过程中的化学反应,得出在第一次循环之后钼酸铁Fe(II)转化为Fe2O3,合成电极材料的结晶度随循环时间的延长而降低,最终转变为非晶态。结合循环电化学性能的发展以及结构的演化,又得出TMO电极材料的结构转变和非晶化改善了电化学反应速率,增加了有效比表面积,有助于容量衰减恢复和稳定性。因此研究了整个电极材料的结构和化学演变。循环寿命有助于了解其电化学反应机理,为电极的材料设计和结构优化提供指导。
而Yuhao Wang等人采用简便的水热法制备钼酸铁Fe(II)掺杂石墨烯复合材料,首次将复合材料用作超级电容器的活性电极材料。通过测量研究了FeMoO4/石墨烯复合材料的形态和结构特征。采用循环伏安法,恒电流充放电和电化学阻抗谱在1.0M Na2SO3电解液中的电化学行为。它表明了FeMoO4/石墨烯复合材料,且与石墨烯或FeMoO4相比得到高度改善。
此外,与纯钼酸铁Fe(II)相比,FeMoO4/石墨烯复合材料电化学电阻降低,循环寿命更长,表明石墨烯增强FeMoO4具有的电化学性能。
四、空心微球结构[7-8]
JianXun Cui等人以FeCl2和Na2MoO4为起始反应试剂,蒸馏水为溶剂,采用无模板水热法制备钼酸铁Fe(II)空心微球晶体结构。
选择1 mmol FeCl2·4H2O和1 mmol Na2MoO4·2H2O作为原料,将其溶于17 mL盐酸溶液中,混合溶液pH为2。采用高压反应釜装置置于180℃电热炉中4h。4h后取出高压釜使其冷却至室温。用去离子水和无水乙醇对反应釜产物进行多次洗涤后得到样品。
研究介绍了在不同反应时间下,测得样品的XRD图谱和SEM图像,并进行对比发现存在有三种不同的形貌物质,而随着反应时间的延长至10h后,微棒逐渐消失,空心微球为主要产物。以此给出结论在低温水热条件或反应时间较短情况下容易产生H2MoO4和Fe2O3。H2MoO4和Fe2O3在提高反应温度或反应时间的情况下,会被转化为钼酸铁Fe(II)形成空洞化微球,在这个化学转化过程称之为Ostwald熟化过程。
Lei Zhang等人采用微波辅助溶液相法制备钼酸铁Fe(II),依旧分别采用XRD和SEM对不同温度条件和反应时间不同所得样品进行表征分析。
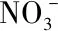
五、活化过硫酸盐[9]
使用钼酸铁Fe(II)作为催化,活化PS去除染料OG Xueming Lin等人采用的是改进的溶剂热法合成的钼酸铁Fe(II),选择在pH=2的51 mL盐酸溶液中溶解3 mmol FeSO4·7H2O和3 mmol Na2MoO4·2H2O。然后将混合溶液放入聚四氟乙烯内衬的容量为100 mL的高压反应釜中。将反应釜装置放入180℃的电热箱中加热4h,取出反应物用去离子水和无水乙醇反复洗涤几次。
研究中以不同的体系为基础,使用PS和OG不同浓度进行研究去除效率的对比实验,随后使用TOC分析进行矿化结果实验,表明FeMoO4/PS体系能有效地矿化OG。随后分别通过研究了催化剂剂量,pH和PS浓度等参数获得最佳反应条件。增加催化剂的量并且PS在适当的浓度范围内将提高去除率,过量的话去除率不会增强,甚至还会减少。此外,pH值的增加会明显降低降解率。回收测试则证明了在十次循环后也具有优异的稳定性能。最后用GC-MS分析检测中间体并呈现出可能的降解途径。该反应过程硫酸根和羟基自由基都有产生,而硫酸根是活化过程中的主要因素,最后表明其活化机理与钼酸铁Fe(II)表面Fe2+/ Fe3+循环有关。
结论
在上述研究中钼酸铁Fe(II)基本采用水热法进行制备合成,其不仅可以用作光催化处理降解染料废水,也可以用作活化过硫酸盐去除染料废水,优异的Li储存性能也可以用作电极的阳极材料且拥有磁性,同时也可以通过改变反应影响因素,制备出空心微球结构。
