伴单克隆免疫球蛋白IgA沉积的膜增生性肾小球肾炎
2019-10-22刘霞李娟姜玲王霞程震
刘 霞 李 娟 姜 玲 王 霞 程 震
病例摘要
现病史患者52岁男性,以“反复发作双下肢皮肤紫癜16年,尿检异常6年,血清肌酐(SCr)升高1月余“于2016-05-06收住入院。患者于2000年时无明显诱因出现双下肢皮疹,不突出皮面,压之不褪色,1天后皮疹可消退,无关节痛、腹痛、黑便,未治疗。2009年因双下肢水肿就诊于外院发现尿检异常(具体不详),血压及肾功能正常,肾活检示免疫荧光IgA+沉积,光镜下见弥漫系膜增生伴新月体形成(3/16)、袢坏死(2处),诊断为过敏紫癜性肾炎,口服泼尼松40 mg/d,后续减量至10~15 mg/d长期维持,蛋白尿波动+~++,持续隐血+++,肾功能正常,皮疹无明显改善,仍反复发作。
2015年2月发现血压160/99 mmHg,SCr 89 μmol/L,尿蛋白+++,尿隐血+++。骨髓穿刺示反应粒细胞增生伴浆细胞增多(成熟浆细胞6%,形态正常),血轻链κ 1.87 g/L,λ 2.54 g/L。2015年3月予口服泼尼松30 mg/d,联合环磷酰胺(CTX)0.8 g/月静滴,共计6次(累计剂量4.8g),尿检无缓解。2015年10月调整为吗替麦考酚酯(MMF)分散片 1.0 g/d,尿检仍未缓解。2016年5月就诊于国家肾脏疾病临床医学研究中心,查尿蛋白定量 7.46 g/24h,尿沉渣RBC 4 935.1/μl、非均一,Alb 27 g/L,Glo 18.4 g/L,BUN 10.2 mmol/L,SCr 119.3 μmol/L。2016-05-06为进一步诊治收住院。病程中患者反复出现双下肢皮肤紫癜(图1),无关节痛、夜尿增多等表现。精神尚可,体重无明显变化。
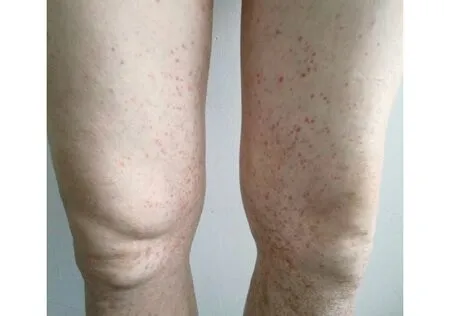
图1 双下肢皮肤紫癜表现
既往史2009年因食管平滑肌瘤行手术治疗。个人史、家族史无特殊。
体格检查体温37.1℃,血压 149/93 mmHg,体重78 kg,身高175 cm,心律齐,各瓣膜区未闻及病理性杂音;双肺呼吸音清,未闻及干湿啰音;腹软,无压痛、反跳痛及肌紧张,移动性浊音阴性;眼睑R,双下肢轻度水肿,未见皮疹。
实验室检查
尿液 尿蛋白定量 2.98 g/24h,尿沉渣红细胞204.1/μl(非均一型)。
血液 Hb 93 g/L,WBC 9.7×109/L,PLT 236×109/L,Alb 24.9 g/L,Glo 16.4 g/L,BUN 10.8 mmol/L,SCr 131.7 μmol/L,UA 582 μmol/L,CystatinC 1.56 mg/L,转氨酶、血脂、电解质正常。eGFR 53.57 ml/(min·1.73m2);血单特异性游离轻链检测:κ FLC 19.87 mg/L,λ FLC 124.49 mg/L,κ/λ 0.16;免疫固定电泳图谱见λ型IgA单克隆免疫球蛋白;IgG 2.6 g/L,IgA 7.63 g/L,IgM 0.408 g/L,IgE 294 IU/ml,补体、ASO及RF正常;冷球蛋白阴性,ANCA阴性,C3肾炎因子和抗补体H因子阴性。
骨髓涂片检查 浆细胞5%;骨髓穿刺组织病理:骨髓增生明显低下;骨髓流式细胞学检查:共检测596 294个细胞,CD38+CD45dim+/-CD19+CD56-cKappa+cLambda+正常浆细胞(p9)占0.005%,CD38+CD45dim+/-CD19-CD56+/-cKappa-cLambda+异常浆细胞(p10)占0.71%(正常<0.01%);荧光原位杂交(FISH)检测:存在IgH断裂重排伴缺失38%,FGFR3/IGH融合基因阳性22%。
影像学检查心电图、甲状腺超声、胸腹部平片、头颅、骨盆平片均未见异常。消化系统超声:肝内略强回声团块(考虑血管瘤);胸部CT:左肺下叶少许肺炎、右肺中叶机化性炎症、两侧胸膜增厚、肝右叶稍低密度灶;外院腹部增强CT:肝脏右叶多发结节考虑血管瘤。
两次肾活检结果
2009年(外院) 16个肾小球,2个球性硬化,3个节段纤维性新月体伴纤维素样坏死,余肾小球弥漫性系膜细胞中度增生。肾间质灶状性纤维化>25%,大片状单核、淋巴、中性粒细胞浸润>50%,灶性肾小管萎缩>25%。肾小管上皮细胞浊肿、颗粒、空泡变性,蛋白管型+,红细胞管型+,部分小管壁增厚,1处小叶间动脉灶性纤维素样坏死。免疫荧光:3个小球,IgA+、IgM+、C3+,余阴性。
小结:系膜增生性病变伴新月体形成(19%)及纤维素样坏死,符合紫癜性肾炎。
2016年(我院) 光镜:45个肾小球,16个球性废弃,3个细胞纤维性新月体。余正切肾小球体积增大,系膜区中度增宽,毛细血管袢开放欠好,偶见节段袢坏死,节段内皮细胞成对,单个核细胞及中性粒细胞浸润1~10个/球,大量“栓子”(图2A)。PASM-Masson:肾小球内皮下节段嗜复红物沉积,节段外周袢分层。肾小管间质慢性病变轻度基础上出现急性病变中度,灶性小管萎缩、基膜增厚,纤维化+。小动脉节段透明变性。免疫荧光:IgA++、C3++,呈颗粒状弥漫分布于系膜区及血管袢(图2B)。IgG、IgM、C1q阴性。荧光染色λ轻链++,呈颗粒状弥漫分布于系膜区及血管袢(图2C)。κ轻链:trace,少量呈颗粒状节段分布于系膜区及血管袢。刚果红染色阴性。电镜:3块组织5个肾小球。低倍镜下较多肾小球系膜区、基膜内皮下,散在上皮侧密度不均匀的电子致密物沉积(图2D),袢腔内及袢内浸润细胞胞质内亦偶见类似物质沉积,高倍镜下电子致密物为晶格状,多数呈平行排列,少数弯曲排列,组成晶格物的直径8~13 nm,部分见中空微管状,直径为2 nm左右,晶格间距20~23 nm(图2E)。肾小球系膜区增宽,系膜细胞及系膜基质增多;肾小球毛细血管袢开放欠好,节段内皮细胞增生;多处系膜基质插入、新的基膜形成。肾小球足细胞足突广泛融合(70%~80%)。
小结:肾小球膜增生样病变,伴袢内大量栓塞,免疫荧光IgA沉积为主,肾组织轻链染色λ++,κ trace。
最后诊断(1)浆细胞病;(2)伴单克隆λ-IgA沉积的膜增生性肾炎。
治疗及随访患者入院后停用吗替麦考酚酯。因肾小球内皮增生明显,较多炎性细胞浸润,给予甲泼尼龙冲击(0.5 g×3d),后续给予小剂量泼尼松10 mg/d+沙利度胺100~200 mg/d治疗。2016-07-13复查尿蛋白14.54 g/24h,SCr升高至294.4 μmol/L,血白蛋白32.1 g/L。患者口服沙利度胺约一个月后出现下肢皮肤感染紫癜复发,当地医院予抗感染治疗后好转。自8月份开始于当地医院予硼替佐米联合地塞米松(BD方案)化疗,共6个疗程。首次BD治疗后次日患者紫癜逐渐消退并未再发,水肿消失,尿检改善。2017年7月复查血压120/70 mmHg,血白蛋白38.4 g/L,SCr 85 μmol/L,血红蛋白129 g/L,血κ轻链1.82 g/L、λ轻链1.48 g/L,M蛋白阴性,骨穿未见明显异常。
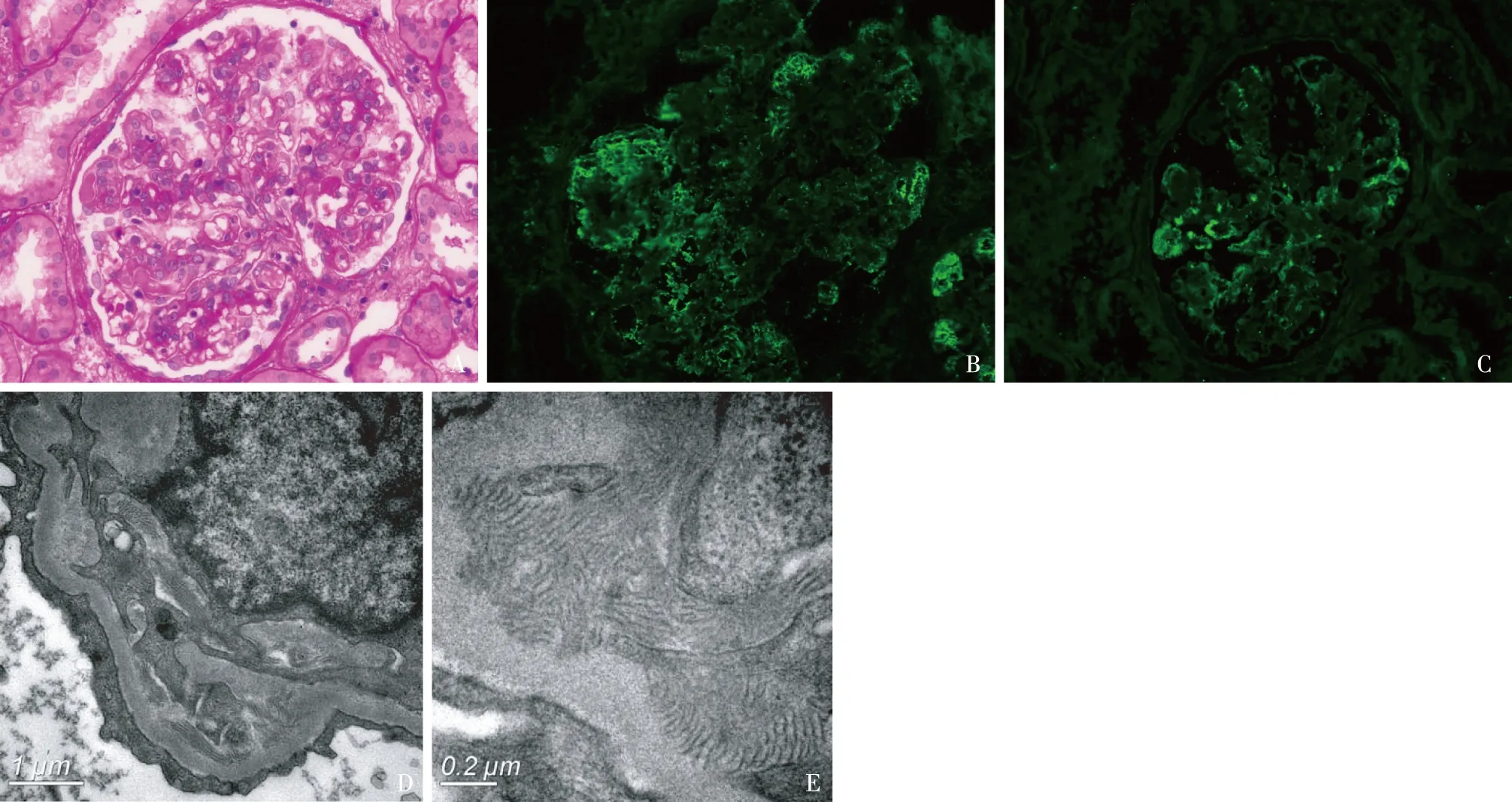
图2 A:肾小球膜增生样病变(PAS,×400);B~C:免疫荧光IgA++(B)、λ轻链++(C)呈颗粒状弥漫分布于肾小球系膜区及血管袢;D~E:上皮侧密度不均匀的电子致密物沉积,高倍镜下电子致密物为晶格状
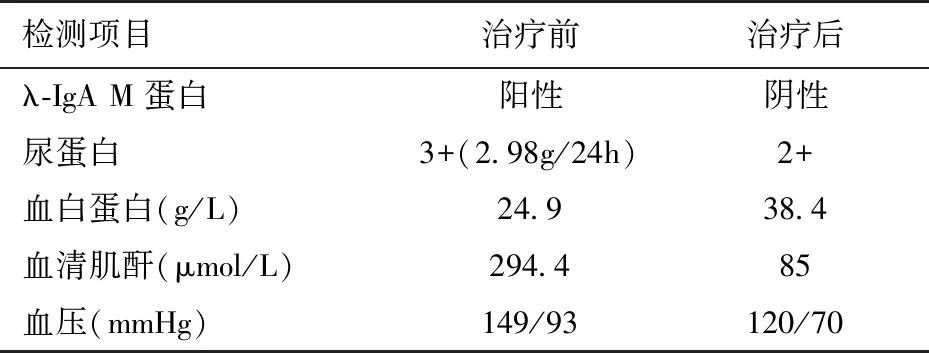
表1 硼替佐米联合地塞米松方案治疗前后的对比
讨 论
本例中年男性患者,病程16年,临床表现为反复发作性双下肢皮肤紫癜,近6年持续尿检异常并进展至肾功能不全。2009年肾活检诊断为过敏性紫癜性肾炎,给予激素治疗后尿检改善,但紫癜持续。近2年肾病加重,激素+环磷酰胺/吗替麦考酚酯治疗无效。2016年5月就诊我院,血M蛋白阳性(λ-IgA),重复肾活检提示膜增生性肾小球肾炎,免疫荧光提示IgA++,轻链染色λ ++、κ阴性,和血M蛋白检测结果一致,刚果红阴性,电镜下见晶格状电子致密物沉积;骨髓细胞学检查提示浆细胞比例5%,骨髓流式细胞学检查见单克隆浆细胞株,荧光原位杂交(FISH)检测报告提示存在IgH断裂重排伴缺失38%、FGFR3/IGH融合基因阳性22%,最终诊断为浆细胞病,伴单克隆免疫球蛋白IgA沉积的膜增性肾小球肾炎。
本例患者以皮肤紫癜起病,后持续尿检异常,如下疾病可以同时出现紫癜伴尿检异常:(1)免疫性疾病,如ANCA相关性血管炎、系统性红斑狼疮、过敏性紫癜性肾炎、冷球蛋白血症。患者血清ANA、ANCA及冷球蛋白均阴性,本院肾活检免疫荧光提示单克隆λ-IgA,且出现MPGN伴晶格样电子致密物沉积,不符合典型过敏性紫癜肾炎及血管炎相关肾损害,且既往激素联合CTX/MMF治疗肾脏损害进展、皮疹仍反复发作,即治疗无效,故可排除此类疾病可能。(2)急、慢性感染性疾病,如丙型肝炎相关性肾损害、乙型肝炎相关性肾损害、亚急性心内膜炎等,本例患者乙肝及丙肝检查均阴性,无亚急性心内膜炎相关表现,故不考虑此类疾病。(3)血液系统疾病,如血小板减少性病变血栓性血小板减少性紫癜、特发性血小板减少性紫癜均可累及肾脏,但本例患者并无血小板减少;也无淋巴细胞或粒细胞异常,不符合淋巴瘤、白血病肾损害;肾组织刚果红染色阴性,偏振光下无典型的苹果绿双折光,不符合肾淀粉样变性;患者肾组织在高倍电镜下电子致密物为晶格状而非中空微管状结构,故排除IgA型免疫管状肾小球病;本例患者血清M蛋白阳性(λ-IgA),且与肾组织免疫荧光染色(IgA++,轻链λ ++、κ阴性)相一致,故病理诊断为伴单克隆λ-IgA沉积的膜增生性肾炎。
伴单克隆免疫球蛋白沉积的增殖性肾炎是一类由单克隆免疫球蛋白沉积于肾组织,临床以肾功能不全、尿检异常、病理以增生性肾小球肾炎(MPGN、MSPGN等)为主要特征的疾病,包括IgG和非IgG(IgA、IgM)沉积。诊断标准:(1)增生性肾小球肾炎;(2)肾组织免疫荧光染色可见单克隆Ig及单克隆轻链沉积于系膜区和血管袢;(3)电镜下见电子致密物沉积;(4)排除冷球蛋白血症肾损害和单克隆免疫球蛋白沉积病[1]。
伴单克隆IgA沉积的肾小球肾炎少见,自1980年Dosa等[2]首次报道至今共有21例关于本病的报道,2017年Vignon等[3]发表在《Kidney Int》上的临床研究是其中病例数最大的,包括了12例患者,其中有1例伴有皮肤反复紫癜症状。
IgA肾病和Henoch-Schönlein紫癜性肾炎(HSPN)都与含有IgA的免疫复合物的肾小球沉积有关。IgA被认为是带负电荷的,主要是λ型,但很少以单克隆形式存在。免疫球蛋白IgA分IgA1和IgA2二个亚类,以往研究表明沉积于肾小球系膜区的IgA主要为IgA l,通过自聚或形成免疫复合物沉积于系膜区,进而刺激系膜细胞增殖、分泌系膜基质、细胞因子、趋化因子、生长因子,导致肾小球炎症反应。而在少数伴单克隆IgA沉积的肾小球肾炎病例中有描述IgA2沉积物或非低半乳糖基化的高度酸性IgA1沉积物,Birchmore等[4]认为此类患者的免疫清除能力被大量的单克隆IgA以及沉积在肾小球和皮肤毛细血管的副蛋白所占据,进而激活补体,引起组织损伤。本例患者骨髓FISH检测提示存在IgH断裂重排伴缺失,也提示本病与浆细胞克隆性疾病有关;而伴有C3沉积则可能机制为部分单克隆免疫球蛋白可能模拟补体调节蛋白或C3转化酶抗体,进而激活补体旁路途径,导致补体旁路途径的补体成分沉积于肾脏[5]。
在临床特征、组织学及病理生理学特点上,伴单克隆IgA沉积的肾小球肾炎与伴多克隆IgA沉积的IgAN或HSPN有着显著差别。综述既往研究可以发现,本病男性更多见(占14/21,66.7%),中位年龄40岁,主要临床表现为蛋白尿、血尿及肾功能不全,近半数患者血或尿中可以检测到单克隆IgA(9/21,42.9%);大多数患者没有肾外表现,但据报道有两例同本例患者类似出现间断皮肤紫癜[2,4,6-10];Marguerite的研究[1]中比较了本病与IgA肾病的区别,伴单克隆IgA沉积的肾小球肾炎患者年龄更大(55岁vs37岁,P<0.0001)、蛋白尿更严重(4.25 g/Lvs1.4 g/L,P<0.000 1)、血白蛋白更低(34 g/Lvs37.8 g/L,P=0.037)、IgA更低(5.1 g/Lvs8.0 g/L,P=0.002)、肾存活率更低(P=0.049)。IgA肾病中IgA沉积的局限于肾小球系膜区和毛细血管壁,HSPN中还会累及到脉管系统,IgG阳性率为20%~50%,MPGN罕见,新月体比例低(35%);伴单克隆IgA沉积的肾小球肾炎肾脏病理光镜以系膜增生肾炎(12/21,57.1%)和MPGN(8/21,38.1%)为主,多伴有新月体(71%),免疫荧光为局限于肾小球的单克隆IgA沉积于肾小球系膜区及血管袢(通常伴有C3沉积,11/14),轻链染色呈单克隆表达:Kappa(12/21,57.1%)或Lambda(9/21,42.1%),电镜下见电子致密物无序沉积。
2012年国际肾脏与单克隆免疫球蛋白病研究组(International Kidney and Monoclonal Gammopathy Research Group,IKMG)提出MGRS的概念用以描述符合意义未明的单克隆免疫球蛋白血症(MGUS)诊断标准,同时发现肾脏损害,且肾活检免疫荧光检测有单克隆免疫球蛋白沉积的病例[11]。在此之前此类疾病没有没有得到临床医师的正确认识和处理,部分血液科医师对MGRS患者的治疗态度不积极,进而治疗不及时、不充分。M蛋白累及肾脏会导致肾功能受损、移植肾复发,增加病死率,影响患者预后,因此当肾脏病患者出现M蛋白,明确二者是否有因果关系对于制定治疗决策及判断预后都具有重要意义[12]。
尽管本病与IgA肾病、HSPN差别明显,但仍有约30%伴IgA沉积单克隆免疫球蛋白沉积的增生性肾小球肾炎(PGNMID)起病初误诊为IgAN,而在误诊的患者中多是没有及时进行血液学检查与监测。本病合并血液系统恶性肿瘤并不常见,但敏感的血清学和骨髓学检查提示大多数患者存在微小的浆细胞增殖[1]。有学者认为皮肤紫癜可以是MGUS的起始表现[4],本例患者以反复发作性双下肢皮肤紫癜为特征,且肾活检曾诊断为HSPN,故在疾病进展过程中需监测血液学检查。
治疗上,伴单克隆免疫球蛋白IgA沉积的膜增性肾小球肾炎本质上属于浆细胞病范畴,治疗的目的在于控制克隆性增殖进而阻止肾脏疾病的进展。从药物疗效及耐受性来看,基于硼替佐米的治疗方案似乎是最优的选择。既往文献中也有报道应用利妥昔单抗治疗本病,但获益并不明显。而老药沙利度胺2010年出现重大研究突破:研究者们发现沙利度胺能够改变T细胞和B细胞的功能,进而达到治疗各种血液系统恶性肿瘤的作用。本例患者因经济条件限制,且考虑内皮增生明显伴较多炎性细胞浸润,先给予甲泼尼龙冲击(0.5g×3d),后续给予泼尼松+沙利度胺(TD)方案化疗。但本例患者沙利度胺治疗效果欠佳,后续在当地医院予硼替佐米治疗后疾病得到明显缓解。此类疾病治疗完全缓解是指尿蛋白定量<500 mg/d且肾功能正常,部分缓解则是指尿蛋白定量减少超过50%且<2 g/d且肾功能稳定[13]。
小结:该患者为国内首例伴单克隆λ-IgA沉积的膜增生性肾小球肾炎,伴反复皮肤紫癜。该病的临床特征、组织病理学均与IgA肾病、HSPN不同,治疗方案的选择及预后差别明显。临床上碰到此类患者除了血、尿检查及肾活检等,需完善血液系统相关检查和肾组织游离轻链染色。需针对浆细胞病进行治疗。
