超声内镜在食管癌多学科综合治疗中的临床应用价值分析
2019-10-21
(安阳肿瘤医院,河南 安阳 455000)
准确的临床分期是食管癌患者获得最佳治疗方案的前提。分期过高可能导致部分患者失去微创手术的治疗机会,分期过低又可能导致手术姑息切除或切除范围过小,影响预后。CT、超声内镜(endoscopic ultrasound,EUS)、PET-CT是食管癌临床分期的主要方法。国内外学者一致认为,CT联合EUS可提高食管癌单独CT或EUS分期的准确率[1-4],但其对治疗方案、手术结果及预后的影响,以及患者是否临床获益,国外争议较大[5-11],国内文献尚未见类似报道。本研究在评估超声内镜对食管癌术前T、N分期准确性的同时,进一步分析其对食管癌治疗方案、手术结果的影响,为超声内镜术前合理使用提供循证学证据。
1 资料与方法
1.1 一般资料
选取2015年1月—2018年5月安阳肿瘤医院初诊食管癌鳞状细胞癌患者750例。术前常规行白光胃镜、头/胸/腹部CT或MRI、颈部彩超、骨扫描等检查进行准确cTNM分期,按电脑随机抽签法决定是否行EUS检查,分为CT-EUS组362例和单独CT组388例。CT-EUS组行微创食管癌切除术(minimally invasive esophagectomy,MIE)/内镜下黏膜切除术(endoscopic mucosal resection,EMR)284例。其中,T1期15例,T2期116例,T3期153例,N0期191例,N1~N3期93例;CT-EUS组另行新辅助治疗78例。单独CT组行MIE/EMR手术321例。其中,T1期21例,T2期127例,T3期173例,N0期215例,N1~N3期106例;单独CT组另行新辅助治疗67例。MIE采用胸腔镜McKeown术式。
1.2 纳入标准及排除标准
纳入标准:术前病理确诊为食管癌;机体功能状态评分(KPS)≥60分;家属或患者知情同意。排除标准:证实有远处转移患者;年龄≥75岁,合并心、肺功能不全等手术禁忌证;EUS或CT前行新辅助放/化疗。
1.3 EUS
超声内镜为UM 2000超声内镜(日本Olympus公司),探头频率5.0、7.5、12.0和20.0 MHz之间可互相转换,360°旋转环扫;Olympus GIF-XQ260电子胃镜,超声小探头采用Olympus UM-2R、Olympus UM-DPl2-25R,探头频率为 12.0 MHz。
1.4 检查方法
1.4.1 EUS术前常规禁饮禁食 6 ~ 8 h,检查前 5 ~10 min口服盐酸利多卡因胶浆10 ml或静脉注射丙泊酚行基础麻醉,同时给予心电和血氧饱和度监测。体位左侧卧位。UM-2000 EUS食管部采用水囊法,胃部采用无气水充盈法。扫描内容包括食管肿瘤浸润食管各层次的情况,以及是否侵犯周围组织、食管区域淋巴结及腹腔干旁淋巴结。
1.4.2 CT采用 64 排 Lightspeed VCT(美国 GE 公司)扫描参数 120 KVP,80 ~ 150 MA,患者术前 6 h 禁食,经肘前静脉注射碘佛醇等造影剂,对所有患者进行胸部至上腹部增强扫描,由影像科2位副高职称医师进行双盲法进行阅片,统一评价并详细记录肿瘤部位、大小、淋巴结数目及大小,以及有无转移情况,出现分歧时通过协商一致作为最终结果。
1.5 TNM分期标准
临床分期及病理分期参照UICC/AJCC第8版食管癌TNM分期标准。
1.5.1 EUS分期诊断标准 食管癌表现为不规则均质低回声区,并有食管壁层次结构的破坏。按浸润深度分为:T1,肿瘤侵犯黏膜或黏膜下层,超声1、2、3层破坏,4层完整光滑(肿瘤侵犯黏膜固有层或黏膜肌层为T1a;肿瘤侵犯黏膜下层为T1b);T2,肿瘤侵犯食管肌层,超声4层不规则增厚,第5层光滑完整;T3,肿瘤侵犯食管外膜,第5层断裂、突出、不规则;T4,肿瘤侵犯邻近脏器,分界不清(肿瘤侵入相邻结构如胸膜、心包膜、奇静脉、膈肌或腹膜为T4a;肿瘤侵入主要相邻结构,例如主动脉、椎体或器官为T4b)。
1.5.2 恶性淋巴结判断标准短径 >5 mm,短径与长径的比值>1/2,或最大径>1 cm,且形态椭圆形、边界清晰、内部回声不规则。当有1个及1个以上淋巴结符合上述标准时即为N1;无淋巴结符合上述标准时为N0期。
1.5.3 CT分期诊断标准 T1期:食管腔内肿块或轻度管壁厚度≤ 5 mm;T2期:管壁增厚 >5~<10 mm,无外侵;T3期:管壁增厚≥10 mm;T4期:管壁增厚伴外侵。转移淋巴结诊断标准:淋巴结最大直径≥10 mm即为N1期;反之为N0期。
1.6 观察指标
EMR使用率、新辅助治疗使用率、R0切除率、中转开胸率、术中出血及气管损伤率。
1.7 统计学方法
数据分析采用SPSS 25.0统计软件。计量资料以均数±标准差(±s)表示,比较采用t检验,计数资料以率(%)表示,比较采用χ2检验或Fisher's检验。评价EUS、CT和手术病理一致性检验采用Kappa值,以0.4<κ≤0.6为一致性水平中等,以0.6<κ≤0.8为一致性水平好,以κ>0.8为一致性非常好。P<0.05为差异有统计学意义。
2 结果
2.1 CT、CT-EUS检查与病理T分期结果比较
CT对食管癌术前T分期的准确率为67.0%,CTEUS的准确率为83.5%,差异有统计学意义(χ2=21.641,P =0.000)。与术后病理证实T分期结果比较,CT一致性检验水平中等(κ=0.434),CT-EUS一致性检验水平好(κ=0.703)。见表1、2。
2.2 两种检查方法对食管癌术前N分期结果分析
CT对食管癌术前N分期的准确率为75.1%,CTEUS为85.6%,差异有统计学意义(χ2=10.354,P =0.001)。与术后病理N分期结果比较,CT一致性检验水平中等(κ=0.414),CT-EUS一致性检验水平好(κ=0.662)。见表3、4。
2.3 CT、CT-EUS检查与病理N分期结果比较
单独CT组诊断T1期21例,15例考虑T1a行EMR治疗,EMR使用率为71.4%(15/21),10例患者经过EMR治疗达到肿瘤根治要求,5例患者因病变侵及黏膜下层加做MIE手术,6例患者考虑T1b未行EMR治疗。CT-EUS组EMR使用率为40.0%(6/15),6例患者经EMR治疗均达到根治要求未加做MIE手术,9例考虑为T1b未行EMR治疗。与单独CT组比较,CT-EUS组中转开胸率、气管损伤率和术中出血率低,R0切除率高,差异有统计学意义(P<0.05),CT-EUS组较单独CT组EMR率低,新辅助治疗率高,但差异无统计学意义。见表5。

表1 食管癌术后病理CT与术前CT T分期结果

表2 食管癌术后病理CT与术前CT-EUS T分期结果

表3 食管癌术后病理CT与术前CT N分期结果

表4 食管癌术后病理CT与术前CT-EUS N分期结果
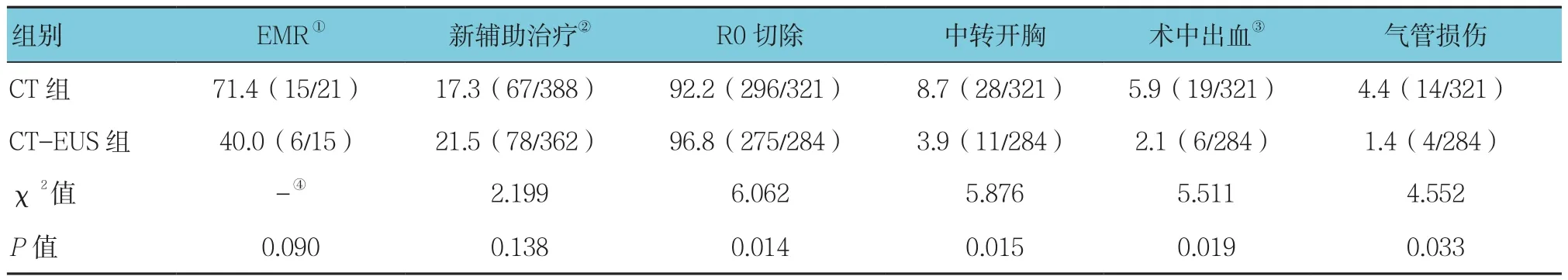
表5 两种检查方法对食管癌治疗的影响 %
3 讨论
3.1 EUS在食管癌T、N分期中的临床价值
CT根据肿瘤所在食管壁的厚度判断浸润深度,并根据瘤体与周边组织的毗邻关系判断是否外侵,对局部晚期(T3、T4)病变具有较高的准确性、特异性[11],但对早期病变准确性不高,且难以准确对T1a与T1b进行分期、诊断,而这对食管癌选择EMR治疗至关重要[1]。EUS利用超声波回声特征判断肿瘤侵犯深度,不仅可对 T1a、T1b进行准确的亚分期[1,4,12],并且对T4a、T4b期病变也有着较高的准确性[3-4]。由于约30%局部晚期病变存在严重食管管腔狭窄,EUS无法进镜或仅能对部分瘤体分期[5,10],CT与EUS联合使用,优势互补,可显著提高食管T分期的敏感性、准确性及特异性[4,13]。本研究结果显示,CT联合EUS提高食管癌T1~T4期分期准确性,CT联合EUS组准确度83.5%,高于单独CT组67.0%。
CT根据直径大小来判断淋巴结是否转移,其中以淋巴结最大径≥1 cm为阳性标准被临床工作者广泛使用,有学者以此标准判断淋巴结转移,敏感性为61.1%,特异性为71.4%,而准确性仅有65.6%[14]。EUS不仅可准确探查出直径低至0.3 cm淋巴结,而且可根据淋巴结大小、形态、回声特点等来判断淋巴结是否转移,具有较高的敏感性、阳性预测值和阴性预测值[3],但特异性不高[4],且难以探查到颈部、锁骨上、腹腔干旁淋巴结[2]。高清多排螺旋CT对直径0.5 cm以上淋巴结具有较高的敏感性[15],可对食管癌引流区域淋巴结进行整体勾画、筛查及诊断,针对可疑淋巴结,EUS-FNA可获得组织病理学诊断,显著提高N分期诊断特异性[1,5,13]。本研究结果显示,单独CT组根据淋巴结最大径大于1.0 cm来判断淋巴及是否转移,准确率仅为75.1%,而CT-EUS的准确率达到86.4%。
3.2 EUS评估食管癌微创治疗
根据食管癌规范化诊疗指南,对T1aN0M0期患者,内镜下黏膜切除术完全可实现根治性治疗,5年生存率达95%以上[16]。研究发现,T1a期淋巴结转移风险为6%~10%,而侵入黏膜下层(T1b)的淋巴结转移率骤增加至19%~23%[17],因此术前准确对T1a与T1b分期是选择EMR治疗的前提。THOSANI等[12]对19项国际研究(12项前瞻性研究,7项回顾性研究)、1 019例T1期食管癌患者进行Meta分析,EUS对T1a和T1b分期的敏感性、特异性均达到86%以上。由于CT、PET无法对食管癌分层诊断,因此EUS成为早期患者选择内镜治疗必要检查。本研究结果提示CTEUS组EMR使用率偏低,考虑为EUS对T1期病变分期更加准确,将T1b期食管癌患者准确地纳入MIE治疗的结果。CT组不能准确对T1a、T1b分期,更激进使用EMR手术,因此单独CT组EMR使用率偏高。单独CT组有5例患者因病变侵及黏膜下层而进一步行微创食管癌切除术,CT联合EUS可减少早期食管癌患者不必要的EMR治疗。
微创食管癌切除术的手术适应证建议为T3N1M0分期以下,而对T4期或存在明显淋巴结转移(N2)的食管癌患者,新辅助化疗或放化疗可提高R0切除率、降低手术风险,延长生存时间[18]。CT-EUS较单独CT显著提高T3、T4分期的准确性,能够降低姑息手术切除率、提高新辅助治疗使用率[8]。有学者研究认为,单独CT后再行EUS检查,可改变约30%患者的治疗决策[6,9],延长患者生存时间[11]。本研究结果显示,EUS将更多的T3患者列入T4期而选择新辅助治疗,降低晚期食管癌患者比例,提高了R0切除率,降低中转开胸率、术中出血率及气管损伤率。而单独CT组进行T分期时术者主观性更大,更激进将T4期患者纳入T3期行微创食管癌切除术,作者认为T3期食管癌是新辅助治疗指征之一,将部分疑似T4期的T3期病变纳入新辅助治疗组,因而CT-EUS组较单独CT组新辅助治疗率高,但未达到统计学意义。
3.3 EUS在食管癌T、N分期的局限性
大多数食管癌患者就诊时已处于中晚期,其中约30%患者因食管严重狭窄无法进行EUS检查,或仅能对部分瘤体分期,同时伴随着出血和穿孔风险[10]。根据中国食管癌规范化诊疗最新指南,T3或T4期病变,均建议新辅助治疗,故无须准确判断T3与T4,EUS额外使用对治疗方案选择影响有限[5,7,10]。本研究同样得出类似结果。EUS虽然对淋巴结诊断具有较高的敏感性,但特异性不高,对颈部、锁骨上、腹腔干旁淋巴结难以探测[3],EUS-FNA虽然可提高淋巴结分期特异性,但检查费时,操作复查,存在一定并发症,使用率使用普遍低于20%[6]。WESTERTERP等[19]研究发现,EUS较US、CT、PET更容易引起患者焦虑与不适,成为患者拒绝EUS检查主要原因。多种因素分析,肿瘤位置、形态,EUS探针的频率及使用方法,以及内镜检查者的经验都会影响EUS的诊断准确性[12]。
综上所述,CT联合EUS可提高食管癌T、N分期的准确性,但对早期及晚期食管癌治疗决策影响有限。在排除远处转移情况下,EUS应作为早期食管癌常规术前检查手段,可减少不必要的EMR手术,但EUS在晚期食管癌临床价值需要进一步大样本、前瞻性、多中心研究证实。
