大麦品种扬农啤5号的黄花叶病抗性QTL定位
2019-10-21潘雨涵沈会权郭宝健王菲菲许如根
徐 肖,潘雨涵,沈会权,吕 超,郭宝健,王菲菲,许如根
(1.扬州大学江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室/扬州大学大麦研究所,江苏扬州 225009; 2.江苏沿海地区农业科学研究所,江苏盐城 224001)
由大麦黄花叶病毒(BaYMV)和大麦温和花叶病毒(BaMMV)引起的大麦黄花叶病主要危害中国冬大麦生产。BaYMV和BaMMV于冬季通过土壤禾谷多粘菌侵入大麦根部,再随水分运输至植株叶片,春季在叶片内增殖破坏大麦叶片的叶绿体,使叶片呈现黄色花斑。不同大麦品种对病毒的抗性不同,病毒在叶片增殖的速度及破坏的程度不同,叶片的黄化程度也不同,叶片黄化会降低叶片的光合能力,削弱植株长势,使植株矮化甚至死亡。大麦黄花叶病不但影响大麦产量,而且会降低籽粒品质[1]。选育和推广抗病新品种是防止大麦黄花叶病危害的最经济有效方法。大麦黄花叶病抗性基因来源广泛,遍及大麦的7条染色体。已报道的大麦黄花叶病抗病基因有18个,仅Rym14Hb、Rym16Hb、Rym17为显性基因,其他均为隐性抗病基因。其中,Rym14Hb和Rym16Hb来自于球茎大麦,分别位于6HS上和2HL末端,它们对欧洲病毒株系BaMMV、BaYMV-1及BaYMV-2[2-3]均具有抗性。位于3号染色体的Rym17来自于巴基斯坦的野生六棱大麦品种PK23-2,抗病基因rym18位于该品种的4号染色体,Rym17和rym18均能抗日本病毒株系BaYMV-Ⅰ和BaYMV-Ⅲ[4]。位于4号染色体长臂的rym1来自于抗病品种木石港3号[5],高抗日本病毒株系BaYMV-Ⅰ、BaYMV-Ⅱ、BaMMV-Nal及BaMMV-Kal,中抗BaYMV-Ⅲ,对欧洲所有病毒株系均表现免疫[6-7]。位于7号染色体的rym2来自于日本抗病品种Mihori Hadaka 3[8],高抗欧洲病毒株系BaMMV、BaYMV-1和BaYMV-2[9]。位于5H短臂的rym3来自于诱变材料Ea52[10],高抗日本病毒株系BaYMV-Ⅰ、BaYMV-Ⅱ和BaYMV-Ⅴ,高感BaMMV[11]。位于3HL的rym4和rym5是一对等位基因[12],rym4来自于克罗地亚的地方品种Ragusa[13-14],抗欧洲病毒株系BaYMV-1和BaMMV,对BaYMV-2表现感病[15];rym5来自于大麦品种Misato Golden[16],对日本病毒株系BaYMV-Ⅰ、BaYMV-Ⅱ、BaYMV-Ⅳ和BaYMV-Ⅴ均具抗性[17]。位于3HL的rym6和rym10也是一对等位基因,rym6来自于抗病品种AmagiNijo,仅抗日本病毒株系BaYMV-Ⅱ,感欧洲BaYMV和BaMMV所有病毒株系[18];rym10来自于德国抗病品种Heberna[19],高抗欧洲病毒株系BaYMV-1和BaYMV-2[20]。位于1HS的抗病基因rym7,抗欧洲BaMMV病毒株系[21]。位于4号染色体长臂的端粒区的抗病基因rym8、rym9、rym12和rym13,rym8来自南斯拉夫大麦品种10247,抗欧洲BaYMV-1和BaMMV株系[22];rym9来自抗病材料Bulgarian 347[23],仅抗欧洲BaMMV病毒株系[22];rym12来自于韩国抗病品种Muju covered 2,高抗欧洲所有病毒株系[24];rym13来自于台湾抗大麦黄花叶病品种Taihoku A,抗欧洲所有病毒株系[25-26]。位于4HL的rym11抗欧洲所有病毒株系[24]。位于6HS的rym15抗欧洲病毒株系BaYMV-1、BaYMV-2和BaMMV[27]。
我国长江中下游地区是大麦黄花叶病的高发区,寄主和病原菌相互作用,协同进化,不断产生新的病毒株系,导致育成品种抗性降低,严重影响大麦产量与品质。因此,引入新的抗病基因、提高品种的抗病性是当务之急。扬农啤5号是扬州大学大麦研究所2005年育成的优质高产多抗啤酒大麦品种,在江苏等省广泛推广,对大麦黄花叶病抗性稳定。本研究以扬农啤5号和感病品种日引3号构建的重组自交系(Recombinant indred lines, RIL)群体为材料,进行抗性QTL定位,以期挖掘出新的抗病基因,为培育高抗优质大麦新品种奠定基础。
1 材料与方法
1.1 供试材料
以大麦黄花叶病高抗品种扬农啤5号和感病品种日引3号构建的253个重组自交系F6群体及亲本为材料,所有材料均由扬州大学大麦研究所提供。
1.2 田间种植
分别于2013年、2014年和2015年秋季将参试材料种植于扬州大学大麦黄花叶病病圃,采用随机区组设计,每个材料种植1行,行长1.2 m,行距0.2 m,每行点播40粒,3次重复。
1.3 抗性鉴定
在大麦黄花叶病发病初始阶段对参试材料抗病性进行调查和鉴定,每个材料连续调查10株,每隔7 d调查1期,连续调查3期。调查时期:2014年:2月22日、3月1日和3月8日;2015年:3月3日、3月10日和3月17日;2016年:3月1日、3月8日和3月15日。
参照黄培忠等[28]的标准进行病情分级和抗性级别判定。
1级(高抗)—叶片呈正常绿色,无病斑;
2级(抗病)—叶片叶色基本正常,有黄花斑点,但斑点未连成线;
3级(感病)—叶片病斑的斑点连成线,叶片黄化,但植株不矮化;
4级(高感)—叶片出现大片黄花病斑,叶片黄化,植株萎缩、矮化甚至死亡。
选取病程梯图下面积作为主要病情评价指标。
病程梯图下面积(Area Under the Disease Progress Stairs,AUDPS):将多期病害调查值联合起来,更准确的评估病害的发病程度,AUDPS值越大,说明该品种(系)发病的严重度高、持续时间长。病程梯图下面积计算公式:
其中,n为总调查次数,xi为第i次调查严重度,ti为第i次调查的时间。
1.4 多态性SSR标记的筛选与RIL群体基因型分析
采用CTAB法[29]提取亲本及重组自交系叶片的DNA。采用PCR技术和凝胶电泳技术,从1 176对大麦SSR引物中筛选亲本间多态性SSR标记,利用筛选获得的SSR标记对RIL群体进行基因型分析。参照郝晨阳等[30]的方法进行PCR和银染。供筛选的1 176对大麦SSR引物中,31对GBM系列引物序列由德国IPK研究所提供,其余1 145对引物序列均为查询Graingenes 2.0数据库(https://wheat.pw.usda.gov/GG3/)获得,由华大基因公司合成。
1.5 群体遗传连锁图谱的构建
通过JoinMap 4.0软件构建RIL群体遗传连锁图谱。
1.6 QTL定位
根据RIL群体3年9时期的大麦黄花叶病抗性表型,通过QTL IciMapping 4.0软件完备区间-加性模型(ICIM-ADD)定位抗性QTL,将LOD值设定为2.5,计算每个QTL的贡献率和加性效应,参考Philn等[31]的方法命名QTL。
2 结果与分析
2.1 亲本及RIL群体大麦黄花叶病抗性表现
由表1可知,在2014—2016年的9个调查时期内,扬农啤5号的大麦黄花叶病病级均为1级左右,表现为高抗,日引3号的病级均在3级左右,表现为感病。t测验显示,亲本间大麦黄花叶病抗性差异均达极显著水平。9个时期群体病级均值均介于双亲之间,并未出现超亲或低亲遗传。RIL群体内变异系数均大于15%,说明RIL群体内大麦黄花叶病存在广泛变异。

表1 亲本及RIL群体病级的平均表现Table 1 The performance of population and parents to thedisease
**表示亲本间在0.01水平上差异显著。
** mean significant differences between Yangnonppi 5 and Riyin 3 at 0.01 level.
2.2 RIL群体的大麦黄花叶病抗性表现
2014—2016年RIL群体的AUDPS值均呈连续性分布,表明RIL群体的大麦黄花叶病抗性为数量性状,符合QTL分析要求。由表2可知, 2014年RIL群体的AUDPS均值为28.53,远小于2015年和2016年,说明2014年RIL群体大麦黄花叶病的发病程度整体上轻于2015年和2016年;另外,分析RIL群体AUDPS值的变幅可知,不同年份间RIL群体大麦黄花叶病抗性均存在一定的差异,但基本介于双亲之间,重发病年份有少量的RIL系发病严重程度超过感病亲本。
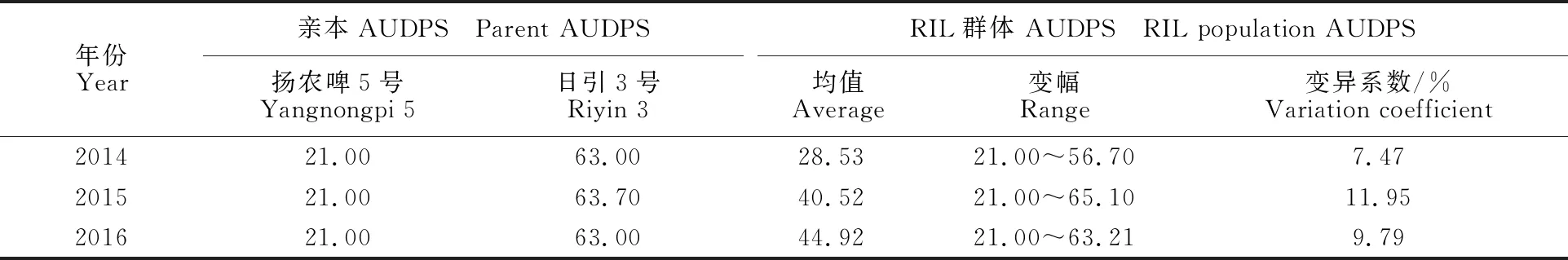
表2 亲本及RIL群体的AUDPS值表现Table 2 The AUDPS performance of population and parents to the disease
2.3 RIL群体遗传连锁图谱的构建
从1 176对大麦SSR引物中筛选获得108对在双亲间具有多态性的标记,采用108对SSR标记对RIL群体进行基因型分析,并通过JoinMap 4.0软件构建RIL群体遗传连锁图谱(图1),发现该遗传连锁图谱全长1 065.13 cM,标记间的平均距离为9.86 cM。在大麦7条染色体上的分子标记数均不相同,其中2H的标记数最多,3H的标记数最少,两者分别有27个和8个(表3);同时,连锁图中一些标记间的距离仍较大,在今后的研究中还需进一步加密标记。
2.4 大麦黄花叶病抗性的QTL定位
根据RIL群体在2014—2016年9个时期的黄花叶病抗性结果,采用QTL IciMapping 4.0软件完备区间-加性模型(ICIM-ADD)定位抗性QTL,结果共检测到6个大麦黄花叶病抗性QTL(表4)。其中,1个QTL位于1H顶端,介于标记区间ABC156B~UMB506,命名为qRYM-1H;3个QTL位于2H上,分别介于标记区间EBmac0640~Bmag0744、GBM1309~EBmac0415和Bmag0745~EBmag0722,命名为qRYM-2Ha、qRYM-2Hb和qRYM-2Hc;1个QTL位于5H末端,介于标记区间MGB357~CFE228,命名为qRYM-5H;1个QTL位于7H顶端,介于标记区间Bmag0007~Bmag0206,命名为qRYM-7H。其中,qRYM-2Ha在2014-02-22、2016-03-08、2016-03-15三个时期均被检测到;qRYM-2Hb在所有时期均被检测到,说明这2个QTL稳定性好。qRYM-2Ha和qRYM-2Hb分别可解释 5.00%~ 10.88%和5.70%~14.64%的表型变异,其他4个QTL均只检测到1次,是否真实存在尚需进一步检测。所有QTL的加性效应均为负值,表明该群体的大麦黄花叶病抗性基因均来自母本扬农啤5号。

表3 分子标记在大麦染色体上的分布Table 3 The distribution of markers on different chromosomes of barley
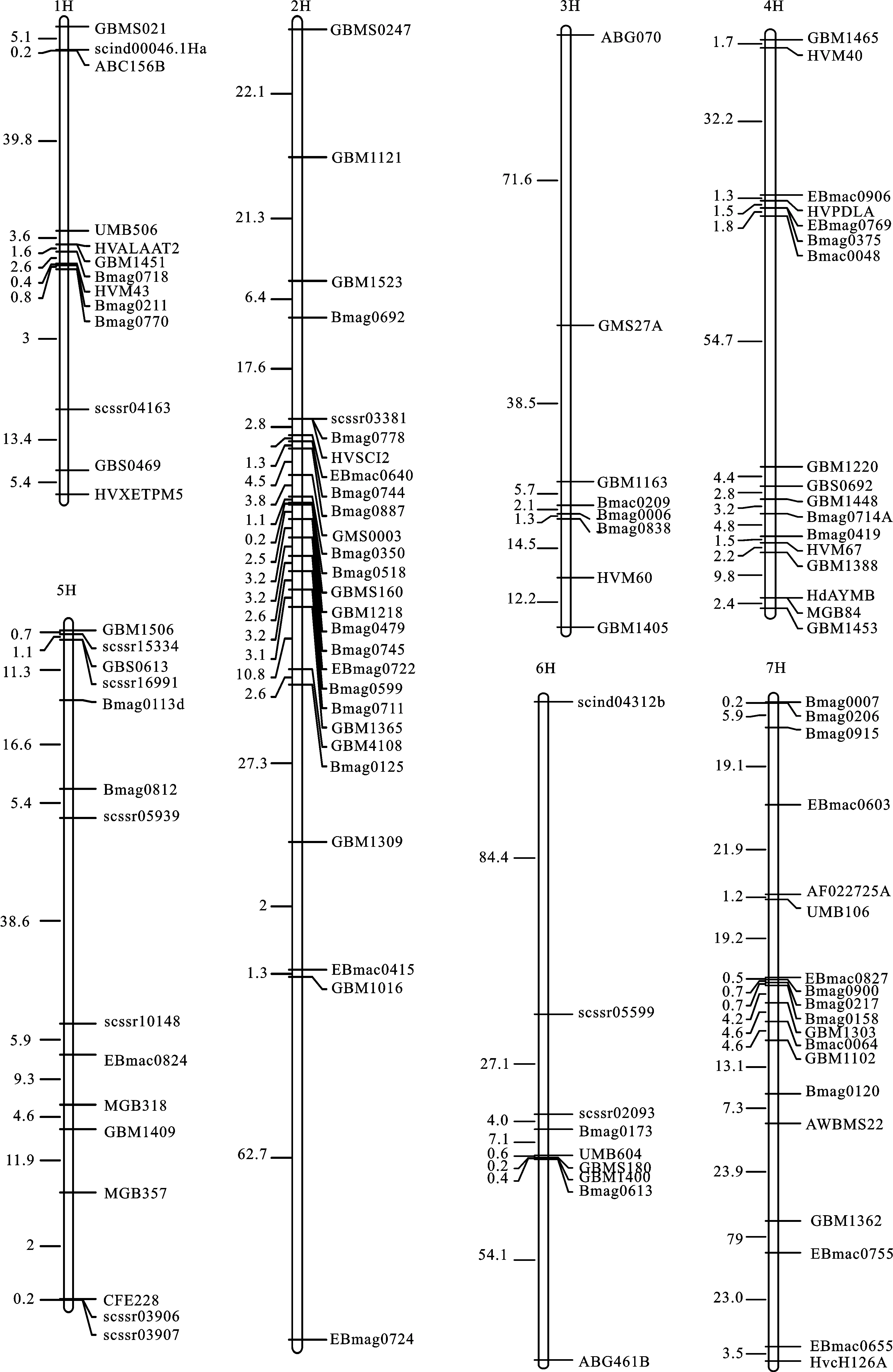
图1 大麦RIL群体遗传图谱Fig.1 Linkage map of RIL lines表4 大麦黄花叶病抗性的QTL在染色体上的位置及效应分析Table 4 The positions of QTL and analyses of effects for resistance to barley yellow mosaic disease
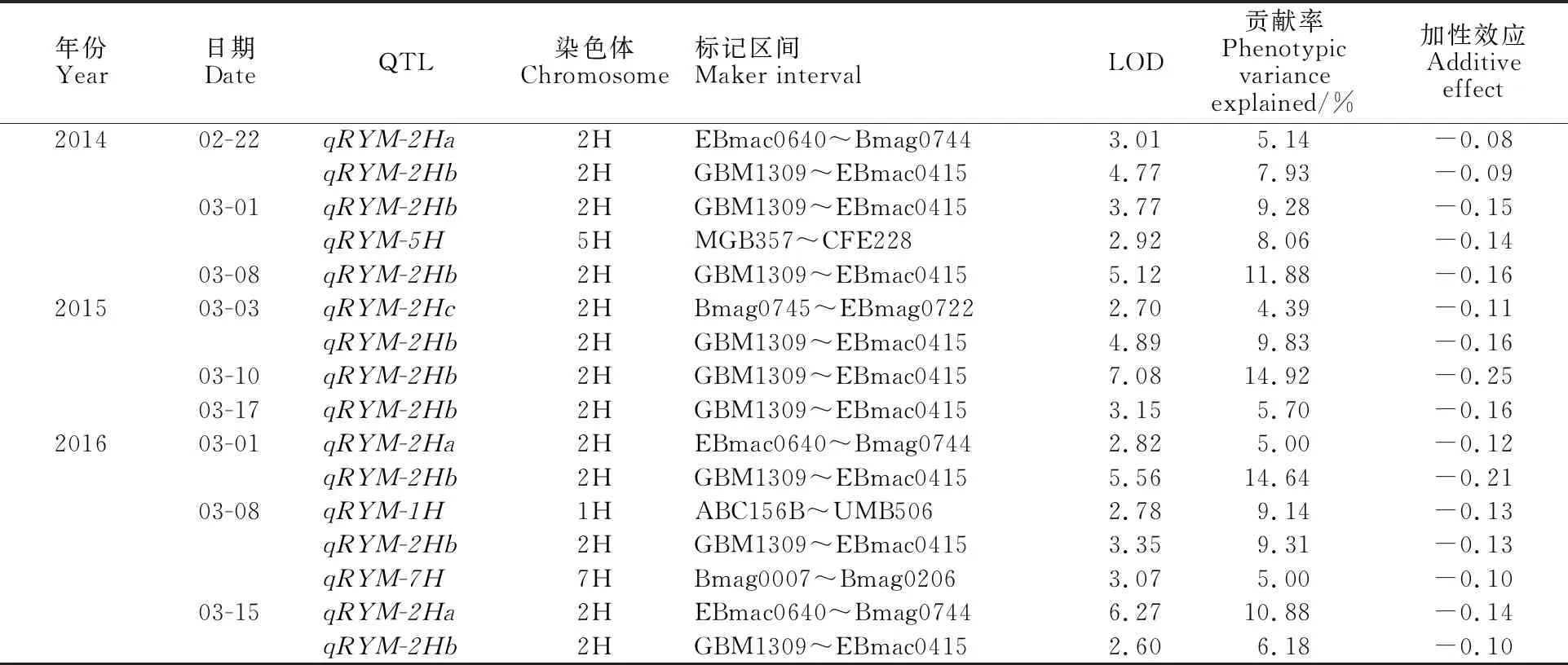
年份Year日期DateQTL染色体Chromosome标记区间Maker intervalLOD贡献率Phenotypicvariance explained/%加性效应Additive effect201402-22 qRYM-2Ha2HEBmac0640~Bmag07443.015.14-0.08 qRYM-2Hb2HGBM1309~EBmac04154.777.93-0.0903-01 qRYM-2Hb2HGBM1309~EBmac04153.779.28-0.15qRYM-5H5HMGB357~CFE2282.928.06-0.1403-08 qRYM-2Hb2HGBM1309~EBmac04155.1211.88-0.16201503-03 qRYM-2Hc2HBmag0745~EBmag07222.704.39-0.11 qRYM-2Hb2HGBM1309~EBmac04154.899.83-0.1603-10 qRYM-2Hb2HGBM1309~EBmac04157.0814.92-0.2503-17 qRYM-2Hb2HGBM1309~EBmac04153.155.70-0.16201603-01 qRYM-2Ha2HEBmac0640~Bmag07442.825.00-0.12 qRYM-2Hb2HGBM1309~EBmac04155.5614.64-0.2103-08qRYM-1H1HABC156B~UMB5062.789.14-0.13 qRYM-2Hb2HGBM1309~EBmac04153.359.31-0.13qRYM-7H7HBmag0007~Bmag02063.075.00-0.1003-15 qRYM-2Ha2HEBmac0640~Bmag07446.2710.88-0.14 qRYM-2Hb2HGBM1309~EBmac04152.606.18-0.10
3 讨 论
3.1 扬农啤5号大麦黄花叶病抗性基因位点的数量与效应
本研究中RIL群体的6个大麦黄花叶病抗性QTL均来自于抗性亲本扬农啤5号,分别位于染色体1H、2H、5H和7H。其中,表现稳定的位点qRYM-2Ha和qRYM-2Hb均位于大麦染色体2H,分别位于染色体2H的70 cM与160 cM。抗病基因Rym16Hb位于大麦2号染色体长臂末端,与RFLP标记MWG949紧密连锁,本研究检测到的qRYM-2Hb与Rym16Hb位置相近[2],可能是一对等位基因,但尚需进一步验证。qRYM-2Ha位点附近尚没有大麦黄花叶病抗性基因报道,可能是一个新的抗性位点,这为该大麦黄花叶病抗性新基因的发掘、精细定位及克隆奠定了 基础。
3.2 大麦黄花叶病抗性表型鉴定与抗性基因位点的稳定性
大麦黄花叶病抗性主要受遗传因素控制,不同年份、不同地点的温度、湿度及土壤中黄花叶病病毒的株系类型及数量也直接影响大麦黄花叶病的抗性表现,进而影响大麦黄花叶病抗性基因位点的稳定性。本研究中,在2014—2016年的9个时期共检测到6个大麦黄花叶病抗性QTL,但仅qRYM-2Ha和qRYM-2Hb具有较好的稳定性,其他4个大麦黄花叶病抗性QTL均在某年份或某时期能检测到,因此这4个QTL是否稳定存在,还需进行多年多点鉴定试验。另外,本研究构建的遗传连锁图谱分子标记数目偏少,对大麦黄花叶病抗性基因的定位存在一定的影响,后续研究还需进一步增加分子标记数目。
3.3 扬农啤5号作为亲本利用的前景分析
扬农啤5号是扬州大学大麦研究所以品种如东6109为母本、苏农22为父本杂交选育的优质多抗高产啤用大麦品种,麦芽品质达到国标优级,产量潜力达7 500 kg·hm-2,因其高抗大麦黄花叶病、白粉病,抗倒性强、耐盐性好[32],在江苏、湖北、安徽等省大面积推广,同时扬农啤5号也被广泛用作育种亲本。扬州大学大麦研究所共配制杂交组合110多个,育成综合性状优良品系10多个,其中选自(苏引麦3号/扬农啤5号)组合的苏B0901品系分别于2014年和2015年经江苏和安徽农作物品种审定委员会鉴定为高抗大麦黄花叶病优质高产啤酒大麦新品种扬农啤10号,2017年通过国家非主要农作物品种登记,扬农啤10号正在江苏、安徽等省示范推广[33]。另有来自扬农啤5号亲本组合的品系正在参加鉴定试验,准备登记。
