miRNA-129-5p通过调控肝素结合生长因子对非小细胞肺癌细胞增殖和迁移能力的影响机制研究
2019-10-18滕树炎陈焕文
滕树炎,陈焕文
重庆医科大学附属第一医院胸外科,重庆400060
肺癌是世界上发病率、病死率均最高的恶性肿瘤[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)包括鳞状细胞肺癌、肺腺癌和大细胞肺癌,是肺癌的重要病理分型,占所有肺癌的80%~85%[2]。目前NSCLC的治疗方法有手术、化疗、放疗、靶向治疗和免疫治疗等[3],但由于大多数NSCLC患者诊断时已处于中晚期,临床治疗效果不佳[4],因此对肺癌患者早期诊断及准确预测治疗后病情变化就显得尤为重要。miRNA是一段由18~22个碱基组成的非编码单链RNA,在细胞增殖、凋亡、迁移、侵袭等生物学过程中发挥着重要的调控作用。miRNA在多种肿瘤中差异表达,在肿瘤的发生发展中充当致癌基因或抑癌基因,发挥重要的调控作用[5]。越来越多的研究证实,miRNA与NSCLC细胞的侵袭和转移密切相关。有研究报道,miRNA-129-5p 在胃癌[6]、胶质母细胞瘤[7],食管鳞状细胞癌[8]中表达下调,能够发挥抑癌作用。近年来有研究发现miRNA-129-5p在NSCLC组织中亦表达下调[9],可影响NSCLC细胞的增殖和迁移能力。肝素结合生长因子(heparin binding growth factor,HDGF)是一种具有促分裂活性的肝素结合蛋白,在NSCLC组织中高表达,可影响细胞增殖和侵袭[10-11]、血管生成[12]等生物学过程,表明HDGF在肺癌的发生发展中发挥着重要作用。通过生物信息学分析预测发现HDGF可能是miRNA-129-5p的靶基因,但miRNA-129-5p是否靶向调控NSCLC中HDGF蛋白参与细胞的增殖和迁移过程仍不清楚。因此,本研究旨在研究miRNA-129-5p对NSCLC细胞的增殖和迁移的影响及其可能的分子机制。
1 材料与方法
1.1 组织与细胞
1.1.1 肺癌组织收集2018年3—7月重庆医科大学附属第一医院手术切除并经病理检查确诊为NSCLC的3例NSCLC患者的肿瘤组织(直径约为1cm)和对应的癌旁组织(距肿瘤外缘3cm外的肺组织)石蜡标本,3例患者均为男性,术前均未接受过放化疗。
1.1.2 细胞正常支气管上皮细胞株16-HBE和NSCLC细胞株A549、H460、H1299均购自美国模式菌种收集中心(American Type Culture Collection,ATCC)。所有细胞采用含10%胎牛血清的DMEM培养基于5%CO2、37℃恒温培养箱中培养。
1.2 材料
HDGF干扰RNA(si-HDGF)和对照干扰RNA(si-NC)均由上海生物工程有限公司合成构建。DMEM培养基和胎牛血清均购自美国Invitrogen Gibco公司,CCK-8试剂和胰蛋白酶均购自美国Sigma-Aldrich公司,miRNeasy Mini Kit试剂盒、总RNA提取试剂盒和miRNA实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒均购自德国QIAGEN公司,miRNA-NC、miRNA-129-5p mimics均购自广州锐博生物公司,Cell Lysis Buffer裂解液、结晶紫染色液、蛋白浓度测定试剂盒、蛋白抽提试剂盒及电化学发光(electrochemiluminescence,ECL)试剂盒均购自碧云天生物科技有限公司,HDGF抗体购自武汉博士德公司,pcDNA3.1空载体、HDGF过表达载体pcDNA3.1-HDGF、β-actin抗体、辣根过氧化酶标记的二抗和LipofectamineTM2000均购自赛默飞公司,逆转录试剂盒购自大连宝生物公司,荧光素酶报告基因检测试剂盒购自美国Promega公司,Transwell小室购自美国BD公司。
1.3 实验方法
1.3.1 qRT-PCR检测miRNA-129-5p和HDGF表达采用总RNA提取试剂盒和miRNeasy Mini Kit试剂盒提取16-HBE、H460、A549和H1299细胞的总RNA和miRNA,参照对应的逆转录试剂盒说明书步骤合成cDNA,按qRT-PCR试剂盒的操作步骤分别检测细胞中HDGF和miRNA-129-5p的表达情况。HDGF和U6引物来源于miRNA qRT-PCR试剂盒,HDGF-F:5'-ATCAACAGCCAACAAATACC-3',HDGF-R:5'-TTCTTATCACCGTCACCCT-3';βactin-F:5'-GGACCTGACTGACTACCTC-3',β-actin-R:5'-TACTCCTGCTTGCTGAT-3'。
1.3.2 细胞转染待A549和H1299细胞生长至80%融合度,以适当密度接种至6孔细胞板中,随机分为7组:control组(未转染细胞)、miRNA-NC组(转染miRNA-NC)、miRNA-129-5p mimics组(转染miRNA-129-5p mimics)、si-NC组(转染si-NC)、si-HDGF组(转染si-HDGF)、miRNA-129-5p mimics+NC组(共转染miRNA-129-5p mimics和pcDNA3.1)、miRNA-129-5p mimics+HDGF组(共转染miRNA-129-5p mimics和pcDNA3.1-HDGF),按照LipofectamineTM2000转染试剂使用说明进行转染,转染48 h后,qRT-PCR检测转染效果,蛋白质印迹法(Western blot)检测HDGF的蛋白表达情况。
1.3.3 CCK-8法检测细胞增殖能力将对数生长期的细胞以3×105/孔密度接种至96孔细胞板中,分别于12、24、36、48、60 h时取出细胞培养板,每孔加入20 μl的CCK-8溶液,采用酶标仪检测各组细胞在490 nm波长下的吸光度值。实验重复3次,取均值。
1.3.4 Transwell小室检测细胞迁移能力取对数生长期的细胞加入无血清的培养基调整细胞浓度。以3×104/孔密度接种至Transwell上室中,下室中加入600 μl含10%胎牛血清的培养基,于培养箱内培养24 h后,小心擦去上室中的细胞,以磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗后,分别用甲醇和0.5%结晶紫对细胞进行固定、染色。倒置显微镜观察A549和H1299细胞的迁移能力,随机选5个视野计算迁移和侵袭细胞数。
1.3.5 双荧光素酶报告基因实验检测miRNA-129-5p与HDGF基因的靶向关系生物信息学分析预测库预测miRNA-129-5p与HDGF3'-UTR存在结合位点。参照转染试剂说明书将构建好的野生型HDGF-3'-UTR-WT和突变型HDGF-3'-UTR-MUT的荧光素酶报告质粒及miRNA-NC、miRNA-129-5p mimics转染至A549和H1299细胞6 h后,更换新鲜培养液并继续培养至24 h,按照双荧光素酶报告基因检测试剂盒操作步骤检测各组细胞的荧光素酶活性。实验重复3次,取均值。
1.3.6 Westernblot检测蛋白表达情况采用快速蛋白提取试剂盒提取3例NSCLC组织、对应癌旁组织及A549和H1299细胞的总蛋白,并参照二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒检测总蛋白的浓度。经沸水浴变性后,取20 μg变性蛋白上样至12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶孔中进行电泳。经80 V电压电泳0.5 h后,换成120 V电压电泳1 h。采用湿转法将蛋白凝胶转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜后,置于含有5%去脂奶粉的封闭液中4℃下孵育过夜。以PBST洗膜后,再在4℃下将PVDF膜转入1∶2000稀释的一抗中反应过夜,经TBST洗膜后,加入1∶10 000稀释的二抗于37℃下孵育1 h。于暗室内滴加化学发光剂显影,以凝胶成像系统采集图像,Image J分析目的条带的灰度值,以β-actin为内参,以目的蛋白条带灰度值与β-actin灰度值的比值表示目的蛋白的相对表达情况。
1.4 统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织、癌旁组织及细胞中miRNA-129-5p表达水平的比较
NSCLC组织中miRNA-129-5p表达水平为(0.41±0.12),低于癌旁组织中的(1.17±0.33),差异有统计学意义(t=7.498,P<0.05)。miRNA-129-5p在16-HBE细胞中的表达水平为(0.97±0.08),A549细胞中为(0.37±.0.04),H1299细胞中为(0.39±0.03),H460细胞中为(0.68±0.06),与正常支气管上皮细胞株16-HBE相比,细胞株A549、H1299和H460中miRNA-129-5p的表达水平均降低,差异均有统计学意义(t=23.238、23.516、10.046,P<0.05)。因A549和H1299细胞中miRNA-129-5p表达水平更低,故后续选取A549和H1299细胞进行研究。
2.2 过表达miRNA-129-5p对NSCLC细胞增殖和迁移能力的影响
2.2.1 miRNA-129-5p转染效果将miRNA-129-5p mimics转染至A549和H1299细胞中,qRT-PCR检测结果显示,A549及H1299细胞中,miRNA-129-5p mimics组细胞中miRNA-129-5p表达均高于control组及miRNA-NC组,转染效果好。
2.2.2 CCK-8法检测 A549和H1299细胞的增殖情况结果显示,作用24、48 h后,与同时间miRNA-NC组相比,miRNA-129-5p mimics组细胞吸光度值均降低(P<0.05)。(表1)
2.2.3 Transwell小室检测细胞迁移情况结果表明,A549及H1299细胞中,miRNA-129-5p mimics组细胞的迁移数目均少于control组及miRNA-NC组。(图 1)
2.3 HDGF是miRNA-129-5p的靶基因
2.3.1 NSCLC组织及癌旁组织中HDGFmRNA及HDGF蛋白表达情况的比较NSCLC组织中HDGFmRNA及HDGF蛋白表达水平分别为(5.73±1.24)、(4.76±0.28),均明显高于癌旁组织的(1.30±0.26)、(1.18±0.12),差异均有统计学意义(t=24.724、83.099,P<0.01)。
2.3.2 16-HBE、 A549、H1299细 胞中HDGFmRNA及HDGF蛋白表达情况的比较A549和H1299细胞中HDGFmRNA分别为(5.36±0.54)、(6.33±0.63),均明显高于正常支气管上皮细胞株16-HBE的(1.20±0.12),差异均有统计学意义(P<0.01)。A549和H1299细胞中HDGF蛋白表达量分别为(4.71±0.47)、(5.42±0.54),均明显高于正常支气管上皮细胞株16-HBE的(1.00±0.10),差异均有统计学意义(P<0.01)。
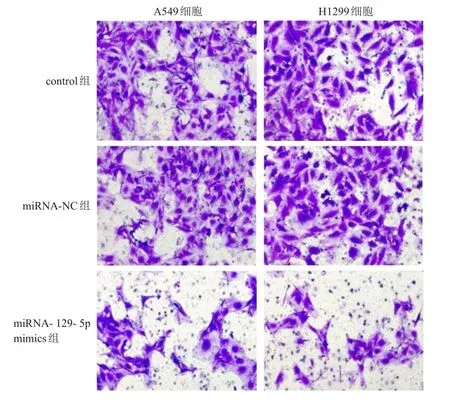
图1 Transwell法检测培养24h后control组、miRNA-NC组、miRNA-129-5p mimics组 A549和H1299细胞的迁移情况(结晶紫染色,×200)
2.3.3 双荧光素酶报告基因实验检测双荧光素酶活性结果显示,miRNA-129-5p mimics组A549、H1299细胞的HDGF-3'UTR-WT荧光素酶活性均明显低于miRNA-NC组,差异均有统计学意义(P<0.01),两组 A549、H1299细胞HDGF-3'UTR-MUT荧光素酶活性比较,差异均无统计学意义(P>0.05)。(表 2)
2.3.4 HDGF蛋白表达水平的比较miRNA-129-5p mimics组A549、H1299细胞中HDGF蛋白表达水平分别为(0.61±0.13)、(0.54±0.15),均明显低于miRNA-NC组的(1.35±0.12)、(1.26±0.23),差异均有统计学意义(P<0.01)。
2.4 沉默HDGF对NSCLC细胞增殖和迁移能力的影响
2.4.1 si-HDGF转染效果Western blot检测发现,与si-NC组相比,转染了干扰RNA的si-HDGF组A549和H1299细胞,HDGF蛋白表达下调。(图2)
表1 control组、miRNA-NC组、miRNA-129-5p mimics组 A549及 H1299细胞吸光度值的比较(±s)
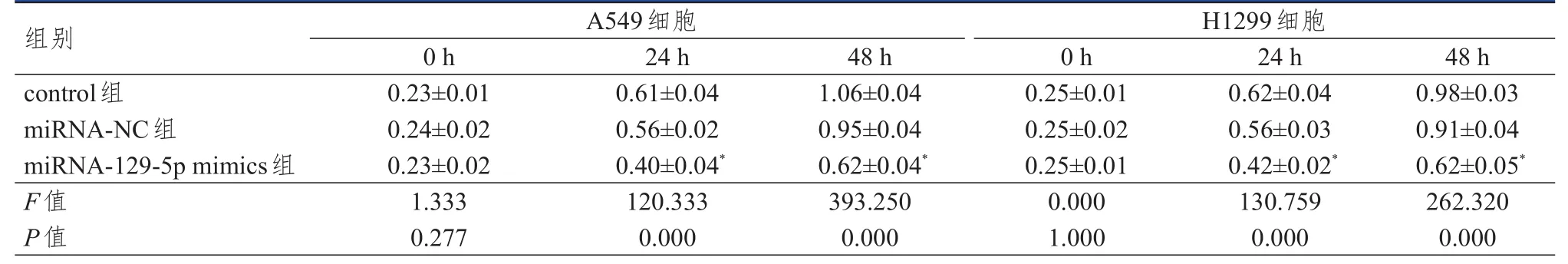
表1 control组、miRNA-NC组、miRNA-129-5p mimics组 A549及 H1299细胞吸光度值的比较(±s)
注:*与同时间miRNA-NC组比较,P<0.05
组别control组miRNA-NC组miRNA-129-5p mimics组F值P值0.23±0.01 0.24±0.02 0.23±0.02 1.333 0.277 0.61±0.04 0.56±0.02 0.40±0.04*120.333 0.000 1.06±0.04 0.95±0.04 0.62±0.04*393.250 0.000 0.25±0.01 0.25±0.02 0.25±0.01 0.000 1.000 0.62±0.04 0.56±0.03 0.42±0.02*130.759 0.000 0.98±0.03 0.91±0.04 0.62±0.05*262.320 0.000 A549细胞H1299细胞0 h 24 h 48 h 0 h 24 h 48 h
表2 miRNA-NC组、miRNA-129-5p mimics组 A549、 H1299细胞双荧光素酶活性的比较(±s)

表2 miRNA-NC组、miRNA-129-5p mimics组 A549、 H1299细胞双荧光素酶活性的比较(±s)
组别miRNA-NC组miRNA-129-5p mimics组t值P值0.99±0.04 0.41±0.03 34.800 0.000 1.00±0.06 1.01±0.07 0.325 0.749 0.99±0.07 0.37±0.03 24.423 0.000 1.00±0.04 1.02±0.05 0.937 0.363 A549细胞HDGF-3'UTR-WT HDGF-3'UTR-MUT H1299细胞HDGF-3'UTR-WT HDGF-3'UTR-MUT
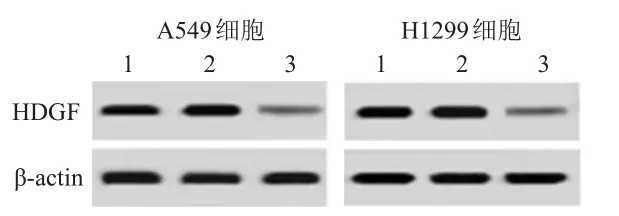
图2 Western blot检测control组、si-NC组、si-HDGF组A549、 H1299细胞中HDGF蛋白的表达情况
2.4.2 CCK-8法检测 A549和H1299细胞的增殖情况结果显示,作用24、48 h后,与同时间si-NC组相比,si-HDGF组细胞吸光度值均降低(P<0.05)。(表3)
2.4.3 Transwell小室检测细胞迁移情况结果表明,A549及H1299细胞中,si-HDGF组细胞的迁移数目均少于control组及si-NC组。(图3)

图3 Transwell法检测培养24h后control组、si-NC组、si-HDGF组 A549和 H1299细胞的迁移情况(结晶紫染色,×200)
2.5 miRNA-129-5p负调控HDGF对NSCLC细胞增殖和迁移能力的影响
2.5.1 CCK-8法检测 A549和H1299细胞的增殖情况作用24、48 h后,与同时间miRNA-129-5p mimics+NC组相比,miRNA-129-5p mimics+HDGF组A549、H1299细胞的吸光度值均明显增加,差异均有统计学意义(P<0.01)。(表4)
2.5.2 Transwell小室检测细胞迁移情况用结晶紫对迁移细胞染色,结果发现,与miRNA-129-5p mimics+NC组相比,miRNA-129-5p mimics+HDGF组A549和H1299细胞的迁移显著增加。(图4)
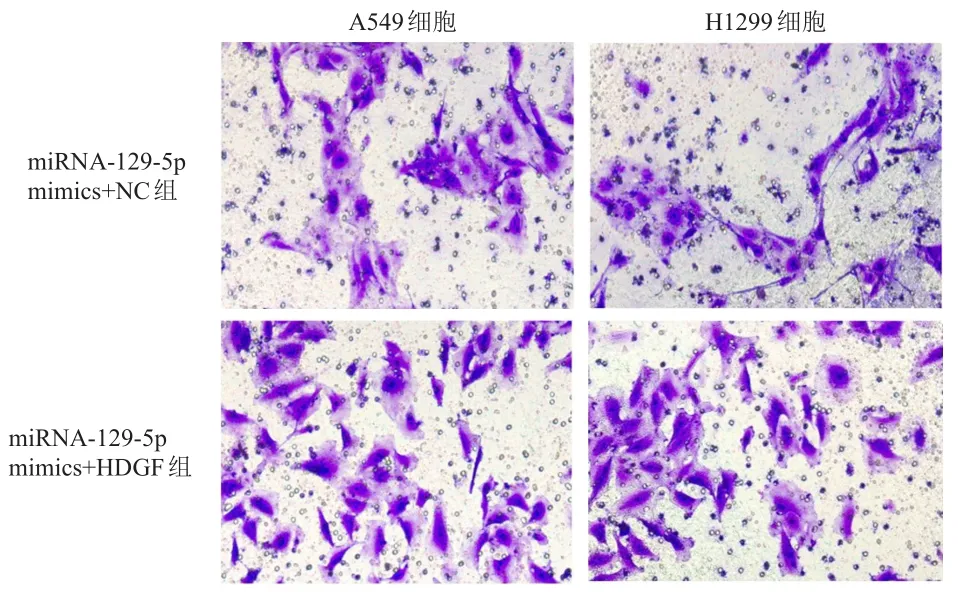
图4 Transwell法检测培养24h后miRNA-129-5p mimics+NC组与miRNA-129-5p mimics+HDGF 组 A549和H1299细胞的迁移情况(结晶紫染色,×200)
3 讨论
研究表明,miRNA-129-5p在多种肿瘤中能够发挥抗肿瘤作用,如Diao等[6]发现miRNA-129-5p能够通过负调控转化生长相互作用因子2(transformation growth interacting factors 2,TGIF2)的表达抑制胶质瘤细胞的增殖、迁移、侵袭与凋亡;Chen等[13]发现miRNA-129-5p通过溶质载体家族2,促进溶质载体家族2成员3(solute carrier family 2 member 3,SLC2A3)蛋白调节胃癌细胞的糖酵解和细胞增殖;Brest等[14]报道miRNA-129-5p在甲状腺癌组织中表达降低;路璐等[15]发现miRNA-129-5p可明显增强紫杉醇抑制乳腺癌MCF-7细胞增殖和诱导细胞凋亡的能力。此外,Ma等[16]发现miRNA-129-5p通过其靶基因delta类似非经典Notch配体1(delta like non-canonical Notch ligand 1,DLK1),抑制NSCLC细胞的耐药性,并且通过靶向基质金属蛋白酶 9(matrix metalloprotein 9,MMP9)、微球蛋白1(microspherule protein 1,MCRS1)等调控NSCLC的增殖和侵袭,表明miRNA-129-5p在NSCLC细胞中能够发挥抑癌作用。本研究通过qRT-PCR检测发现,3株NSCLC细胞株A549、H460和H1299中miRNA-129-5p均低表达,后续实验选择miRNA-129-5p低表达较为显著的A549和H1299细胞作为研究对象,miRNA-129-5p mimics转染上调miRNA-129-5p的表达,CCK-8和Transwell实验检测其对A549和H1299细胞的增殖和迁移能力的影响,结果发现,过表达miRNA-129-5p可以显著抑制细胞增殖和迁移能力,提示miRNA-129-5p在NSCLC中能够发挥抑癌作用。
表3 control组、si-NC组、si-HDGF组 A549、 H1299细胞吸光度值的比较(±s)
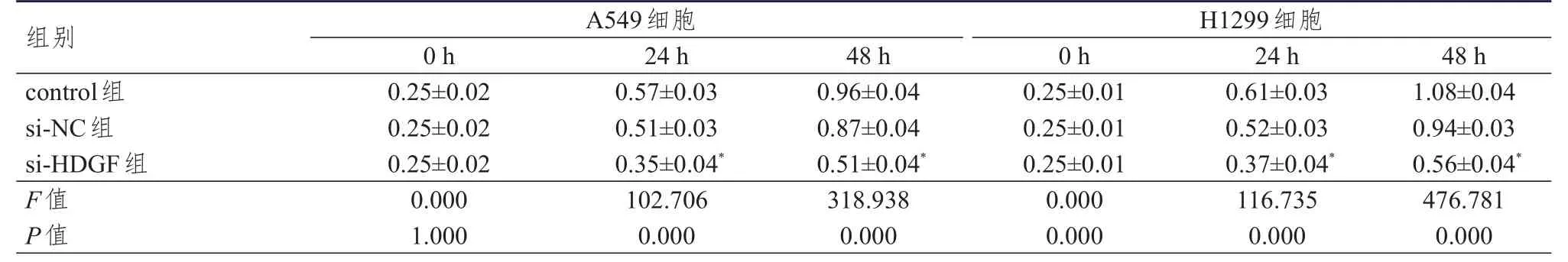
表3 control组、si-NC组、si-HDGF组 A549、 H1299细胞吸光度值的比较(±s)
注:*与同时间si-NC组比较,P<0.05
组别control组si-NC组si-HDGF组F值P值0.25±0.02 0.25±0.02 0.25±0.02 0.000 1.000 0.57±0.03 0.51±0.03 0.35±0.04*102.706 0.000 0.96±0.04 0.87±0.04 0.51±0.04*318.938 0.000 0.25±0.01 0.25±0.01 0.25±0.01 0.000 0.000 0.61±0.03 0.52±0.03 0.37±0.04*116.735 0.000 1.08±0.04 0.94±0.03 0.56±0.04*476.781 0.000 A549细胞H1299细胞0 h 24 h 48 h 0 h 24 h 48 h
表4 miRNA-129-5p mimics+NC 组与miRNA-129-5p mimics+HDGF 组 A549、 H1299细胞吸光度值的比较(±s)

表4 miRNA-129-5p mimics+NC 组与miRNA-129-5p mimics+HDGF 组 A549、 H1299细胞吸光度值的比较(±s)
组别miRNA-129-5p mimics+NC组miRNA-129-5p mimics+HDGF组t值P值0.25±0.03 0.24±0.03 0.707 0.490 0.40±0.06 0.53±0.05 4.993 0.000 0.67±0.03 0.99±0.05 16.464 0.000 0.25±0.03 0.26±0.03 0.707 0.490 0.36±0.05 0.47±0.03 5.3660 0.000 0.61±0.04 0.87±0.05 12.182 0.000 A549细胞H1299细胞0 h 24 h 48 h 0 h 24 h 48 h
有研究报道HDGF广泛存在于多种正常组织及恶性肿瘤中,具有促进细胞增殖和新生血管生成的作用[17],与多种恶性肿瘤的生长、侵袭、转移以及预后密切相关。先前有研究发现HDGF在NSCLC组织中高表达,miRNA-195[18]和miRNA-497[19]能够靶向调控HDGF从而抑制肺癌细胞的增殖和迁移。但是关于miRNA-129-5p是否能够通过调控HDGF从而进一步影响NSCLC细胞的增殖和迁移,目前仍不清楚。本研究通过靶基因预测软件检测发现miRNA-129-5p与HDGF3'-UTR存在互补的核苷酸序列,推测HDGF可能是miRNA-129-5p的潜在靶基因,miRNA-129-5p可能通过靶向HDGF参与NSCLC的发生发展。双荧光素报告基因实验证实了HDGF是miRNA-129-5p的靶基因,过表达miRNA-129-5p可以抑制HDGF的表达。沉默HDGF可以抑制NSCLC细胞A549和H1299的增殖和迁移能力,与过表达miRNA-129-5p结果一致,提示HDGF在NSCLC细胞A549和H1299的增殖和迁移过程中具有重要作用。此外,共转染miRNA-129-5p mimics和pcDNA3.1-HDGF后发现,HDGF可部分逆转miRNA-129-5p对NSCLC细胞A549和H1299增殖和迁移的抑制作用,提示miRNA-129-5p可以通过负调控HDGF表达参与其中,表明miRNA-129-5p能够靶向调控HDGF的表达从而影响NSCLC细胞A549和H1299的增殖和迁移能力。
miRNA-129-5p在NSCLC中的作用已有报道[20],但是以miRNA-129-5p为NSCLC治疗靶点的理论依据还不充足。miRNA-129-5p调控NSCLC的机制十分复杂,本研究发现miRNA-129-5p可通过下调HDGF的表达抑制NSCLC细胞A549和H1299的增殖和迁移,但其下游可能存在的信号通路仍需进一步研究。本实验结果为NSCLC的诊断和治疗提供了新的科学依据,后期将会继续致力于miRNA-129-5p对NSCLC调控机制的研究。
